树枝状大分子在传感器中的应用
2011-06-26陈少珠杨园园李冰心侯静亚
陈少珠,杨园园,李冰心,侯静亚,徐 岚
(发光与实时分析教育部重点实验室,西南大学化学化工学院,重庆400715)
0 引言
传感器是能感受规定的被测量信号并按照一定规律将其转换成可测信号 (主要是电信号)的器件或装置,它通常由敏感元件(敏感结构材料和载体)、转换元件及检测器件所组成。其中敏感元件是传感器的核心,它决定传感器的选择性、灵敏度、线性度、稳定性等。因此,选择并优化新功能材料的开发和应用一直是传感器研究的热点。在这方面,树枝状大分子由于其优越的性能而广泛地应用于传感器。
1985年,美国DOW化学公司Tomalia等[1~2]首次合成了一种可围绕中心核进行星状发散式增长的分子,即所谓的“星爆状(Starburst)”树枝状大分子,后来简称为树枝状大分子(Dendrimer),由于其具有特殊的结构和优异的物理化学性能,因此树枝状大分子的研究和应用取得了许多进展。树枝状大分子作为传感器的载体材料具有如下优点:
(1)树枝状大分子是一类三维的、高度有序的单分散性大分子化合物[3~4]。
(2)完整的树枝状分子由中心核、数层重复树枝单元和大量外围基团所组成,具有内外受体的能力,其大量的外围基团可提供更多的活性位点,从而提高了传感器的灵敏度。
(3)树枝状大分子由于反应步骤的可控制性从而具有高度分支的精确结构,因此大大提高了传感器的重现性。
(4)树枝状大分子具有良好的生物兼容性,可以直接和酶等试剂进行共价结合。另外,可以改变其外围的功能基,用于检测不同的分析对象,从而扩大了分析的范围。
目前,研究工作主要构建不同代(G)的聚丙烯胺树枝状大分子(Polypropyleneimine dendrimers,PPI)和聚酰胺-胺树枝状大分子(Polyamidoamine dendrimer,PAMAM)、 碳硅烷类树枝状大分子和硅氧烷类树枝状大分子及其衍生物作为传感器的载体,树枝状大分子由于具有较好的稳定性和生物兼容性,可方便地沉积在各种基片上,并且可与其它功能材料共聚或复合等优点,因而受到传感器研究者的青睐。其中由于聚酰胺-胺(PAMAM)(图1)树状大分子既具有树状大分子的共性,又有自身特点。它精确的分子结构,大量的表面官能团,分子内存在空腔,相对分子质量具有可控性,分子量分布可达单分散性,分子本身具有纳米尺寸,高代数分子呈球状等优点。 因而是目前研究最广泛,最深入的树状大分子之一。该文主要综述了近年来树枝状大分子传感器特别是生物传感器的研究进展,并对树枝状大分子的研究动向作了展望。
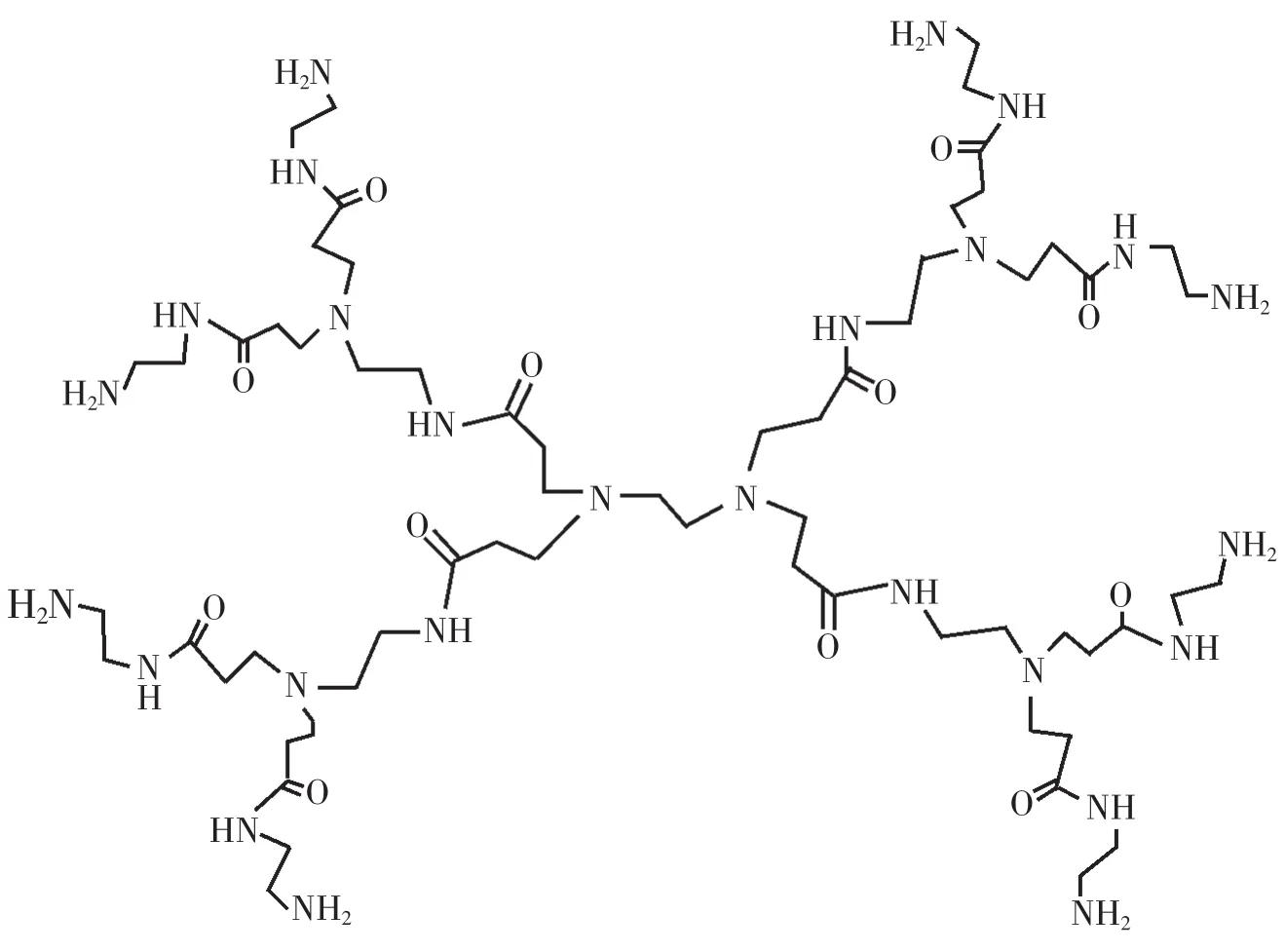
图1 PAMAM的结构Fig.1 Structure of PAMAM
1 树枝状大分子固载到基底的方法
从树枝状大分子和固体基底的相互作用方式看,有静电作用力、共价键作用、氢键和范德华作用力,目前以静电作用和共价键作用居多。
1.1 静电作用力结合
早在几年前,Tsukruk等[5]提出树枝状大分子可以通过静电作用自组装到电荷化的基底形成完全的、均匀的薄膜。如图2所示,带负电的硅基底或者先组装了有机小分子带上正电的硅基底可以通过静电作用力吸附带异性电荷的树枝状大分子。这类树枝状大分子以PAMAM为代表,通过此类方法制备出的PAMAM树枝状大分子代数为 G4,G6,G10的自组装膜[6~7]。
在很多情况下,树枝状大分子通过与金属离子静电作用吸附在自组装膜 (self-assembly monolayers,SAMs)上[8~10]。 Regen 等[8]利用整代的PAMAM树枝状分子的胺端基,将其沉积到用Pt2+离子活化的表面,重复这一过程即得到多层膜结构。Schryver等[9]通过Cu2+离子把G2Td(COOH)16(末端基团为羧基的聚苯撑树枝状化合物)吸附到Au的SAM上。末端为COOH的SAM在碱溶液中生成COO-,然后Cu2+离子通过静电作用(-COO-…Cu2+)强烈地吸附在SAM上,再将其浸入加有KOH的Td(COOH)16的溶液中,碱的加入既破坏分子间的氢键,又使Td(COOH)16被中和而带上负电荷,可以通过静电力使树枝状分子吸附到SAM上,重复几次,就可形成树枝状分子吸附多层膜。
1.2 共价键结合
以共价键结合的制备方式通常需要一个中间媒介,一般先在基底上形成有机单分子自组装膜,然后利用自组装的末端官能团和树枝状大分子反应生成共价键。这一方面,Crooks工作小组较早地进行了相关研究并取得了很多成果。
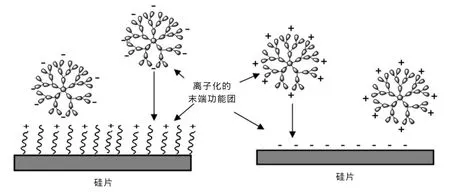
图2 通过静电作用力树枝状大分子的自组装的一般过程Fig.2 The general process of self-assembly of dendritic macromolecules by electrostatic interaction
树枝状大分子可以通过多个作用点接在SAM 表面上(如图3i)[11]。 例如,ω-巯基十一烷酸(MUA)在Au表面的自组装膜末端的羧基功能团可以和末端是胺基的树枝状化合物PAMAM反应生成酰胺共价键[12]。Crooks最初研究表明树枝状大分子以图3i所示方式的结合容易造成化合物的形变。另外,末端活性基团密度大小(如图3ii所示)的结合避免了化合物的形变。例如,MUA与十二硫醇两种有机分子形成混合自组装膜,由于表面的SAM末端-COOH官能团一部分被甲基所取代,大大的稀释了-COOH在表面的浓度[13],导致末端羧基只能和每个树枝状大分子中的一个或者少数几个官能产生共价键,这就避免了化合物的形变。
树枝状化合物也能直接固定在Au表面而不需要表面先固定上一层有机小分子[14~18](如图3iii)。张希等[14]先合成带有硫醇官能团的Frechet类型树枝状化合物,硫醇官能团能直接组装到金属表面。Won[15]和Evenson[17]研究小组在大分子基底上制备PAMAM薄膜。Won首先在空气或者马来酸酐环境中对聚二甲基硅烷(PDMS)表面进行等离子体处理,使表面接上过氧键或酸酐等官能团,胺基结尾PAMAM再直接与表面反应,形成稳定的薄膜。这类薄膜对气体的渗透有明显的阻碍作用,同时也可用来制备粘合性的功能化表面。
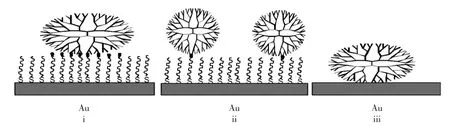
图3 三种共价键结合的形式Fig.3 Three kinds of forms by covalent bonds
2 树枝状大分子在生物传感器中的应用
2.1 生物传感器的工作原理
树枝状大分子的生物传感器主要是以树枝状大分子作为载体固定生物活性成分(酶、抗原、抗体、微生物等),并将其固定在活化的基质上作为敏感元件,再与适当的信号转换和检测装置结合而成的器件。
2.2 DNA生物传感器
2005年,Rosi和Mirkin发表了一些关于树枝状大分子在DNA微阵列和生物传感器中应用的评论[19]。工作原理是通过共价作用在载玻片上固载核苷酸,分析荧光标记核酸的混合物,所具有的荧光能够对DNA链的杂交作用进行定量。目前,将树突生长在载玻片上的方法[20]已经得到较大地改进[21~22]。 在 2001 年,Niemeyer研究小组[23]开辟了PAMAM树枝状大分子的领域并获得了稳定的荧光强度,与非树枝状交联剂相比,荧光强度显著地增加。期间,PPI树枝状大分子也在这方面得到应用[24]。随后,当使用更高代的带有末端醛的树枝状大分子和胺化的载玻片时,强度增加更大并具有较高的灵敏度[25~28]。Lim研究小组[28]将抗生素蛋白修饰的树枝状G3-PAMAM与生物素结合的复合物固载到载玻片上,并用AFM,SEM对较低浓度的DNA进行检测,结果表明增加了荧光标记的目标DNA的灵敏度。Reinhoud研究小组[29~30]也报道了一种精美的图形方法包括微印刷邮票,这种方法提出了微阵列复制。该邮票用PPI树枝状大分子喷黑,并用荧光素标记的DNA孵化(培养),然后洗掉在载玻片上印刷后的树枝状大分子,这样图案化了的DNA微阵列能够进行荧光分析。
带正电树枝化大分子和寡核苷酸之间通过静电作用的也有研究,这种研究本质上可直接用于基因转移[31]。关于不同的物理方法的相互作用[32~37]在 2001 年 Florence 也发表了评论[32]。
2.3 三磷酸腺苷(ATP)传感器
ATP是DNA的一个片段,是一种细胞的能量的来源和细胞的信使者。它能用阳离子传感器通过静电连接作用识别。如二茂铁基[38]或二茂钴基[39]氧化还原系统。其阳离子形式能够和ATP的阴离子基形成了离子对。然而,如果这种传感器是线性的,这种相互作用太弱而不能引起氧化还原电位较大的变化。端基为二茂铁基的树枝状大分子显示了一种正树枝效应,如在CV中,当ATP加入到低代或高代的端基为二茂铁基的树枝状大分子中时,一种新的二茂铁基氧化还原峰出现在较低的正电位下。因此,在端基为二茂铁基树枝状大分子离子对中,二茂铁基通过烷基链简单地连接到核中并在树枝状大分子内部参与了对ATP的包裹,与具有线性的烷基二茂铁相比,引起了较强的相互作用,这能够对ATP溶液进行滴定分析[40]。
引入其他的超分子也能够增强在ATP磷酸基和二茂铁部分离子的相互作用。比如,包含末端硅基二茂铁基的金纳米核树枝状大分子显示了一种增强的相互作用,当存在和不存在ATP时二茂铁基树枝状大分子之间引起较大的电位差[41~43]。这可能是由于在硅二茂铁形式下硅原子较高的价态引起的。因此,尽管硅原子在四等硅烷基中没有氧的亲和力,但在硅二茂铁中硅的部分正电荷导致了硅的高价态[44~49]。另外一种超分子相互作用在三唑基二茂铁基[50]或者三唑基甲基二茂铁树枝状大分子[41]中,通过唑基末端与乙炔基二茂铁反应或者炔末端树枝状大分子和唑甲基二茂铁反应,提供了温和的电化学识别和ATP的滴定反应。Beer研究小组[51~53]开创了通过电子受体对二氢磷酸识别,并在1997年是第一例公开发表的对二氢磷酸具有识别能力的树枝状电子受体。与此同时,一种动态的正树枝状效应使用端基为氨基二茂铁基的树枝状大分子,当树枝状大分子代数较高时具有较大的氧化还原电位差,识别较容易。氨基能够引起较大的氧化还原电位差,是由于氨基与二氢磷酸的两个氢键之间的协同作用[47]。Alonso等[48]报道了端基为二茂铁碳酰胺的树枝状大分子能够成功地对氢磷酸检测,并且以无机钼簇为核的末端硅二茂铁树枝状大分子也能够对ATP进行检测[49]。
另外,尺寸较大的二茂铁树枝状大分子的优势是它比较容易地全部吸附在Pt电极上,通过衍生化的树枝状大分子电极更方便检测,电极能够允许ATP的洗脱和电极传感器的再使用。这也是Au纳米核树枝状大分子的一个优点[44~45]。二氢磷酸阴离子是很好的ATP模式,但端基为二茂铁基树枝状大分子对二氢磷酸阴离子的检测比对ATP较容易些[46]。然而,具有较大尺寸的末端[Fe4Cp4(CO)4]簇代替了末端二茂铁,与二茂铁末端(FeⅢ/Ⅱ)相比,ATP 的识别较容易并观察到了[Fe4Cp4(CO)4]+/0具有较大的氧化还原电位变化,那是因为较大的[Fe4Cp4(CO)4]簇与ATP大小更匹配[54]。
2.4 葡萄糖传感器
葡萄糖生物传感器已经广泛地形成并对糖尿病人的血糖进行监测。Losada等[55]研究了硅二茂铁基树枝状大分子作为电子媒介体在安培传感器中的应用。结果表明了当加入葡萄糖时,树枝状载体和葡萄糖氧化酶修饰的碳糊电极能够快速地识别并具有稳态的安培响应。后续的主要工作,Losada小组也发展了其他树枝状大分子的电化学方法,如以PPI为核的聚甲基二茂铁基树枝状大分子沉积到Pt电极上,研究了膜厚度和浓度的影响,通过氧化酶催化定量了H2O2的产生。另外,H2O2和乳酸氧化酶的酶电极也被研究[56~59]。链激酶、葡萄糖氧化酶和磷酸胆碱固载到聚甘油树枝状大分子上,该生物共轭结构能够对葡萄糖进行检测。这种材料作为葡萄糖氧化媒介体并用于优越的氧化还原酶可移植的生物传感器中[60]。其他的葡萄糖氧化酶-葡萄糖生物传感系统包括Pt纳米-多壁碳纳米管和树枝状大分子金纳米膜。通过引入氧化还原电子媒介体,具有高容量的膜基质对于酶的固载具有环境稳定性[61]。
基于荧光非电化学法能够对葡萄糖进行检测。Lee等[62]报道了基于荧光卟啉树枝状大分子的蛋白质共轭葡萄糖敏感表面。与非树枝状表面相比,树枝状大分子表面蛋白质活性更高,葡萄糖氧化酶介导的葡萄糖氧化反应会引起卟啉核荧光猝灭,猝灭光和葡萄糖的浓度成定量关系。该方法的优势在于树枝状大分子修饰表面提供三维骨架,具有大量的功能基能够高密度的固载蛋白质并很好的保持了蛋白质的活性,很好的用于目标物的分析。
2.5 抗体和抗原生物传感器
基于高特异性识别的免疫传感器广泛地应用在临床诊断、环境监测、食品安全分析等领域。免疫传感表面可逆的亲和作用基于功能性抗原和抗体分子间的生物特异的结合和可移动的反应。一个典型的抗原和抗体例子是生物素和抗生素系统。Yoon等[63]研究了具有功能化二茂铁基和生物素化的PAMAM树枝状大分子,功能化的单层对具有单克隆抗生素免疫球蛋白特异性识别提供了一个平台,具有末端功能化二茂铁基作为电子媒介体。
另外,一种新颖的电化学免疫传感器对苯并芘的检测使用PAMAM树枝状大分子和功能化的亚甲基蓝/SiO2纳米粒子连接的葡萄糖氧化酶和葡萄糖二抗结合体,较大的增强了苯并芘分析的灵敏度。G2的PAMAM树枝状大分子的修饰增加了功能基苯并芘抗原的固载量。亚甲基蓝/SiO2纳米粒子连接的葡糖糖氧化酶用作免疫传感器的检测标记,得到的传感器显示了相对较宽的线性范围和较低的检出限[64]。该设计对一些污染物环境监测具有很好的应用前景。
在临床中免疫测定促进了灵敏和特异的技术的发展,能够在样品中检测特异抗原的存在。比如,非竞争荧光免疫检测通过PAMAM皮质醇-树枝状大分子俘获抗体的非连接位点[65],能够对皮质醇进行分析。树枝状纤维素能够作为对人工抗原的支架,在人类中提供了对发展临床测试材料的工具,它能够研究对药物的反免疫学响应[66]。免疫治疗法研究阿尔茨海默病,β-淀粉样蛋白斑特异抗原决定簇识别治疗阿尔茨海默痴呆病的抗体,对疫苗的发展提供了基础。因此,由一种淀粉样蛋白斑特异的抗原决定簇构成的生物结合的设计目前也已报道[67]。
3 树枝状大分子在离子传感器中的应用
离子传感器也称离子选择性电极。膜的电极电位分别对被测离子存在Nernst响应,根据这些原理可制成相应的离子电位传感器。后来研究发现以树枝状大分子为载体的传感器对某些离子也有响应,制成了离子传感器,其机理为离子识别实际上主客体之间通过非共价相互作用的过程,主体分子具有特定的分子几何结构能够选择性与客体分子互补,从而与目标离子形成相对较强的作用力实现对离子的检测。最近发现许多功能化的树枝状大分子探测许多金属离子,它们在痕量金属离子的探测、污水处理、乃至重金属离子传感器等方面都显示出巨大的应用前景。Zhang等[68]研究了基于丹酰化的8-羟基喹啉为核的PAMAM树枝状大分子的荧光传感器用于对Fe3+进行检测,结果表明G3的树枝状大分子比G1和G2具有较高的灵敏度,并且该传感器对Fe3+具有较好的选择性和灵敏度。Gupta等[69]研究了基于G2的硅氧烷类树枝状大分子为载体的Li+选择性电极电位传感器对Li+的识别具有较好的选择性,并且在一价、二价、三价的阳离子的存在下不对Li+造成干扰。端基为三乙二醇醚的碳硅烷树枝状大分子作为离子载体对K+的识别,该电极对K+具有较宽的线性范围并且响应时间较快[70]。Lopez等[71]构建了G4六氰合铁酸镍PAMAM树枝状大分子修饰的金电极用于水溶液中K+的检测,该活性表面不仅能够增加六氰合铁酸镍的表面覆盖量,而且可以在水溶液中定量K+的浓度变化。另外,Sethi等[72]研究了末端硅冠的碳硅烷树枝状大分子为载体的PVC膜并对Na+进行检测,该传感器对碱离子,碱土金属离子,重金属离子具有较好的选择性和较宽的线性范围。以15-冠-碳硅烷树枝状大分子为载体的离子传感器用于NH4+的检测,响应时间为6 s左右[73]。因此,以树枝状大分子为载体的离子传感器不仅可以提高选择性,而且增加了被测离子的灵敏度。
另外,由于阴离子在生物体和环境保护中的重要性,对阴离子的识别也引起了广泛的兴趣,其代表之一是二茂铁树枝状大分子,由于二茂铁有良好的稳定性、电化学性质及反应活性,因此作为阴离子受体的二茂铁基化合物对阴离子的检测方面得到了应用。如,Cuadrado等[74]研究了硅二茂铁树枝状大分子具有的四面体的空腔对识别四面体的H2PO4-和HSO4-更有利,而Stone和Smith[75]以二茂铁为核的树枝状大分子一种选择性识别趋势为Cl->Br->I-。然而,为了在实际中得到广泛的应用,二茂铁树枝状大分子传感器的灵敏度和选择性有待进一步提高。目前许多检测都在有机溶剂中开展而在水溶液中检测阴离子还很困难,这将是一个进一步研究的课题。
4 树枝状大分子在气体传感器中的应用
树枝状大分子气体传感器的研究近年来得到了很大的发展,这是由于树枝状大分子气体传感器具有高灵敏度、高选择性等优点,因而也成为气体传感器研究领域的热点,并已经广泛应用于环境等实际应用研究中。其检测原理是:树枝状大分子气体传感器是以树枝状大分子为载体,为目标分子的选择性吸附提供位点,通过检测相互作用导致的物性变化(如导电率变化)而得知检测气体分子存在的信息。
通过层层自组装构建含有金纳米粒子的树枝状薄膜,它们有效地作为具有导电率测试的阻抗器对甲苯、丙醇和水蒸气进行检测,膜的选择性基于树枝状大分子的溶解特性[76]。基于PAMAM树枝状大分子薄膜具有高CO2/N2选择性,对 CO2进行分离[77~78]。 Gao 等[79]研究了炭黑-树枝状复合物能够检测挥发性的有机胺和羧酸,与非树枝状绝缘炭黑复合物相比,末端氨基或羧基修饰的树枝状炭黑复合物能够增加对挥发性羧酸和胺检测的灵敏度。Duan等[80]在壳聚糖层中将玻璃酸加入到PAMAM树枝状大分子组成膜中,它能够增加膜的溶胀度从而提高CO2的分离性能。一种硅醚树枝状金纳米复合物用作CO传感器,CO的浓度与电流成正比[81]。G0-G8PAMAM树枝状大分子膜也能够对具有挥发性的不同功能基的有机化合物进行检测。研究发现G4是最优的一代,原因可能由于它是最小的球形代并具有易进入的内腔。另外,Liang等[82]设计了在功能化的SBA-15上逐步生长末端氨基的三聚氰胺树枝大分子的方法并用做CO2吸附剂,CO2的吸附能力得到增强。
5 树枝状大分子在传感器中的研究展望
树枝状大分子材料的出现为传感器的设计制作引发了新的思路,特别是在生物传感器、气体传感器和离子传感器方面具有广阔的应用前景。以下几个方面是未来树枝状大分子可能的发展方向。
(1)开发和制备新的、多功能的树枝状大分子,研究和开发其新的优异性能,是今后研究的主流之一。
(2)多功能树枝状大分子阵列及其微型化的研究。
(3)高选择性的分子印迹树枝状大分子传感器是很有前景的研究方向,现已有报道[83~85]。树枝状大分子作为主体分子和客体分子相互作用,在环境、医疗、催化、材料科学等领域的实际应用还需要进一步研究。
(4)树枝状大分子能够作为支架、稳定纳米粒子,合适的支架能够获得耐压纤维、纳米胶、纳米管并将其应用在航空电子设备、半导体、发光二极管、粘合剂等领域,目前仍是一个难题。
[1]Tomalia D A,Dewald J R.US Patent[P]us:4 507 466,1985.
[2]Tomalia D A,Dewald J R.US Patent[P]us:4 568 737,1986.
[3]Newkome G R,He E,Moore C N.Suprasupermolecules with novel properties:metallodendrimers[J].Chem Rev,1999,99:1 689~1 746.
[4]Astruc D,Chardac F.Dendritic catalysts and dendrimers in catalysis[J].Chem Rev,2001,101:2 991~3 024.
[5]Tsukruk V V,Rinderspacher F,Bliznyuk V N.Selfassembled multilayer films from dendrimers[J].Langmuir,1997,13:2 171~2 176.
[6]Decher G.Fuzzy nanoassemblies:Toward layered polymeric multicomposities[J].Science,1997,277:1 232~1 237.
[7]Tsukruk V V.Assembly of supramolecular polymers in ultrathin films[J].Progr Polymer Sci,1997,22:247~3l1.
[8]Walanabe S J,Regen S L.Dendrimers as bluilding block for multilayer construction[J].J Am Chem Soc,1994,116:8 855~8 856.
[9]Zhang H,Grim P C M,Liu D,et al.Probing carboxylic acid groups in replaced and mixed self-assembled monolayers by individual ionized dendrimer molecules:an atomic force microscopy study[J].Langmuir,2002,18:1 801~1 810.
[10]Cheng L,Cox J A.Preparation of muhilayered nanocomposites of polyoxometalates and poly(amidoamine)dendrimers[J].Electrochem Commun,2001,3:285~289.
[11]WeHs M,Crooks R M.Interactions between organized,surface-confined monolayers and vapor-phase probemolecules.10.preparation and properties of chemically sensitive dendrimer surfaces[J].J Am Chem Soc,1996,l18:3 988~3 989.
[12]Zhu N N,Gu Y F,Chang Z,et al.PAMAM Dendrimers-Based DNA Biosensors for Electrochemical Detection ofDNA Hybridization[J].Electroanalysis,2006,18:2 107~2 114.
[13]Tokuhisa H,Crooks R M.Interactions be tween organized,surface-confined monolayers and vapo r-phase probe molecules.12.Two new methods for surface.immobilizationand functionalization of chemically sensitive dendrimer surfaces[J].Langmuir,1997,13:5 608~5 612.
[14]Zhang L,Huo F W,Wang Z Q,et a1.Investigation into seIf-assembled monolayers of a polyether dendron thiol:chemisorption,kinetics and patterned surface[J].Langrnuir,2000,16:3 813~3 817.
[15]Cha B J,Kang Y S,Won J.Preparation and characterization of dendrimer layers on poly(dimethylsiloxane)films[J].Macromalecules,2001,34:6 631~6 636.
[16]Rahman K M A,Duming C J,Turro N J,et a1.Adsorption of poly(amidoamine)dendrimers on gold[J].Langrnuir,2000,16:10 154~10 160.
[17]Fail C A,Evenson S A,Ward L J,et a1.Controled attachment of PAMAM dendrimers to solid surfaces[J].Langrnuir,2002,18:264~268.
[18]Tokuhisa H,Zhao M,Baker L A,et al.Preparation and characterization of dendrimer monolayers and dendrimeralkanethiolmixed monolayers adsorbed to gold[J].J Am Chem Soc,1998,120:4 492~4 501.
[19]Rosi N L,Mirkin C A.Nanostructures in biodiagnostics[J].Chem Rev,2005,105:1 547~1 562.
[20]Beier M,Hoheisel J D.Versatile derivatisation of solid support media for covalent bonding on DNA-microchips[J].Nucleic Acids Res,1999,27:1 970~1 977.
[21]Oh S J,Ju J,Kim B C,et al.DNA microarrays on a dendron-modified surface improve significantly the detection of single nucleotide variations in the p53 gene[J].Nucleic Acid Res,2005,33:e90.
[22]Hong B J,Sunkara V,Park J W.DNA microarrays on nanoscale-controlled surface[J].Nucleic Acid Res,2005,33:e106.
[23]Benters R,Niemeyer C M,Wohrle D.Dendrimer-activated solid supports for nucleic acid and protein microarrays[J].ChemBioChem,2001,2:686~694.
[24]Talor S,Smith S,Windle B,et al.Impact of surface chemistry and blocking strategies on DNA microarrays[J].Nucleic Acids Res,2003,31:e87.
[25]Trevisol E,Leberre-Anton V,Leclaire J,et al.Dendrislides,dendrichips:a simple chemical functionalization of glass slides with phosphorus dendrimers as an effective means for the preparation of biochip s[J].New J Chem,2003,27:1 713~1 719.
[26]Le Berre V,Trevisol E,Dagkessamanskaia A,et al.Dendrimeric coating of glass slides for sensitive DNA microarrays analysis[J].Nucleic Acids Res,2003,31:e88.
[27]Chaize B,Nguyen M,Ruysschaert T,et al.Microstructured liposome array[J].Bioconjugate Chem,2006,17:245~247.
[28]Lim S B,Kim K W,Le C W,et al.Improved DNA chip with poly(amidoamine)dendrimer peripherally modified with biotin and avidin[J].Biotechnol Bioprocess Eng,2008,13:683~689.
[29]Rozkiewicz D I,Brugman W,Kerkhoven R M,et al.Dendrimer-mediated transfer printing of DNA and RNA microarrays[J].J Am Chem Soc,2007,129:11 593 ~11 599.
[30]Rozkiewicz D I,Gierlich J,Burley G A,et al.Transfer Printing of DNA by “Click” Chemistry[J].Chem-BioChem,2007,8:1 997~2 002.
[31]Ritort F,Mihardja S,Smith S B,et al.Condensation transition in DNA-polyaminoamide dendrimer fibers studied using optical tweezers[J].Phys Rev Lett,2006,96:118 301~118 304.
[32]Al-Jamal K T,Ramaswany C,Florence A T.Supramolecular structures from dendrons and dendrimers[J].Adv Drug Delivery Rev,2005,57:2 238~2 270.
[33]Kim B S,Lebedeva O V,Koynov K,et al.Effect of dendrimergeneration on the assembly and mechanical properties of DNA/phosphorus dendrimermultilayer microcapsules[J].Macromolecules,2006,39:5 479~5 483.
[34]Maiti P K,Bagchi B.Structure and dynamics of DNA-dendrimer complexation: role of counterions,water,and base pair sequence[J].Nano Lett,2006,6:2 478~2 485.
[35]Kostiainen M A,Szilvay G R,Smith D K,et al.Multivalent Dendrons for High‐Affinity Adhesion of Proteins to DNA[J].Angew Chem,Int Ed,2006,45:3 538~3 542.
[36]Kostiainen M A,Smith D K,Ikkala O.Optically Triggered Release of DNA from Multivalent Dendrons by Degrading and Charge-Switching Multivalency[J].Angew Chem,Int Ed,2007,46:7 600~7 604.
[37]Su C J,Liu Y C,Chen H L,et al.Two-dimensional densely packed DNA nanostructure derived from DNA complexation with a low-generation poly(amidoamine)dendrimer[J].Langmuir,2007,23:975~978.
[38]Astruc D,Daniel M C,Ruiz J.Dendrimers and gold nanoparticlesas exo-receptorssensing biologically important anions[J].Chem Commun,2004,23:2 637~2 649.
[39]Alonso E,Valerio C,Ruiz J,et al.Polycationic metallodendrimers with cobalticinium and FeCp(arene)+termini[J].New J Chem,1997,21:1 139~1 141.
[40]Ornelas C,Ruiz J,Astruc D.Dendritic and Ion-Pairing Effects in Oxo-anion Recognition by Giant AlkylferrocenylDendrimers[J].Organometallics,2009,28:4 431~4 437.
[41]Daniel M C,Ruiz J,Astruc D.Supramolecular H-bonded assemblies of redox-active metallodendrimers and positive and unusual dendritic effects on the recognition of H2PO4-[J].J Am Chem Soc,2003,125:1 150~1 151.
[42]Labande A,Astruc D.Colloids as redox sensors:recognition of H2PO4-and HSO4-by amidoferrocenylalkylthiolgold nanoparticles[J].Chem Commun,2000,12:1 007~1 008.
[43]Daniel M C,Ruiz J,Nlate S,et al.Gold nanoparticles containing redox-active supramolecular dendrons that recognize H2PO4-[J].Chem Commun,2001,19:2 000~ 2 001.
[44]Daniel M C,Ba F,Ruiz J,et al.Assemblies of Redox-Active Metallodendrimers Using Hydrogen Bonding for the ElectrochemicalRecognition of the H2PO4-and Adenosine-triphosphate(ATP2-)Anions[J].Inorg Chem,2004,43:8 649~8 657.
[45]Deng L,Wang L,Yu H,et al.Synthesis and electrochemical properties of phloroglucin‐based ferrocenyl compounds and their application in anion recognition[J].J Appl Polym Sci,2008,107:1 539~1 546.
[46]Astruc D,Daniel M C,Ruiz J.Dendrimers and gold nanoparticles as exo-receptors sensing biologically important anions[J].Chem Commun,2004,23:2 637~2 649.
[47]Daniel M C,Juiz J,Blais J C,et al.Synthesis of Five Generations of Redox-Stable Pentamethy lamidoferrocenyl Dendrimers and Comparison of Amidoferrocenyland Pentamethylamidoferrocenyl Dendrimers as Electrochemical Exoreceptors for the Selective Recognition of H2PO4-,HSO4-,and Adenosine 5′-Triphosphate(ATP)Anions:Stereoelectronic and Hydrophobic Roles of Cyclopentadienyl Permethylation[J].Chem A-Eur J,2003,9:4 371~4 379.
[48]Alonso B,Casado C M,Cuadrado I,et al.Effective recognition of H2PO4-by a new series of dendrimers functionalized with ferrocenyl-urea termini[J].Chem Commun,2002,16:1 778~1 779.
[49]Mery D,Plault L,Ornelas C,et al.From Simple Monopyridine Clusters[Mo6Br13(Py-R)][n-Bu4N]and Hexapyridine Clusters[Mo6X8(Py-R)6][OSO2CF3]4(X=Br or I)to Cluster-Cored Organometallic Stars,Dendrons,and Den-drimers[J].Inorg Chem,2006,45:1 156~1 167.
[50]Ornelas C,Ruiz J,Cloutet E,et al.Click Assembly of 1,2,3‐Triazole‐Linked Dendrimers,Including Ferrocenyl Dendrimers,Which Sense Both Oxo Anions and Metal Cations[J].Angew Chem,2007,119:890~895.
[51]Beer P D.Anion recognition and sensing:the state of the art and future perspectives[J].Angew Chem,Int Ed,2001,40:486~516.
[52]Beer P D,Bayly S R.Anion sensing by metal-based receptors[J].Top Curr Chem,2005,255:125~162.
[53]Valerio C,Fillaut J L,Ruiz J,et al.The dendritic effect in molecular recognition:ferrocene dendrimers and their use as supramolecular redox sensors for the recognition of small inorganic anions[J].J Am Chem Soc,1997,119:2 588~2 589.
[54]Aranzaes J R,Belin C,Astruc D.Assembly between gold-thiolate nanoparticles and the organometallic cluster[Fe(η5-C5H5)(μ3-CO)]4toward redox sensing of oxoanions[J].Chem Commun,2007,23:3 456~3 458.
[55]Losada J,Cuadrado I,Moran M,et al.Ferrocenyl siliconbased dendrimers as mediators in amperometric biosensors[J].Anal Chim Acta,1997,338:191~198.
[56]Armada M,Losada J,Zamora M,et al.Electrocatalytical properties of polymethylferrocenyl dendrimers and their applications in biosensing[J].Bioelectrochemistry,2006,69:65~73.
[57]Losada J,Zamora M,Armada P G,et al.Bienzyme sensors based on novel polymethylferrocenyl dendrimers[J].Anal Bioanal Chem,2006,385:1 209~1 217.
[58]Armada M P G,Losada J,Cuadrado I,et al.Preparation of biosensors based in a siloxane homopolymer with interacting ferrocenes for the amperometric detection of peroxides[J].Sens Actuators B,2004,101:143~149.
[59]Armada M P G,Losada J,Cuadrado I,et al.A siloxane homopolymer with interacting ferrocenes as a new material for the preparation of sensors based on the detection of hydrogen peroxide[J].Electroanalysis,2003,15:1 109~1 114.
[60]Fernandes E G R,De Queiroz A A A.A bioconjugated polyglycerol dendrimer with glucose sensing properties[J].J Mater Sci:Mater Med,2009,20:473~479.
[61]Crespilho F N,Ghica M E,Florescu M,et al.A strategy for enzyme immobilization on layer-by-layer dendrimergold nanoparticle electrocatalytic membrane incorporating redox mediator[J].Electrochem Commun,2006,8:1 665~1 670.
[62]Lee Y,Kim J,Kim S Y.Protein-conjugated,glucosesensitive surface using fluorescent dendrimer porphyrin[J].J Mater Chem,2009,19:5 643~5 647.
[63]Yoon H C,Lee D,Kim H S.Reversible affinity interactions of antibody molecules at functionalized dendrimer monolayer:affinity-sensing surface with reusability[J].Anal Chim Acta,2002,456:209~218.
[64]Lina M,Liua Y J,Liub C H,et al.Sensitive immunosensor for benzo[a]pyrene detection based on dual amplification strategy of PAMAM dendrimer and amino-modified methylene blue/SiO2core-shell nanoparticles[J].Biosens Bioelectron,2011 26:3 761~3 767.
[65]Rios L,Garcia A A.Dendrimer based non-competitive fluoroimmunoassay for analysis of cortisol[J].React Funct Polym,2008,68:307~314.
[66]Montanez M I,Perez-Inestrosa E,Suau R,et al.Dendrimerized Cellulose as a Scaffold for Artificial Antigens with Applicationsin Drug Allergy Diagnosis[J].Biomacromolecules,2008,9:1 461~1 466.
[67]Manea M,Przybilski M,Hudecz F,et al.Design,structural,and immuno-analytical properties of antigenic bioconjugates comprising a β-amyloid-plaque specific epitope[J].Peptide Science,2008,90:94~104.
[68]Zhang Q,Sha Y W,Wang J H.8-Hydroxyquinoline Dansylates Modified with PAMAM Dendrimer as Fluorescent Fe3+Sensors[J].Molecules,2010,15:2 962~2 971.
[69]Gupta V K,Chandra S,Agarwal S,et al.Lithium-selective potentiometric sensor based on a second generation carbosiloxane dendrimer[J].Sens Actuators B,2005,107:762~767.
[70]Chandra S,Buschbeck R,Lang H.Triethylene Glycol Ether End-grafted Carbosilane Dendrimer:A Potential Ionophore for Potassium Ion Recognition[J].Anal Sci,2006,22:1 327~1 332.
[71]Lopez J A,Manrιquez J,Mendoza S,et al.Design and construction of nickel hexacyanoferrate-Starburst PAMAM dendrimer modified gold electrodes for the potentiometric detection of potassium in aqueous media[J].Electrochem Commun,2007,9:2 133~2 139.
[72]Sethi B,Chandra S,Kumar S,et al.Crown ether-dendrimer based potentiometric Na+sensor electrode[J].J Electroanal Chem,2011,651:185~190.
[73]Chandra S,Buschbeck R,Lang H.A 15-crown-5-functionalized carbosilane dendrimer as ionophore for ammonium selective electrodes[J].Talanta,2006,70:1 087~1 093.
[74]Casado C M,Cuadrado I,Alonso B,et al.1,1'-Bis(dimethylvinylsilyl)ferrocene as a Two-Directional Core for the Construction of Homo-and Heterometallic Systems[J].J Electroanal Chem,1999,463:87~92.
[75]Stone D L,Smith D K.Anion binding at the core of branched ferrocene derivatives[J].Polyhedron,2003,22:763~768.
[76]Krasteva N,Besnard I,Guse B,et al.Self-assembled gold nanoparticle/dendrimer composite films for vapor sensing applications[J].Nano Lett,2002,2:551~555.
[77]Duan S,Kouketsu T,Kasama S,et al.Development of PAMAM dendrimer composite membranes for CO2separation[J].J Membr Sci,2006,283:2~6.
[78]Kouketsu T,Duan S,Kai T,et al.PAMAM dendrimer composite membrane for CO2separation:Formation of a chitosan gutter layer[J].J Membr Sci,2007,287:51~59.
[79]Gao T,Tillman E S,Lewis N S.Detection and classification of volatile organic amines and carboxylic acids using arrays of carbon black-dendrimer composite vapor detectors[J].Chem Mater,2005,17:2 904~2 911.
[80]Duan S,Chowdhury F A,Kai T,et al.PAMAM dendrimer composite membrane for CO2separation:addition of hyaluronic acid in gutter layer and application of novel hydroxyl PAMAM dendrimer[J].Desalination,2008,234:278~285.
[81]Koo B W,Song C K,Kim C.CO gas sensor based on a conducting dendrimer[J].Sens Actuators B,2001,77:432~436.
[82]Liang Z,Fahdel B,Schneider C J,et al.Stepwise growth of melamine-based dendrimers into mesopores and their CO2adsorption properties[J].Microprous Mesoporous Mater,2008,111:536~543.
[83]Zimmerman S C,Zharov I,Wendland M S,et al.Molecular Imprinting Inside Dendrimers[J].J Am Chem Soc,2003,125:13 504~13 508.
[84]Elmer S L,Lemcoff N G,Zimmerman S C.Exploring the reversibility of the ring-closing metathesis mediated cross-linking of dendrimers[J].Macromolecules,2007,40:8 114~8 118.
[85]Mertz E,Zimmerman S C.Cross-linked dendrimer hosts containing reporter groups for amine guests[J].J Am Chem Soc,2003,125:3 424~3 425.
