组蛋白去乙酰化酶2在宫颈鳞癌组织中的表达及临床意义
2011-06-20陈琛
陈 琛
(郑州大学第二附属医院病理科,河南郑州450014)
目前,宫颈癌的发病率居高不下,且预后极差,因此寻找转移相关基因来诊断宫颈癌显得意义重大。近年来的研究显示,组蛋白去乙酰化酶2(histone deacetylase 2,HDAC2)作为该家族重要的Ⅱ型成员在肿瘤的发生、发展中发挥着极其重要的作用[1-3]。抑制HDAC的活性或表达已经成为恶性肿瘤治疗的十分有用的分子靶点[4-7]。本研究采用免疫组化和原位杂交(in situ hybridization,ISH)方法联合检测HDAC2在宫颈鳞癌组织及正常宫颈黏膜组织中的表达情况,并分析其表达与宫颈鳞癌的临床病理学特征的关系。
1 材料与方法
1.1 一般资料 80例宫颈鳞癌及25例正常宫颈黏膜组织,均来自于2006年5月至2011年8月郑州大学第二附属医院妇产科手术切除标本。所有宫颈鳞癌患者术前均未服用任何抗肿瘤药物,均未接受放、化疗。80例宫颈鳞癌患者年龄为25~74岁,平均年龄(53.1±12.3)岁,其中年龄 <50岁者27例,≥50岁者53例。依据WHO 1985年肿瘤细胞分化程度规定,其中高分化癌11例,中分化癌45例,低分化癌24例。依据国际妇产科联盟(FIGO,2000)修订的TNM分期标准,其中Ⅰ期37例,Ⅱ期43例。依据淋巴结转移情况分类,其中有淋巴结转移者31例,无淋巴结转移者49例。标本经40 g/L多聚甲醛溶液固定,常规脱水,石蜡包埋,连续切片,切片厚度4~6 μm,用于 HE、免疫组织化学及原位杂交染色。
1.2 主要试剂及探针合成 预杂交液、SA-Bio-AP、BCIP/NBT均购自武汉博士德生物技术有限公司。探针序列:原位杂交5’端生物素标记、全硫代修饰探针由北京奥科生物技术有限公司合成。HDAC2探针序列:5’-CTAGTCTAAAAGTGGATGA-3’。HDAC2 单克隆抗体购自美国Santa Cruz公司,免疫组织化学试剂盒、DAB显色剂购自北京中杉金桥生物技术有限公司。
1.3 免疫组化方法 采用免疫组化S-P法,常规脱蜡,PBS清洗,抗原修复,体积分数3%H2O2清除内源性过氧化物酶活性,PBS清洗,滴加正常山羊血清封闭,加Ⅰ抗(即用型),4℃冰箱过夜,PBS清洗,加Ⅱ抗,PBS清洗,加Ⅲ抗,PBS清洗,DAB显色。苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。用Novus Biologicals公司提供的切片作为阳性对照,PBS代替一抗作为阴性对照。
1.4 ISH方法 标本经新鲜配制二甲苯脱蜡和梯度酒精脱水后,用新鲜配制的体积分数0.5%H2O2室温处理30 min,以灭活内源性过氧化物酶;质量分数3%柠檬酸新鲜配制蛋白酶(0.01 g/L),37 ℃,10 min,消化标本DNA结合蛋白;每张玻片滴加20 μL不含探针的预杂交液(42℃),预杂交4 h;加含探针(1 ng/L)的杂交液,42℃湿盒内杂交12 h;柠檬酸盐42℃洗后,加 SA-Bio-AP 37 ℃,10 min;漂洗后加BCIP/NBT,避光显色2~4 h。以不含探针的标本作阴性对照。
1.5 结果判定 HDAC2蛋白及mRNA阳性信号分别呈黄色及紫蓝色颗粒样物质,分别位于细胞核及细胞质内。高倍镜下随机选取5个视野(每个视野观察细胞数不少于200个),按阳性细胞所占百分比及着色深浅进行结果判定[8]。采用9分评分制。按照阳性细胞所占百分比:阳性细胞<10%为1分,10% ~50%为2分,>50%为3分;按染色程度强弱:阴性为0分,淡黄(蓝)色染色为1分,中度黄(蓝)色染色为2分,棕黄(紫蓝)色染色为3分。然后将两项评分的乘积作为总分,总分<3分为阴性,≥3分为阳性。
1.6 统计学处理 应用SPSS 11.0进行统计分析,率的比较用χ2检验,相关性检验用Spearman相关分析,检验水准 α=0.05。
2 结果
2.1 HDAC2蛋白表达情况 HDAC2蛋白阳性信号定位于细胞核中,呈淡黄至棕黄色颗粒样物质(图1)。HDAC2蛋白在宫颈鳞癌组织中的阳性表达率(65.0%)显著高于正常宫颈黏膜组织(16.0%)(χ2=18.375,P <0.001)。不同临床病理学特征的宫颈鳞癌组织中HDAC2蛋白的表达情况见表1。

图1 宫颈鳞癌组织中HDAC2蛋白的表达(S-P×400)
2.2 HDAC2 mRNA表达情况 HDAC2 mRNA阳性信号定位于细胞质中,呈蓝紫色颗粒样物质(图2)。HDAC2 mRNA在宫颈鳞癌组织中的阳性表达率(57.5%)显著高于正常宫颈黏膜组织(8.0%)(χ2=18.807,P <0.001)。不同临床病理学特征的宫颈鳞癌组织中HDAC2 mRNA的表达情况见表1。
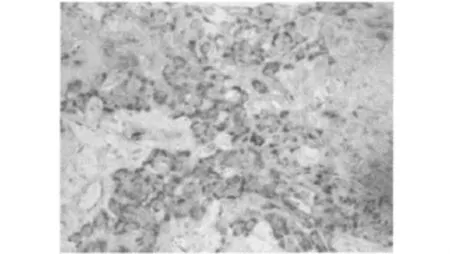
图2 宫颈鳞癌组织中HDAC2 mRNA的表达(ISH×400)
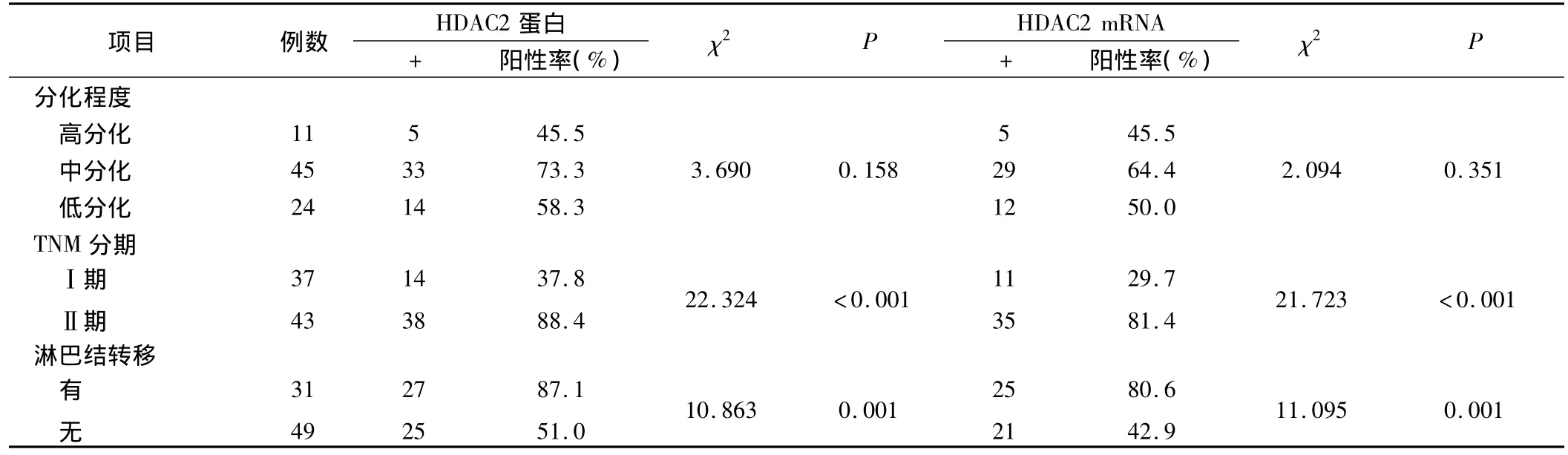
表1 HDAC2蛋白及mRNA表达与宫颈鳞癌临床病理学特征的关系
2.3 HDAC2蛋白及mRNA在宫颈鳞癌组织中表达的相关性 HDAC2蛋白及mRNA在宫颈鳞癌组织中的表达呈正相关关系(r=0.482,P <0.05)。见表2。
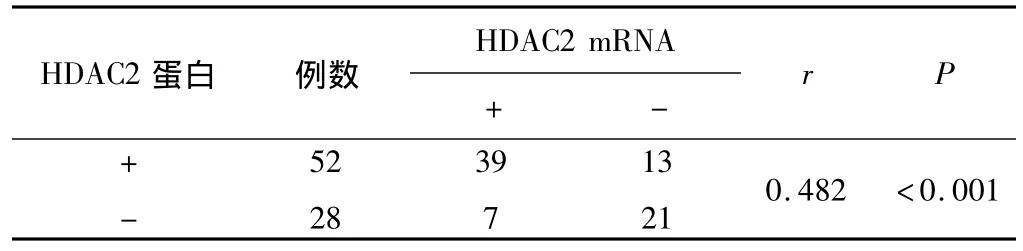
表2 HDAC2蛋白及mRNA表达的相关性分析
3 讨论
HDACs是由一组酶组成的,其主要的功能是从ε-N-乙酰赖氨酸中删除乙酰基团。因为真核生物DNA的组织和包装主要通过核心组蛋白H2A、H2B、H3和H4的增加来完成,从而形成染色质这种复合物的结构,核心组蛋白的修饰对于染色质构象的改变是十分重要的[9-10]。乙酰化水平也影响转录的活性:乙酰化诱导开放的染色质构象,这种构象可提高转录效率。染色质的乙酰化与转录活性相关,而去乙酰化与基因沉默有关。HDACs也涉及到非组蛋白可逆的乙酰化。有研究显示,HDAC2在口腔肿瘤组织中均呈现过表达,其过表达与口腔肿瘤的晚期和预后差关系密切[11]。Chang等[12]检测了 5 株头颈部肿瘤细胞系Ca9-22、Cal-27、HSC-3、SAS 和 TW2.6 中 HDAC2 的表达,并构建HDAC2的过表达载体和shRNA载体分别研究其表达上调或下调对口腔肿瘤浸润和转移能力的影响,结果发现敲除SAS细胞中HDAC2的表达导致肿瘤发生和进展能力的下降。Fritzsche等[13]在肾癌细胞中发现了HDAC2的高表达,其表达的阳性率大约为60%,提示HDAC2作为原癌基因在肿瘤的发生、发展中发挥重要作用。
本研究结果显示,HDAC2在正常宫颈黏膜组织中蛋白及mRNA表达均较低,在宫颈鳞癌组织中的表达则显著升高;HDAC2蛋白及mRNA表达与宫颈鳞癌的TNM分期及淋巴结转移有关,这就提示HDAC2蛋白及mRNA的过表达是宫颈鳞癌癌变过程中的一个早期事件,可能与肿瘤的发生、发展、浸润、转移及演进过程有密切的关系。
本研究通过对HDAC2蛋白及mRNA表达情况的相关性分析发现,宫颈鳞癌组织中HDAC2蛋白的表达与HDAC2 mRNA的表达呈正相关,提示其蛋白表达与mRNA表达具有一致性。HDAC2蛋白及mRNA的联合检测有助于合理评估患者的病程,给临床治疗方案的合理制定提供有益的参考。
[1]Verdin E,Dequiedt F,Kasler HG.Class Ⅱ histone deacetylases:versatile regulators[J].Trends Genet,2003,19(5):286 - 293.
[2]Sakuma T,Uzawa K,Onda T,et al.Aberrant expression of histone deacetylase 6 in oral squamous cell carcinoma[J].Int J Oncol,2006,29(1):117-124.
[3]Arts J,Angibaud P,Mari¨en A,et al.R306465 is a novel potent inhibitor of class I histone deacetylases with broad-spectrum antitumoral activity against solid and haematological malignancies[J].Br J Cancer,2007,97(10):1344 -1353.
[4]Marks PA,Miller T,Richon VM.Histone deacetylases[J].Curr Opin Pharmacol,2003,3(4):344 -351.
[5]Marcus AI,Zhou J,O’Brate A,et al.The synergistic combination of the farnesyl transferase inhibitor lonafarnib and paclitaxel enhances tubulin acetylation and requires a functional tubulin deacetylase[J].Cancer Res,2005,65(9):3883 -3893.
[6]Saji S,Kawakami M,Hayashi S,et al.Significance of HDAC6 regulation via estrogen signaling for cell motility and prognosis in estrogen receptor-positive breast cancer[J].Oncogene,2005,24(28):4531-4539.
[7]Carew JS,Giles FJ,Nawrocki ST.Histone deacetylase inhibitors:mechanisms of cell death and promise in combination cancer therapy[J].Cancer Lett,2008,269(1):7 -17.
[8]高冬玲,李晟磊,赵志华,等.食管鳞癌组织中RECK和MMP-9基因mRNA 检测与分析[J].中国肿瘤临床,2008,35(13):748-751.
[9]Bertos NR,Wang AH,Yang XJ.Class Ⅱ histone deacetylases:structure,function,and regulation[J].Biochem Cell Biol,2001,79(3):243-252.
[10]Fischle W,Kiermer V,Dequiedt F,et al.The emerging role of class Ⅱhistone deacetylases[J].Biochem Cell Biol,2001,79(3):337 - 348.
[11]Chang HH,Chiang CP,Hung HC,et al.Histone deacetylase 2 expression predicts poorer prognosis in oral cancer patients[J].Oral Oncol,2009,45(7):610 -614.
[12]Chang CC,Lin BR,Chen ST,et al.HDAC2 promotes cell migration/invasion abilities through HIF-1α stabilization in human oral squamous cell carcinoma[J].J Oral Pathol Med,2011,40(7):567 -575.
[13]Fritzsche FR,Weichert W,Röske A,et al.Class I histone deacetylases 1,2 and 3 are highly expressed in renal cell cancer[J].BMC Cancer,2008,8:381.
