乳酸环丙沙星注射液药物稳定性试验的研究
2011-06-08石长春李红梅
石长春 李红梅
(吉林省广春药业有限公司,吉林 白城 137000)
乳酸环丙沙星能抑制细菌的DNA旋转酶干扰DNA的复制,破坏细菌的细胞膜,使细胞内容物流失,细菌在环丙沙星的双重袭击下,不论细菌处于繁殖期还是静止期,都能迅速被杀死,这是其他抗菌药物无法比拟的。乳酸环丙沙星注射液适用于敏感菌所致的呼吸道、泌尿道、消化道、胆道、皮肤和软组织、盆腔、咽喉等部位感染。本文对乳酸环丙沙星注射液在贮藏期内的质量稳定性进行观察,为药品的有效期提供依据。
稳定性试验包括影响因素试验、加速试验、长期试验。影响因素试验的目的是明确药品可能的变化途径、初步确定药品的包装、贮藏条件和加速试验的条件,同时验证处方的合理性和分析方法的可行性。加速试验的目的是明确药品在偏离正常贮藏条件下的变化情况、确定长期试验的条件。长期稳定性试验的目的是确认影响因素试验和加速试验的结果,明确药品稳定性的变化情况,以便确定药品的有效期。
根据《中国药典》(2010年版二部)关于药物稳定性试验指导原则和注射剂稳定性考察重点内容,本文对乳酸环丙沙星注射液进行了性状、pH值、含量的考察,各项目的检查均按本品质量标准及《中国药典》(2010年版)注射剂有关物质项下有关规定进行。
1 影响因素试验
考察项目:外观、pH值、有关物质、含量。
1.1 高温试验
将乳酸环丙沙星注射液除去外包装,放置于60℃条件下10d,分别于第0、5、10天取样,测定各项指标,见表1。
本品影响因素试验表明,经与0d时结果数据相比较,结果表明,样品在60℃高温条件下考查5、10d时,各项考察指标基本无变化。该品在高温60℃条件下均较稳定,说明本品在此条件下是稳定。
1.2 低温试验

表1 高温60℃试验结果
将乳酸环丙沙星注射液除去外包装,放置于4℃条件下10d,分别于第0、5、10天取样,测定各项指标,见表2。

表2 低温4℃试验结果
本品影响因素试验表明,经与0d时结果数据相比较,结果表明,样品在40℃低温条件下考查5、10d时,各项考察指标基本无变化。该品在低温40℃条件下均较稳定,说明本品在此条件下是稳定。
1.3 光照试验(4500±500LX)
在室温条件下,将乳酸环丙沙星注射液除去外包装,放置于(4500±500)LX强光下照射10d,分别于第0、5、10天取样,测定各项指标,见表3。

表3 光照试验(4500±500LX)结果
本品影响因素试验表明,该品在光照5d时,有关物质明显升高,不符合标准规定。说明本品在此条件下不具有较好的稳定性。
2 加速试验
2.1 考察项目
外观、pH值、有关物质、含量。
2.2 试验条件及结果
将乳酸环丙沙星注射液模拟上市包装,放置于(40±2)℃的条件下6个月,分别于第0、1、2、3、6个月取样,测定各项指标,见表4。

表4 (40±2)℃的条件下6个月加速实验结果
经6个月加速试验并与0d时结果数据相比较,结果表明,样品在加速条件下考察,各项考察指标无明显变化,说明本品在此条件下具有较好的稳定性。
3 长期试验考察
3.1 考察项目
外观、pH值、有关物质、含量。
3.2 试验条件及结果
将乳酸环丙沙星注射液模拟上市包装,在室温(25±2)℃的条件下存放36个月,分别于第0、3、6、9、12、18、24、36个月取样,测定各项指标,见表5。
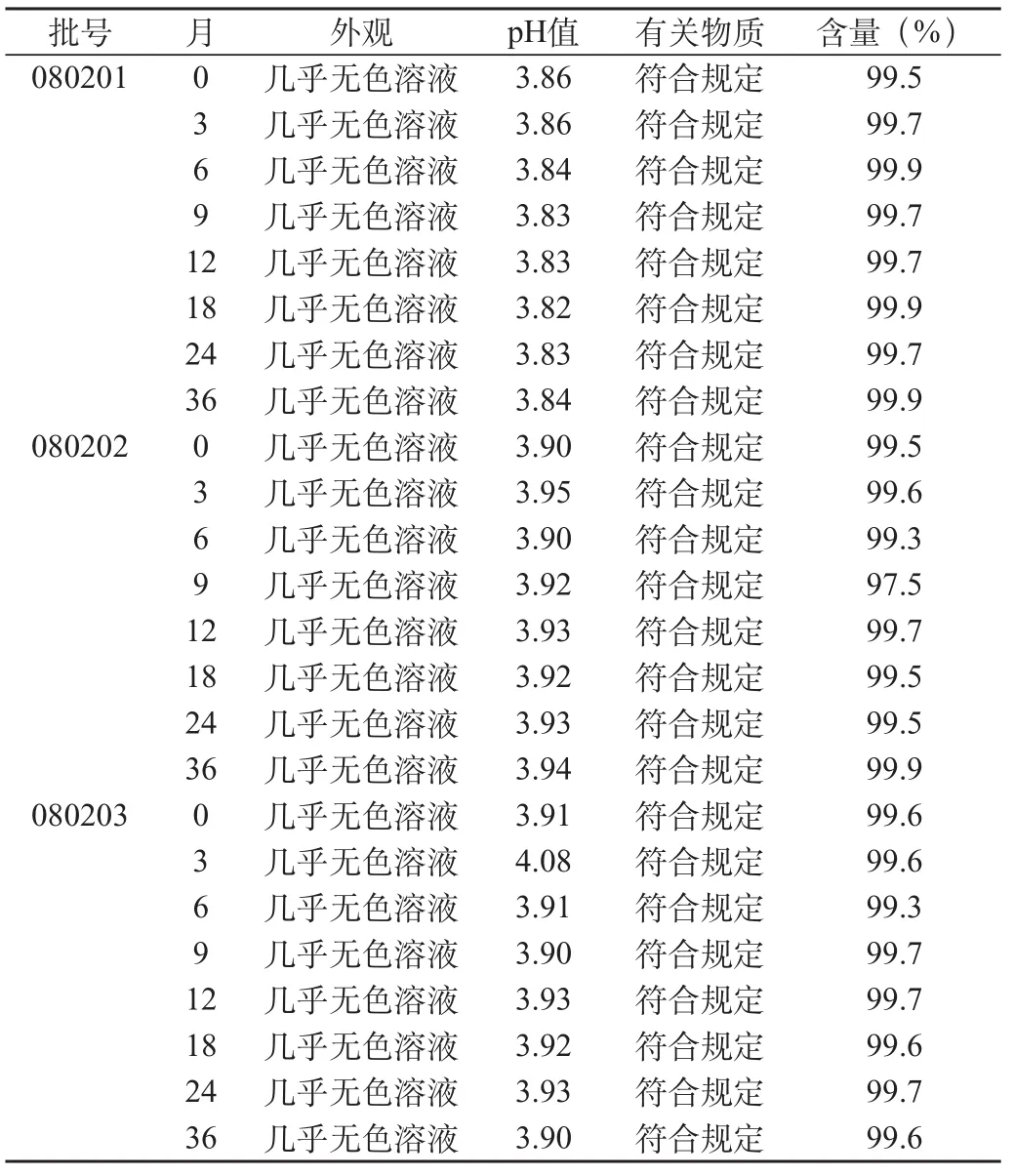
表5 室温(25±2)℃的条件下存放36个月长期试验结果
经36个月长期试验并与0d时结果数据相比较,结果表明,样品在长期条件下考察,各项考察指标无明显变化,说明本品在此条件下具有较好的稳定性。
4 稳定性考察结论
本品影响因素试验表明,该品在光照5d时有关物质明显升高,不符合标准规定,高温60℃及低温4℃条件下均较稳定;经6个月加速试验、36个月室温考察试验,各项质量指标均符合规定,故本品的贮藏条件可确定为遮光、密闭保存,有效期可定为2年。
