烟曲霉性角膜炎的实验研究
2011-05-28吴然程波贾敏
吴然 程波 贾敏
(1.贵阳中医学院第一附属医院皮肤科,贵阳550001;2.福建医科大学附属第一医院皮肤科,福州350001)
近年来,随着广谱抗生素和糖皮质激素的滥用、隐形眼镜的普及及艾滋病等免疫缺陷性疾病的增加,真菌性角膜炎的发病率在不断上升[1]。研究显示烟曲霉较其他曲霉菌对人体组织有更强的黏附性和致病性[2],是我国真菌性角膜炎的主要致病菌种之一[3]。一旦感染了烟曲霉,患者的视力将受到不同程度的损害,甚至永久性失明,因此,本实验根据我国真菌性角膜炎的流行病学调查结果,选择烟曲霉作为病原体,建立烟曲霉角膜炎的小鼠模型,初步探讨烟曲霉对角膜的致病条件、损伤机制,以期促进曲霉病的实验和临床研究。
1 材料和方法
1.1 实验材料
菌株及动物 烟曲霉 取自福建医科大学附属第一医院皮肤科真菌实验室保存的菌种。清洁级昆明小白鼠 (ICR)6~8周龄,体重 (30±0.5)g,雌雄兼用,福建医科大学实验动物中心提供,无眼疾。
主要试剂及配制方法 马铃薯葡萄糖琼脂培养基、沙氏葡萄糖蛋白胨琼脂培养基按中华人民和国国家标准,微生物学检测方法GB/T14926.43-2001 4.16 和 4.17 方法进行配制[4]。
仪器设备 OlympusRCK40-32PH光学显微镜、手术用双眼显微镜、裂隙灯显微镜、电热恒温培养箱、血球计数板、组织研磨器 、1 mL结膜注射针等。
1.2 实验方法
烟曲霉分生孢子悬液的制备 收集PDA培养平皿盖内完全纯化的烟曲霉孢子,用生理盐水稀释成孢子混悬液,用血球计数板计数,将孢子混悬液调配成 102、104、106、108(单位 CFU/mL)备用。
实验小鼠模型的建立 ①划痕法:选取正常实验用小鼠36只,根据所接种菌液浓度102CFU、104CFU、106CFU、108CFU及生理盐水分为5组,分别标记1、2、3、4 、5 组,其中 3、4 、5 小鼠数量均为6只,鉴于预实验中发现接种低浓度菌液时小鼠角膜感染率极低,故1、2组小鼠分别选取10只和8只,所有模型小鼠均取单侧眼角膜进行接种实验。全部将小鼠以10%水合氯(400 mg/kg)腹腔注射麻醉后,于手术显微镜下用1 mL结膜注射针在小鼠单侧角膜表面造成#字形浅表划伤,尽量刮除#字各区角膜上皮层后,第 1、2、3、4组表面涂以10μL预制的烟曲霉孢子悬液,含量分别为 102CFU 、104CFU、106CFU、108CFU,第 5组滴入生理盐水作对照,然后闭合小鼠睑裂并轻轻揉搓上下眼睑,使烟曲霉孢子混悬液或生理盐水能均匀分布在划伤的角膜表面。接种24小时后每天在裂隙灯和手术显微镜下观察角膜病变,比较各组感染率及病变程度。②免疫抑制剂处理后加用划痕法:随机选取6只正常小鼠,于接种孢子前 5 天、前 3 天、前 1 天按 180 mg·kg-1·d-1[5]给小鼠肌注环磷酰胺,之后采取划痕法给小鼠单眼接种10 L(含106CFU)烟曲霉孢子混悬液,接种24 h后观察角膜病变。③角膜基质注射法:选取6只正常小鼠,予10%水合氯醛麻醉腹腔注射麻醉后,在手术显微镜指导下,用结膜注射针在小鼠角膜中央1/3~1/2基质层,注入烟曲霉孢子悬液10μL(含106CFU),闭合小鼠睑裂并适当搓揉使菌液充分黏附于角膜组织中。
1.3 实验结果观察方法
模型建立后,在不同时间对病变角膜行肉眼观察评分﹑真菌镜检﹑真菌培养及组织病理学检查。
模型小鼠角膜病灶观察评分 自接种24 h起,每天将小鼠麻醉后在手术显微镜和裂隙灯显微镜下观察角膜病变,并予临床评分。评分标准参照Wu TG等[5]的方法:根据造模后小鼠角膜的混浊面积、混浊深度及角膜表面平整光滑度分别予以评分,3项的分数相加为该眼的总分,根据此法,正常未受外伤的角膜总评为0分,临床病情分度:总分≤5分为轻度、6~9分为中度、≥10分为重度。
模型小鼠角膜组织真菌镜检及培养 接种后第5天,将小鼠麻醉后,用无菌钝性刀片刮取适量病变角膜表面分泌物,置于无菌载玻片上,滴1~2滴10%KOH,盖上盖玻片,置显微镜下观察有无菌丝及孢子,与此同时刮取尽可能多的病变角膜标本,按点植法接种在SDA培养基上,置于28℃恒温箱中进行培养,每天观察菌落生长情况。
模型小鼠角膜组织病理活检 造模后24 h随机选取角膜病变呈中度发病小鼠10只,分别于接种后第36 h、4 d、7 d、10 d、14 d 行颈椎脱臼处死小鼠,立即摘取病变眼球,作病理活检,行HE染色,光学显微镜下观察组织学改变及真菌结构。
2 结 果
2.1 模型小鼠角膜接种后感染情况
划痕法组 接种10μL烟曲霉孢子混悬液,含量分别为 102CFU、104CFU、106CFU、108CFU 菌液的感染率分别为 (2/10)20%、(2/8)25% 、(2/6)33.3% 、(3/6)50%。接种量 <106CFU时,角膜呈轻度病变,24 h内角膜基本恢复正常透明度;接种量≥106CFU时,角膜轻度混浊 (见图1)可持续36~48 h,于10 d内基本恢复正常的透明度,部分小鼠角膜仅留下多少不等的新生血管(见图2)。
环磷酰胺处理+划痕法组 接种含量为106CFU时,感染率为6/6(100%),病变中至重度(见图3),持续到第10天时,角膜病变持续存在(见图4)。
角膜基质注射法组 接种含量为106CFU时,正常小鼠角膜感染率为6/6(100%),病情中至重度 (见图5),病变迁延,呈现明显角膜溃疡(见图6)。
接种生理盐水组 角膜未呈现混浊,8 h内观察仅显示角膜表面水肿粗糙,24 h后全部角膜恢复正常。
2.2 模型小鼠角膜大体观察结果

图1 划痕法:感染后第3天小鼠角膜像,显示角膜轻度混浊 图2划痕法:感染后第10天小鼠角膜像,显示角膜恢复透明,少量新生血管 图3 CTX+化痕划痕法:感染后第3天小鼠角膜像,显示全角膜混浊水肿,局限溃疡 图4 CTX+划痕法:感染后第10天小鼠角膜像,显示角膜菌丝灶,较多新生血管 图5 基质注射法:感染后第3天小鼠角膜像,显示菌丝苔被 图6 基质注射法:感染后第10天小鼠角膜像,显示菌丝灶,伪足,大量新生血管Fig.1 Mouse corneal appearance by cornea sacrifiction 3 ds PI:minor opacity in the cornea Fig.2 Mouse corneal appearance by cornea sacrifiction 10 ds after inoculation:cornea regain clearing with small quantity of neovessels Fig.3 Mouse corneal appearance by sacrifiction with CTX treatment 3 ds PI:opacity and hydropswith localized ulcer in the cornea Fig.4 Mouse corneal appearance by cornea sacrifiction 10 ds after inoculation:hypha and neovessels in the cornea Fig.5 Mouse corneal appearance by stromal injection 3 ds PI:hypha mossFig.6 Mouse corneal appearance by stromal injection 10 ds PI:hypha and pseudopodia with neovessels
接种后3 d内,各组小鼠患眼畏光,刺激性眨眼次数较多。3 d后刺激症状渐减少至消失。感染后第7天,病情重度者角膜表面粗糙不平,坏死组织多,荧光素钠染色阳性面积大,角膜基质层水肿明显,有明显新生血管,接种处有绿白色脓液及坏死物附着,质地稠厚不易刮除,即菌丝苔被;接种后第10天,各组小鼠角膜充血水肿渐减轻,远离病灶处,角膜变得光滑平整,菌丝苔被处仍有小面积上皮缺损,荧光素染色阳性面积缩小,此时可见菌丝灶和伪足。环磷酰胺处理组中有3只小鼠在接种后表现纳差、少动,全身毛发不顺,小鼠症状出现后5 d内死亡,检查发现角膜溃疡深在且广泛,合并前房积脓及角膜穿孔,取死亡小鼠脑部组织作真菌镜检及培养,发现颅内有广泛的烟曲霉菌感染灶。
2.3 模型小鼠角膜实验室检查结果
角膜组织真菌镜检结果 接种后第5天,取角膜标本行真菌镜检,发现透明有隔的菌丝,呈45°分支,同时见有散在的孢子。全部模型组检出率70%(见图7)。
角膜组织真菌培养结果 见典型烟曲霉菌落,未见其他杂菌生长,光镜下观察见烟曲霉镜下结构(见图8),证实眼部感染的病原体即为接种的标准烟曲霉菌株。全部模型组真菌培养阳性率100%。
组织病理学观察结果 取病变角膜组织行HE染色见烟曲霉菌丝呈垂直的方式向角膜深层生长(见图9,10)。
3 讨 论
烟曲霉是一种广泛存在于自然界中的一种常驻菌种,那么它对我们到底有多大的威胁呢?是否只要接触到烟曲霉就会发生致盲性眼病或其他部位的严重感染呢?本实验首先采用划痕法比较不同浓度的烟曲霉孢子混悬液对正常小鼠角膜的感染率,发现随着孢子混悬液浓度的增加其感染率增高,所致病情加重。如要确保划痕法33%以上的正常小鼠出现轻至中度角膜感染,至少需要孢子混悬液的含量达到106CFU,这一现象说明烟曲霉性角膜炎的形成与接触高数量的病原体直接相关。另外,我们将小鼠在实验前用免疫抑制剂 (环磷酰胺)抑制小鼠免疫系统功能后,发现同样接种量(106CFU)烟曲霉对小鼠角膜感染率升高到100%,且显示更为严重更为持久的病变,部分小鼠发展为烟曲霉脑炎,说明烟曲霉角膜炎的形成除与病原体感染数量有关外,与受累宿主的免疫状态也有明确关系。为了观察角膜损伤程度与角膜真菌感染率的关系,本实验用等量菌液(106CFU)分别采用划痕法和角膜基质注射法造模,发现后者使小鼠角膜感染率更高,病变更重。由此,我们推断出曲霉角膜炎形成的三个条件:①角膜受损并达到一定的深度,为真菌的侵袭及黏附提供了结构基础。②入侵的病原体必须有足够的数量才能导致曲霉角膜炎的形成。③机体免疫力降低时,角膜对曲霉的易感性增加。
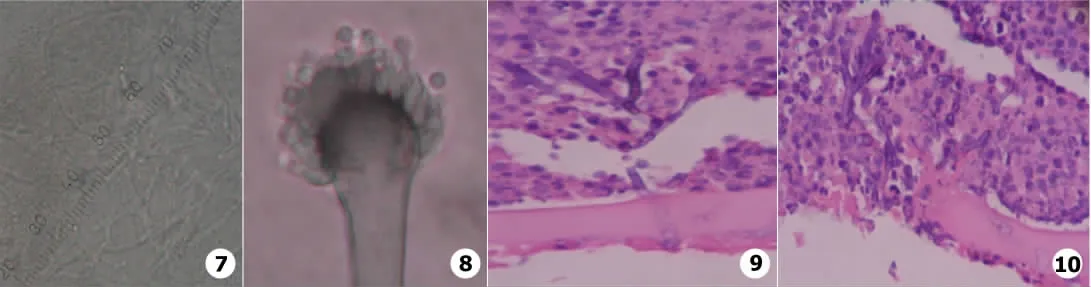
图7 小鼠角膜组织真菌镜检显示透明孢子及呈45°分支的管状菌丝(×400) 图8 小鼠角膜真菌培养菌落镜下结构,显示烟曲霉结构(×1 000) 图9 接种后第7天小鼠角膜组织像显示菌丝垂直晶状体囊生长(HE,×1 000) 图10接种后第7天小鼠角膜组织像显示晶状体囊大量炎症细胞和菌丝侵袭伴组织坏死(HE,×1 000)Fig.7 Direct light microscopic photographs of cornea tissues:clear spores and tubular-shape hypha with 45°branching(×400)Fig.8 Light microscopic photograph of fungal colony isolated from mouse cornea:the structure of Aspergillusfumigatus(×1 000)Fig.9 Mouse corneal tissue appearance 7 ds PI:hypha growth vertically to the capsula lentis(HE,×1 000)Fig.10 Mouse corneal tissue appearance 7 ds PI:large amount of inflammatory cells and hypha with necrotic tissues in the capsula lentis(HE,×1 000)
组织病理活检在许多疾病的诊断中视为金指标,对烟曲霉角膜炎也有确诊价值,但通常只用于相关的基础研究或角膜移植术后的确诊,术前组织活检很少进行。本实验刮取小鼠角膜病变组织行真菌镜检,阳性率达70%,此项检查简便易行,3~5 min即可出结果,且经济要求不高,较适合基层医院实施开展,从而提高真菌病的早期诊断率。本次实验通过病理组织检查发现烟曲霉以垂直角膜基质层的方向向角膜深层潜行生长,而镜检时所取标本来自病变角膜表面的分泌物及坏死物,离真菌深层感染灶较远,加之标本量偏少,导致其敏感性降低,镜检阳性率达不到100%,如在取标本做镜检同时取适量标本行真菌培养,在适宜的培养基中,仅一条烟曲霉菌丝片段或孢子也能无限制繁殖扩增,从而提高真菌培养检查的阳性率,故临床上如真菌镜检阴性,不能除外真菌感染。
系统性真菌感染的研究证实烟曲霉感染肺组织时,可产生多种水解活性酶如丝氨酸蛋白酶、金属蛋白酶等,这些活性酶通过降解肺泡细胞外基质从而促进烟曲霉对组织的黏附扩散[6]。另有研究证实烟曲霉感染角膜时,早期即存在烟曲霉孢子与角膜上皮基底膜的黏附现象。本实验发现仅有菌丝或炎症细胞侵犯处组织保持较完整,而烟曲霉与炎症细胞同时侵犯处组织发生溶解坏死 (见图9,10),根据已有的研究结果和本试验组织病理学所见,我们推测,角膜曲霉感染中,受累组织断裂溶解是病原体和炎症细胞综合作用的结果:一方面烟曲霉与受累组织发生黏附产生机械破坏,而致病状态的烟曲霉分泌多种水解酶及毒素,造成对组织的化学性降解破坏;另一方面入侵的烟曲霉作为异物对体内炎症细胞产生趋化作用,活化的炎症细胞也可释放大量蛋白水解酶和炎症介质参与对组织的溶解破坏,促进菌丝和孢子在组织中的黏附和扩散。有关曲霉角膜炎的更多损伤机制有待进一步深入的研究。
[1] 应佳,施天严.真菌性角膜炎[J].实用医学杂志,2007,23(24):3965.
[2] Botterel F,Gross K,Ibrahim-Granet O,et al.Phagocytosis of Aspergillus fumigatus conidia by primary nasal epithelial cells in vitro[J].BMCMicrobiol,2008,8:97.
[3] Wenxian Zhong,Hongmei Yin,Lixin Xie.Expression and potential role of major inflammatory cytokines in experimental keratomycosis[J].Mol Vis,2009,15:1303-1311.
[4] 中华人民共和国国家标准[S].GB/T 14926.4-2001实验动物微生物学检测方法(2)
[5] Wu TG,Wilhelmus KR,Mitchell BM.Experimental keratomycosis in a mouse model[J].Invest Ophthalmol Vis Sci,2003,44(1):210-216.
[6] Rementeria A,Lopez-Molina N,Ludwig A,et al.Genes and molecules involved in Aspergillus fumigatus virulence[J].Rev Iberoam Micol,2005,22(1):1-23.
