预注不同剂量长托宁对内毒素休克兔肺动脉张力的影响及机制探讨
2011-05-25佟冬怡于泓波李娜魏会霞张锦
佟冬怡,于泓波,李娜,魏会霞,张锦
(1.中国医科大学附属盛京医院麻醉科,沈阳 110004;2.沈阳市骨科医院麻醉科,沈阳 110044;3.煤炭总医院麻醉科,北京 100071)
内毒素休克(endotoxin shock,ES)时,并发急性肺损伤(acute lung injury,ALI),肺血管受损,出现肺动脉高压(pulmonary artery hypertension,PAH),有研究证实ES时肺血管张力增高,是导致PAH和肺水肿的产生的主要因素之一[1]。长托宁(penehyclidine hydrochloride,PHC)是一种新型抗胆碱能药物,其选择性阻断M1,M3受体,近年来在内毒素致急性肺损伤的保护作用成为热点。而PHC对ES下肺血管张力变化的调节机制及给药时机和量的选择,目前报道较少。本研究旨在从离体水平观察不同剂量PHC对家兔ES时肺动脉张力变化的影响,并探讨其机制,为抗胆碱能药物应用于ES围术期提供理论依据。
1 材料和方法
1.1 材料
试剂:大肠杆菌内毒素E.coli脂多糖(美国Sigma公司生产,型号 L2880);KRB 液(Gibco公司,美国);苯肾上腺素(深圳沃兰德公司);氯化乙酰胆碱(美国Sigma公司,批号A1049);长托宁(成都力思特制药股份有限公司,批号090701)。仪器:压力换能器(Power Lab4/25T;ADI公司,澳大利亚),西门子900C呼吸机(德国),血气分析仪(Bayer855),NO试剂盒(南京建成生物工程研究所)。
1.2 方法
1.2.1 实验分组与动物模型:新西兰大耳白兔30只,雄性,体质量2.0~2.5 kg,由中国医科大学附属盛京医院动物实验中心提供。随机分为5组(每组6只,n=6):(1)NS对照组(N 组);(2)Ach对照组(A组);(3)LPS 对照组(L 组);(4)PHC(0.02 mg/kg)+LPS 组 (PHC2+L 组);(5)PHC(0.45 mg/kg)+LPS组(PHC5+L组)。大耳白兔麻醉后呼吸机机械通气股动脉经压力传感器动态描记给药前,给药即刻(0 min),5 min,15 min,30 min 各时间点 MAP,并于30 min抽取股动脉血样检测血气指标。ES模型:除N组和A组外,其他3组均颈静脉注射LPS(1 mg/kg);PHC组LPS注入前15 min注入PHC(0.02 mg/kg,0.45 mg/kg)。注射 LPS后以 MAP低于 60 mmHg作为ES模型成功标准[2],血气分析PaO2/FiO2<300,为 LPS 致 ALI[3]。
1.2.2 离体肺动脉环张力测定:将处死动物心肺联合取出,置于通入95%O2和5%CO2混和气的4°C KRB液中。分离肺动脉,经血管环活性及内皮完整性检测后,置于含有5 ml KRB(37°C)的恒温浴槽中。连上张力换能器,调节血管环至最适张力,记录平衡后的张力值。用PE 1μmol/L预收缩血管环,记录预收缩值,N 组依次加入(0.01,0.1,1,10和 100 μmol/L)浓度NS,其余各组依次加入对应浓度的Ach,记录张力变化值。舒张反应结果以舒张反应百分比表示:(PE预收缩值-舒张值)/PE预收缩值×100%。
1.2.3 颈动脉血NO含量测定:各组动物分别于注入 LPS 前,注入即刻(0 min),5 min,30 min 各时间点抽取颈动脉血样,检测肺循环NO含量,按试剂盒说明操作。
1.3 统计学处理
采用SPSS16.0统计学软件进行分析。计量资料x±s表示。组间比较采用单因素方差分析,Graphpad grim 5.0绘制Ach剂量依赖性曲线图,并计算Ach曲线的EC50和最大效能(Emax)。P<0.05为差异有统计学意义。
2 结果
2.1 各组注入LPS后MAP的变化
观察30 min,N组和A组的MAP未随时间而出现明显变化,2组各时间点MAP也无明显差异(P>0.05);注入LPS各组MAP在给药前及注入即刻无差异,但5 min时出现下降,明显低于对照组(3组分别降至 52.78±4.020,52.97±3.146,49.89±1.801,P<0.01),并呈持续性下降,30 min时降至最低,均明显低于对照组(3组分别降至30.88±0.921,31.26±1.967,30.96±1.513,P<0.01);与 L 组比较,PHC2+L组和PHC5+L组在各时间点MAP均无差异,2组对LPS注入后MAP变化无影响(P>0.05)。见图1。
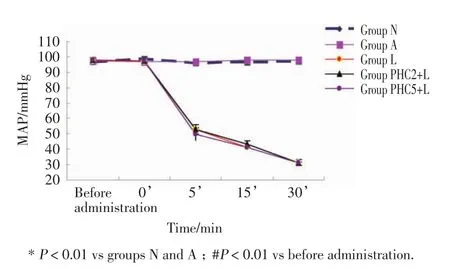
图1 各组注入N S或L PS后M A P变化Fig.1 C hange in mean arterialpressure after the in j ection of normalsaline or lipopolysaccharide in each group
2.2 各组PE预收缩后加入Ach的舒张反应变化及各组EC50和Emax比较
除N组张力无明显变化外,其余各组加入Ach后出现明显舒张(P均<0.01);与N组比较,除A组Ach0.01外,其余各组各剂量Ach均明显引起肺动脉舒张作用(P<0.01);与A组比较,L组可剂量依赖性引起Ach舒张反应降低(P均<0.01),EC50增加(P<0.01),曲线右移;PHC2不能逆转注入LPS后Ach的舒张反应的降低,PHC2+L与L组EC50无显著差异(P>0.05);而PHC5组可逆转注入LPS各剂量Ach引起的舒张反应的降低,EC50减小,较L组有显著性差异(P<0.01),而与低剂量PHC2比较,PHC5引起的各剂量Ach舒张均有显著性差异(P<0.01),曲线右移。见图2,表1。
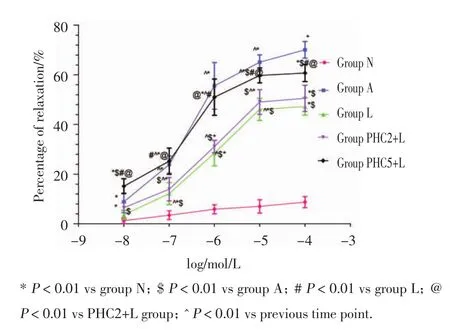
图2 兔肺动脉环对A ch舒张反应百分比(x±s)Fig.2 Percentage of dilation of vascular ring in response to acetylcholine(x ±s)
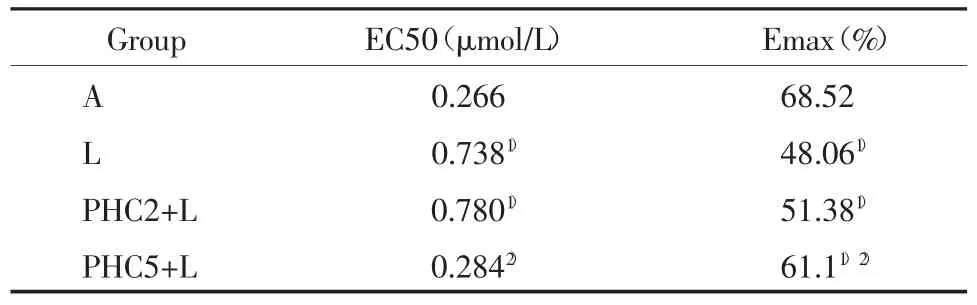
表1 各组A ch剂量依赖曲线的E C50,EmaxT ab.1 E C50 and Emax of the dose-dependent curve for acetylcholine
2.3 各组肺循环NO含量测定
N组和A组静注生理盐水前及后各时点NO含量无明显差异;与N组和A组对照组比较,注入LPS各组在给药前及注入即刻NO含量无明显差异,除PHC2+L组5 min外,3组5 min和30 minNO含量均明显高于N组和A组对照组(P<0.01);与L组比较,PHC5+L组在5 min和30 min测得NO含量明显增高(P值分别为0.042和0.001 2),同时明显高于PHC2组(P均<0.01);L组和PHC5+L组含量于5 min时较前一时间点明显增加(P值分别为0.028和 0.019),LPS 3组于 30 min均升至最高(P均<0.05)。见表 2。
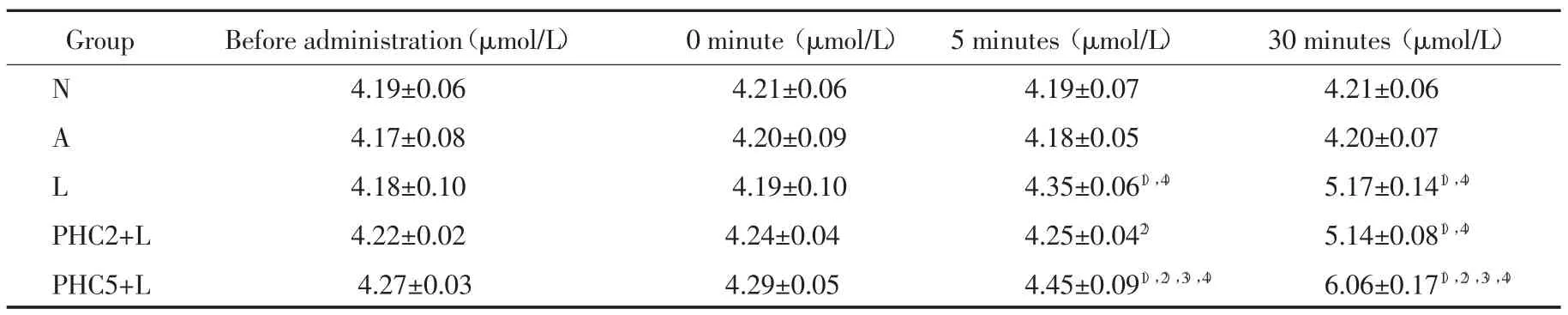
表2 各时间点NO含量测定(x±s)T ab.2 NO content at each time point(x ±s)
3 讨论
人和兔肺血管内皮细胞或平滑肌细胞中分布有M1和M3受体,作用于肺血管内皮细胞M受体,使血管舒张;作用于平滑肌细胞相应M受体,引起血管收缩。内毒素休克后,Ach大量释放,但内皮细胞中的M受体数量减少,影响NO的生成,Ach对肺血管内皮依赖性舒张抑制;同时,LPS致肺血管平滑肌上M受体密度上调,Ach转而通过直接刺激血管平滑肌上的M受体产生血管收缩作用[4],加重肺循环阻力的增高。既往大量研究主要探讨长托宁对肺组织NO含量变化影响,NO来源不同,浓度不同的NO可能在发病机理上有不同甚至相反的作用:李娟等研究证实预先使用长托宁,可减轻LPS造成的急性肺损伤,机制可能是抑制LPS引起的大鼠肺组织NF-κB 活性增加,抑制 eNOS 活性减少[6];雷利荣等发现经长托宁处理后的脓毒症小鼠,肺组织iNOSmRNA含量明显减少[7]。而本实验从肺血管张力测定角度,观察早期应用不同剂量长托宁是否减轻内毒素致肺血管张力增高,并同步检测肺循环而非肺组织NO含量变化,探讨预注入不同剂量长托宁对内毒素休克肺循环的影响。
本实验观察到,Ach可剂量依赖性引起兔正常肺动脉的舒张反应,内毒素组肺动脉对Ach舒张反应显著减弱。内毒素致ALI早期血液氧合已开始发生变化,因此应早期进行有效药物干预。长托宁注入体内10 min后血药浓度达到较高水平,20~30 min即可达到峰值血药浓度,本研究观察到注入LPS前15 min预注入大剂量长托宁,可有效改善LPS引起的Ach舒张反应降低,而小剂量长托宁对LPS引起的Ach舒张反应降低无此效应,可能由于使用长托宁时,需达到一定剂量后才能发挥效果,M型受体被阻挡50%并不能影响乙酰胆碱能神经系统的功能,阻挡70%时才明显降低[8]。进一步观察到,大剂量长托宁预处理后,肺循环NO较内毒素组增加,推测大剂量长托宁可能保护血管内皮细胞及其功能,肺血管内皮细胞损伤减轻,从而使内皮源性NO合成和释放增加,调节肺血管的舒张。而长托宁是否阻断平滑肌上的M受体密度的上调,致使内毒素休克肺血管收缩反应减弱,有待后续研究。另外,有研究认为,抗胆碱药物可引发某些副作用,如谵妄等,对大剂量应用长托宁提出质疑。术后谵妄是一种暂时性的认知能力障碍和意识水平降低的精神状态,且该症状发生率随年龄增加而相应增加,因此,高龄患者应用大剂量长托宁仍需谨慎。大剂量长托宁虽有改善患者微循环,保护肺循环等积极作用,但其引发的相关副作用及利弊的权衡,仍需进一步实验及临床研究。
综上所述,内毒素休克后Ach介导舒张反应降低,而预注入大剂量长托宁可逆转此作用,这与改变肺循环NO含量有关,对内毒素休克肺循环具有保护作用。
[1]Liaudet L,Szabo C,Evgenov OV,et a1.Flagellin from Gram-negative bacteria is potent mediator of acute pulmonary inf1ammation in sepsis[J].Shock,2003,19(2):l31-137.
[2]Albert M,Losser MR,Hayon D,et a1.Systemic and renal macro-and microcirculatory responses to arginine vasopressin in endotoxic rabbits[J].Crit Care Med,2004,32(9):1891-1898.
[3]马铃,李万冬,陈卫民,等.异丙酚对脂多糖诱导的急性肺损伤大鼠肺组织Toll样受体表达的影响[J].中国医科大学学报,2009,38(4):261-264.
[4]Kalsner S.Cholinergic constriction in the general circulation and its rolein coronary artery spasm[J].Circ Res,1999,65(2):237-257.
[5]杨小龙,袁世荧.盐酸戊乙奎醚对大鼠脓毒症肺损伤的影响[J].华中医学杂志,2007,31(2):86-87.
[6]李娟,李俊,潘建辉,等.盐酸戊乙奎醚预先给药对大鼠内毒素性急性肺损伤的影响[J].中华麻醉医学杂志,2007,27(1):70-74.
[7]雷利荣,王焱林,贾宝辉,等.盐酸戊乙奎醚对腹腔感染脓毒症小鼠肺 iNOS 表达的影响[J].中华急诊医学杂志,2006,l5(8):735-737.
[8]曾繁忠.新药长托宁研究和应用概况论文集[M].四川:成都科技出版社,2002:4-14.
