无镁诱导培养大鼠海马神经元癫痫放电模型中延迟整流钾电流的变化
2011-05-25郭凤孙威姚阳高青华闵冬雨封瑞胡慧媛蔡际群郝丽英
郭凤,孙威,姚阳,高青华,闵冬雨,封瑞,胡慧媛,蔡际群,郝丽英
(1.中国医科大学药学院药物毒理教研室,沈阳 110001;2.沈阳医学院生理教研室,沈阳 110034)
海马是癫痫的重要致痫病灶之一,其CAl与CA3区锥体神经元是痫性放电的初始位点[1]。研究表明,体外培养的海马神经元在无镁细胞外液的作用下可形成异常放电,而异常放电的作用机制并不清楚。离子通道结构和功能的障碍均可引起痫性发作,而电压依赖性钾通道在保持神经元的膜电位和神经递质的释放过程中发挥重要作用[2]。延迟整流钾电流(delayed rectifier K+current,IK)作为电压依赖性钾电流的重要组成部分,广泛分布于中枢神经系统,特别是海马部位。本研究拟通过“无镁细胞外液”诱导原代培养大鼠海马神经元异常放电模型研究延迟整流钾电流的变化,进一步探讨无镁诱导神经元异常放电的作用机制。
1 材料与方法
1.1 材料
动物:新生24 h内Wistar大鼠,雌雄不限,由中国医科大学动物实验中心提供。
主要试剂与仪器:DMEM/F12培养基、NeurobasalTM-A-Medium、马血清、B27(Gibco)、胎牛血清、D-Hanks液(Hyclone)、胰蛋白酶(Sigma)、FITC 标记羊抗兔 IgG (中杉)、倒置显微镜(Olympus)、Axopatch200B放大器(Axon Instrument)数模转换器(Axon Instrument)。
1.2 方法
1.2.1 原代神经元的培养:取新生24 h内Wistar大鼠脑,显微镜下分离双侧海马置于D-Hanks液;0.125%胰蛋白酶于37℃培养箱消化15~30 min。种植液(DMEM/F12+15%血清)终止消化,调整细胞密度为2×105/cm2后种植于2.0 cm×2.0 cm的盖玻片上。3~4 d半量换饲养液(2%B27+NeurobasalTM-AMedium),体外培养1个月。
1.2.2 无镁细胞外液诱导原代培养大鼠海马神经元放电:无镁液(mmol·L-1):NaCl 145,KCl 2.5,CaCl22,HEPES 10,Glucose 10,Glycine 0.001,用 NaOH 调pH 至 7.4。细胞外液(mmol·L-1):NaCl 135,KCl 5.4,MgCl21.0,NaH2PO40.33,HEPES 10,Glucose 5.5,用NaOH 调 pH 至 7.4。电极内液 (mmol·L-1):K-Aspartate 50,KCl 20,HEPES 20,EGTA 1,MgCl21,Ca-Cl20.2,NaCl 13.6,K2ATP33,KOH 调 pH 至 7.4。将培养12 d后的神经元放入“无镁”细胞外液处理3h后,重新放入含镁的正常细胞外液中培养。电阻为2~5 MΩ。利用膜片钳电流钳技术在I-Normal模式下,分别记录神经元在正常细胞外液、“无镁”细胞外液3 h并恢复正常细胞外液的自发性发电活动。
1.2.3 膜片钳技术记录延迟整流钾电流:培养细胞第12 d后,应用膜片钳电压钳技术分别记录神经元在正常细胞外液、“无镁”细胞外液3 h并恢复正常细胞外液的钾电流。钾电流的记录方法:在V-clamp模式下,设定保持电位为-80 mV,以10 mV为步阶使膜电位由-60 mV逐步去极化至+60 mV,持续时间300 ms,可记录到外向电压依赖性钾电流。
1.3 统计学分析
所有数据均用SPSS 12.0统计学软件进行处理,结果以x±s表示,两组间比较用t检验。
2 结果
2.1 海马神经元的培养
神经元12~24 h后大部分贴壁,随时间延长形态多变,突起逐渐增多,培养第8天后,神经元可见锥体形状,有轴突与树突,细胞富有立体感,细胞核呈空泡状,核仁清晰可见。第10天后,细胞之间通过突触联系,可形成典型的神经网状结构(图1),至28 d培养液中有悬浮的细胞碎片。
2.2 海马自发性放电记录
用正常细胞外液处理,可以记录到神经元(n=6)正常的自发性动作电位(图2A)。经无镁细胞外液处理3 h并恢复正常细胞外液后,神经元(n=6)可出现两种自发性动作电位,一种是周期性的电压幅度为50~80 mV“癫痫样”自发性放电(图2B),放电频率为8~20 Hz;另一种是电压幅度为50 mV左右的“楔形”放电(图2C)。
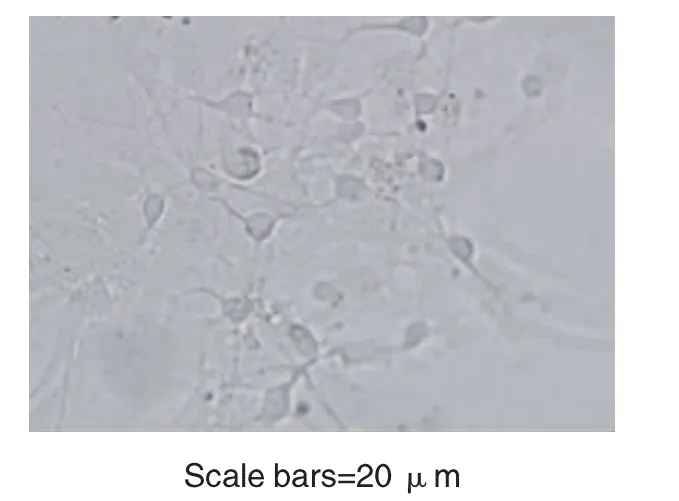
图1 大鼠海马细胞的原代培养 ×400Fig.1 Primary cultured rat hippocampal neurons×400
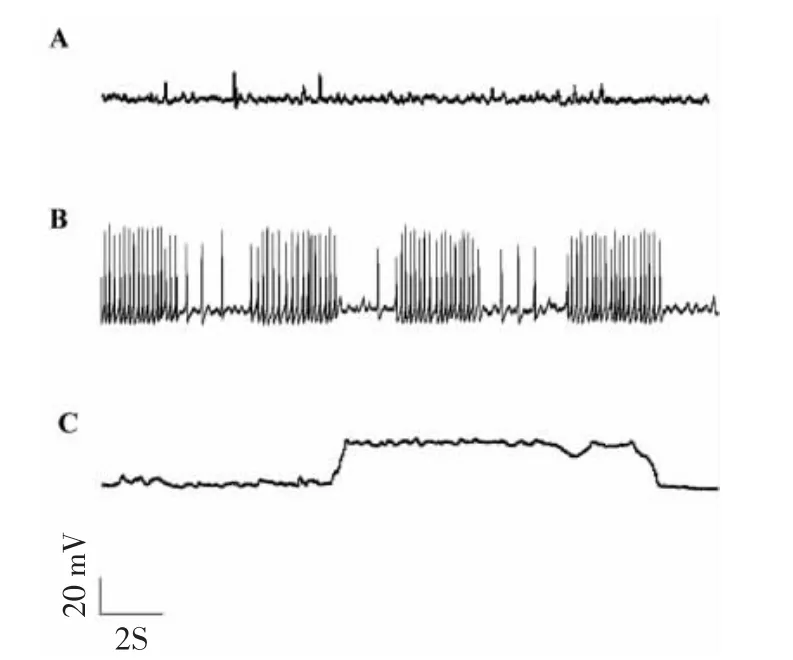
图2 无镁处理诱导培养海马细胞癫痫样放电Fig.2 Epileptiform discharge in cultured hippocampal neurons treated with Mg2+-free extracellular fluid
2.3 无镁对延迟整流钾电流的峰值与电流-电压曲线的影响
延迟整流钾电流为最后100 ms激发出的外向钾电流的主要成分。用pClamp10.0计算出每个细胞的电容,电流值与电容之比为电流密度(pA·pF-1)。无镁组(图3B)可使对照组(图3A)的IK峰密度值从(3.65±1.29)pA·pF-1增大到(9.09±2.41)pA·pF-1(与对照组比较,P<0.01,n=6)。以各命令电压下的平均电流密度值(pA·pF-1)对相应的膜电位(mV)作图,制得I-V曲线。结果显示,无镁组可增大不同膜电位下的IK平均电流密度,但曲线的形状无明显变化(图4)。
3 讨论
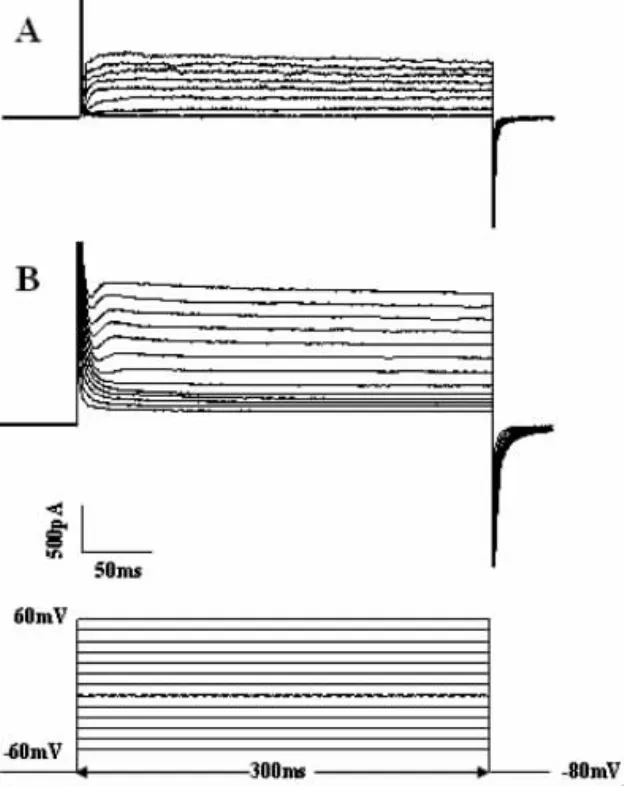
图3 无镁处理对延迟整流钾电流的作用Fig.3 Effect of Mg2+-free extracellular fluid on IK
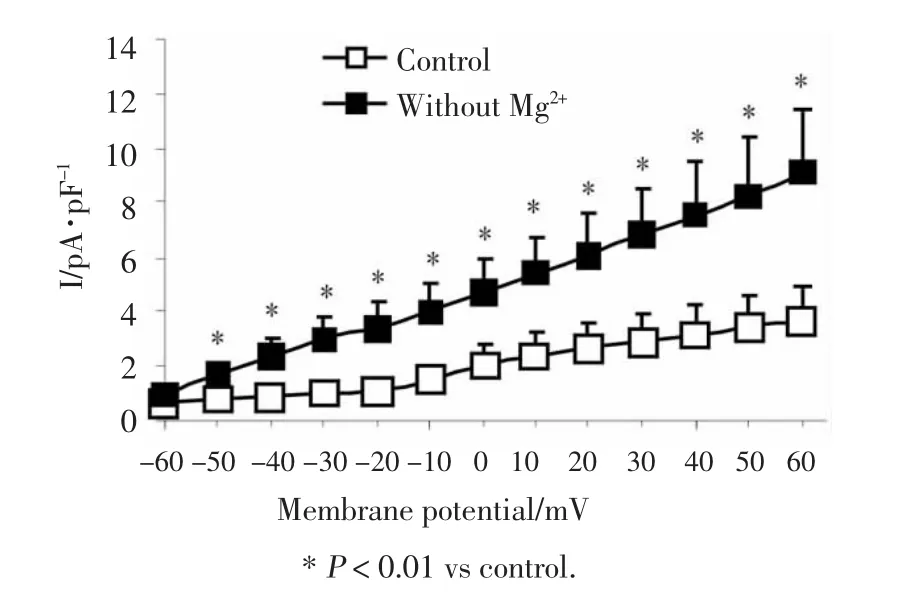
图4 无镁处理对延迟整流钾电流电流-电压曲线的影响Fig.4 Effect of Mg2+-free extracellular fluid on I-V curve of IK
研究表明,无镁诱发的神经元自发的动作电位与癫痫发作时电生理活动相似,可以产生反复循环的自发性“癫痫样”发电,而抗癫痫药物如苯巴比妥、苯妥英钠等都可以阻滞这类动作电位[3,4]。本研究参照Sombati等的实验方法,利用无镁细胞外液模拟“癫痫微环境”,发现经无镁细胞外液作用3 h后,神经元可周期性地出现电压幅度为50~80 mV“癫痫样”自发性放电和“楔形”放电,从而证实我们建立了癫痫神经元模型。本研究发现,培养神经元必须形成突触联系与网络结构,具有传递信息的形态学基础后,才能建立癫痫自发性发电的模型,而分散培养的海马细胞没有自发性动作电位。
因此,制备表面光滑、轮廓清楚、立体感强的神经细胞是进行膜片钳记录的必要前提。本方法培养的海马神经元具备适用膜片钳研究的前提条件,特别是需要与少量的胶质细胞混合培养,神经元和神经胶质细胞之间具有一定程度的信息传递。此种培养条件下的的神经元活性较强,封接率可达50%以上,为进一步的功能实验奠定了良好的技术基础。
目前癫痫发病机制仍不清楚。钾通道决定细胞膜的静息电位、膜兴奋性和动作电位的形状与频率,在癫痫研究中近年来愈加受到重视。研究表明钾通道 KCNQ2/Q3、KATP、、KV1.1 在癫痫发病机制中起重要作用[5]。IK是一种重要的钾电流成分,最初发现于乌贼巨轴突。哺乳动物脑中的IK电流由多种电压依赖性钾通道亚型构成,包括KV1.1、KV1.2、KV1.5、KV2.1、KV2.2、KV3.1 和 KV3.2[6]。
以往众多研究发现,癫痫发作诱导的神经元活动增加、体内缺氧、谷氨酸刺激和实验性缺血能导致IK增加[7]。Huang等[8]发现抗癫痫药左乙拉西坦在NG108-15细胞株中可以浓度依赖性的形式抑制IK并且使IK的稳态激活曲线向去极化方向移动,可能是其在体内具有抗癫痫作用的药理机制之一。本研究显示与对照组相比,无镁组IK电流密度值增大,推测IK增大可能与无镁诱导体外培养大鼠海马神经元自发异常放电的基础病理机制相关,具体的相关机制则需进一步的实验加以证明。
[1]Engel JJr.Mesial temporal lobeepilepsy:what havewelearned?[J].Neuroscientist,2001,7(4):340-352.
[2]Padilla K,Wickenden AD,Gerlach AC,et al.The KCNQ2/3 selective channel opener ICA-27243 binds to a novel voltage-sensor domain site[J].Neuronsci Lett,2009,465(2):138-142.
[3]Blair RE,Sombati S,Churn SB,et al.Epileptogenesis causes an N-methyl-d-aspartatereceptor/Ca2+-dependent decreasein Ca2+/calmodulin-dependent protein kinase II activity in a hippocampal neuronal culture model of spontaneous recurrent epileptiform discharges[J].Eur JPharmacol,2008,588(1):64-71.
[4]Blair RE,Deshpande LS,Sombati S,et al.Prolonged exposure to WIN55,212-2 causes downregulation of the CB1 receptor and the development of tolerance to its anticonvulsant effects in the hippocampal neuronal culture model of acquired epilepsy [J].Neuropharmacology,2009,57(3):208-218.
[5]Hahn A,Neubauer BA.Sodium and potassium channel dysfunctions in rare and common idiopathic epilepsy syndromes [J].Brain Dev,2009,31(7):515-520.
[6]Chen X,Johnston D.Properties of single voltage-dependent K+channelsin dendritesof CA1 pyramidal neuronsof rat hippocampus[J].J Physiol,2004,559(Pt 1):187-203.
[7]Misonou H,Mohapatra DP,Menegola M,etal.Calcium-and metabolic state-dependent modulation of the voltage-dependent Kv2.1 channel regulates neuronal excitability in response to ischemia [J].JNeurosci,2005,25(48):11184-11193.
[8]Huang CW,Tsai JJ,Huang CC,et al.Experimental and simulation studies on the mechanisms of levetiracetam-mediated inhibition of delayed-rectifier potassium current (Kv3.1):contribution tothe firingof action potentials[J].JPhysiol Pharmacol,2009,60(4):37-47.
