二氢青蒿素对结肠癌细胞HCT116凋亡基因表达图谱的影响
2011-05-25王国丽刘莹宿文辉许琳孙卢浩然卢敏
王国丽,刘莹,宿文辉,许琳,孙卢浩然,卢敏
(中国医科大学 1.基础医学院生物化学与分子生物学教研室;2.附属第一医院肛肠外科,沈阳 110001)
青蒿素于20世纪70年代由我国科学家从植物黄蒿中成功分离后,替代传统抗疟药喹啉,成为世界范围治疗脑型疟疾和恶性疟疾的首选药物。青蒿素及其衍生物具有抗寄生虫、抗孕、抗肿瘤、抗纤维化、抗病毒、抗真菌、调节免疫和心血管系统等广泛的药理作用,其中的抗肿瘤作用近年来逐渐引起关注[1,2]。二氢青蒿素(dihydroartemisinin,DHA)为青蒿素衍生物的主要活性代谢体,1998年美国国立癌症研究所报告了在抗肿瘤药物筛查项目中DHA对60种肿瘤细胞的细胞毒作用的检测结果[3]。DHA的抗肿瘤作用,在不同的结肠癌细胞株得到验证,并且发现可能通过线粒体途径或者内质网应激诱导细胞凋亡[3~6]。
本研究利用微阵列RTProfilerTMPCRArray Human Apoptosis和实时定量PCR方法,检测DHA处理前后结肠癌细胞HCT116的84种凋亡通路关键蛋白的基因表达水平,以期全面认识并深入阐明DHA对结肠癌细胞的促凋亡分子机制。
1 材料与方法
1.1 材料
DHA购自中国药品生物制品检定所;细胞培养、RNA提纯及反转录试剂主要购自宝生物和Invitrogen 公司;RTProfilerTMPCR Array Human Apoptosis(PAHS-012A)购自 SABiosciences公司。
1.2 方法
1.2.1 细胞培养:结肠癌HCT116细胞株购自中科院上海生命科学院生物化学与细胞生物学研究所。培养条件:DMEM培养基含10%胎牛血清、100 U/ml青霉素、0.1 mg/ml链霉素。培养箱37℃、5%CO2、100%湿度。
1.2.2 MTT实验:DHA对HCT116细胞的生长抑制率通过MTT实验测定。接种细胞于96孔培养板,细胞数5 000/孔。培养至24 h,更换加入不同浓度DHA的培养液。DHA浓度分别为0(对照组)、40、80、160μmol/L,每浓度设6个平行孔。加药后24 h、48 h或72 h进行呈色反应。每孔加入MTT溶液(5 g/L)20μl继续孵育 4 h,加入 150μl DMSO,振荡 10 min后在492 nm处测定吸光度(Absorbance,A)。各浓度平行孔吸光度均值减去无细胞孔吸光度均值后,按下列公式计算细胞生长抑制率。
抑制率=[A(对照组)-A(用药组)]/A(对照组)×100%1.2.3 凋亡基因表达图谱检测:接种等量HCT116细胞于直径10 cm的细胞培养皿。培养24 h后细胞融合度约40%,更换培养基。DHA组细胞培养基内DHA浓度80μmol/L,对照组细胞培养基未加入DHA。继续培养24 h,收集细胞,用Trizol(Invitrogen)提纯RNA。然后用DNase I消化RNA样品,去除可能存在的基因组DNA,并用RNeasy誖MinE-luteTM纯化试剂盒(Qiagen)对获得的RNA进行纯化,再通过琼脂糖电泳和紫外吸收测定法检测RNA的质量、浓度和纯度。cDNA合成应用SuperScript.IIIReverse Transcriptase(Invitrogen),20 μl反应体系中加入总RNA 1.5μg。操作按照说明书进行。
cDNA 与 2倍 SuperArray PCR master mix(Cat.No.PA-112)充分混合,加10μl至PCR Array对应的每个孔中。实时定量PCR程序设置为变性95℃,10 min;扩增 40个循环,95 ℃ 15 s,60℃ 1 min。采集荧光,进行溶解曲线分析。
数据分析采用ΔΔCt方法。荧光阈值设定为0.15,取各 PCR Array管家基因 B2M、HPRT1、GAPDH 和 ACTB 的阈值循环数(cycle threshold,Ct)均值为本底,按公式(1)计算ΔCt。ΔΔCt的计算公式为(2)。通过 2-ΔΔCt计算 DHA 组与对照组对应基因的表达差异[7]。

上调倍数(fold up-regulation)>2为基因表达显著上调,下调倍数(fold down-regulation)<-2为基因表达显著下调。基因表达上调及下调的定性结论具有可重复性。实时PCR微阵列实验由康成生物工程有限公司(中国上海)提供技术服务。
2 结果
2.1 DHA处理的条件选择及RNA样品的鉴定
DHA作用于HCT116细胞的MTT实验结果表明HCT116细胞的生长抑制率随DHA浓度的增加及作用时间延长而升高,与文献报道相符[5,6],见表1。我们选择80μmol/L 24 h做为DHA组细胞的药物处理条件,该条件处理后的细胞生长抑制率约9%,绝大多数细胞处于凋亡前期,其基因表达改变可反映DHA诱导凋亡的分子机制。
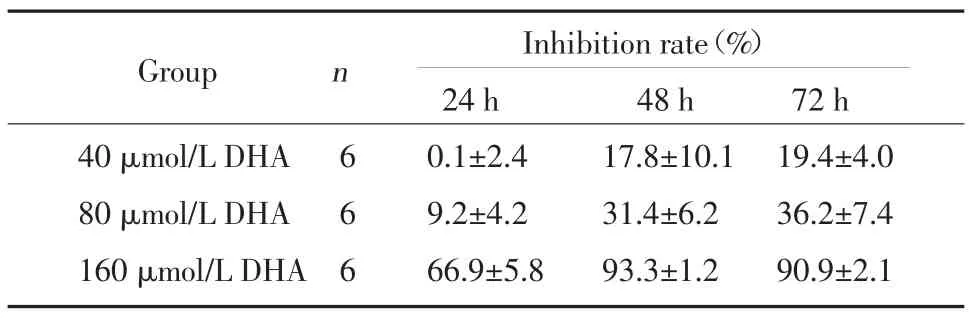
表1 D H A对结肠癌细胞HC T116的生长抑制T ab.1 Inhibitory effect of D H A on cellgrowth in HC T116 cells
DHA组和对照组RNA样品的Abs260/Abs280比值分别为2.00和2.02。变性琼脂糖凝胶电泳照片上,DHA组和对照组的28S和18S核糖体RNA带均亮而浓,前者密度大约是后者的2倍,而且能观察到一个由低分子量RNA组成的略扩散带(图1)。Abs260/Abs280比值分析和变性琼脂糖凝胶电泳鉴定证实RNA样品的纯度和质量符合微阵列研究的要求。

图1 RNA样品的变性琼脂糖凝胶电泳鉴定Fig.1 D enaturing agarose gel electrophoresis of RNA
2.2 DHA诱导的HCT116细胞凋亡基因差异表达
与对照组相比较,DHA组HCT116细胞被检测的84种凋亡基因中,有35种基因表达水平显著改变,即上调倍数高于2或者下调倍数低于-2。TNFα、TNFα、TRAILR、CASP、GADD45GADD45A 等 26 种基因表达显著上调,而TP73、CASP2、Bcl2等9种基因显著下调,见表2。
3 讨论
本研究通过DHA诱导的凋亡基因表达图谱结果表明:促凋亡基因中,TNFα、TNFR1、TRAILR、CASP10、CASP3、CASP4、GADD45 等基因表达显著上调,CAPS6、P73、BIK等表达下调;抗凋亡基因中,BCL2、AKT、BAG1的表达下调,而一些IAP家族成员的基因表达上调2~4倍。

表2 D H A诱导结肠癌细胞HC T116凋亡基因的显著差异表达T ab.2 Significantly differential expressions of apoptotic genes induced by D H A in HC T116 cells
结合本研究检测到的凋亡基因显著差异表达及他人的实验结果[3~6,8~9],我们提出了 DHA 诱导HCT116细胞凋亡的信号网络假说(图2)。DHA作用后HCT细胞内部分促凋亡基因表达的显著上调和部分抗凋亡基因的显著下调提示DHA可能不同程度地依赖3条经典凋亡途径诱导HCT116细胞的凋亡,其一为内质网途径;其二为TNFR1、TRAILR等死亡受体介导途径;其三为线粒体途径。Uhlemann等提出青蒿素可通过结合内质网Ca2+泵(SERCA),升高胞质内Ca2+浓度发挥药理作用,而且结合部位与SERCA1a的特异性抑制剂毒胡萝卜素相同[8]。Lu等[4]则认为DHA可能通过铁依赖的自由基产生促发内质网应激,导致内质网应激相关蛋白的高表达。因此胞质Ca2+浓度升高及内质网应激则可能决定其复杂凋亡信号转导的引发。此外,在DHA诱导HCT116细胞凋亡的过程中,存在BID蛋白作为内质网途径和线粒体途径的交叉点的可能性,胞质Ca2+浓度升高及内质网应激可以驱使内质网内BID蛋白转位至线粒体诱发凋亡[9]。

图2 D H A诱导HC T116细胞凋亡的信号网络假说Fig.2 H ypothesis of D H A-induced apoptosis networ k in HC T116 cells
实时PCR微阵列技术结合实时定量PCR和其他DNA微阵列基因芯片的优点,在一次实验中能够准确定量检测上百个基因的mRNA水平。既克服了实时定量PCR检测基因表达图谱工作量大耗时久的缺点,又将检测精确度提高到与实时定量PCR相当的水平,实验结果无须再进行实时定量PCR验证。本研究应用人凋亡实时PCR微阵列较全面地检测了凋亡前期DHA对结肠癌细胞的凋亡相关分子的基因表达影响,增进了对DHA诱导结肠癌细胞凋亡机制的理解。经过进一步验证和完善,可望对DHA抗肿瘤药物作用机制的研究带来突破性进展。
[1]贺晓青,方鹏飞.青蒿素极其衍生物的药理作用[J].医药导报,2006,25(6):528-530.
[2]孙雅洁,王京燕.青蒿素及其衍生物体外抗肿瘤活性研究[J].解放军药学学报,2010,25(4):315-317.
[3]Beekman AC,Wierenga PK,Woerdenbag HJ,et al.Artemisinin-derived sesquiterpenelactones aspotential antitumor compounds:cytotoxic action against bone marrow and tumor cells[J].Planta Med,1998,64(7):615-619.
[4]Lu JJ,Chen SM,Zhang XW,et al.The anti-cancer activity of dihydroartemisinin is associatedwith induction of iron-dependent endoplasmic reticulum stress in colorectal carcinoma HCT116 cells[J].Invest New Drugs,2010,July 7,Epub ahead of print.
[5]邵义如,朱尤庆,刘敏.二氢青蒿素对结肠癌细胞系SW480增殖凋亡的影响[J].武汉大学学报,2008,29(3):319-323.
[6]朱奔奔,谢东.二氢青蒿素抑制结肠癌细胞株HCT-116并诱导凋亡的实验研究[J].航空航天医药,2010,21(7):1083-1085.
[7]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2 (-delta delta C(T))method[J].Methods,2001,25(4):402-408.
[8]Uhlemann AC,Cameron A,Eckstein-Ludwig U,et al.A single amino acid residue can determin the sensitivity of SERCAs to artemisinins[J].Nat Struct Mol Biol,2005,12(7):628-629.
[9]胡洁,何东花,高良,等.Bid蛋白在内质网和线粒体相关的凋亡过程中的作用[J].中华血液学杂志,2007,28(7):466-469.
