糖尿病肾病与血清内脂素、C反应蛋白的关系
2011-05-23苏桂兰唐忠秀刘树娇陈春莲
苏桂兰,唐 灵,唐忠秀,刘树娇,陈春莲,陈 虹
(桂林医学院附属医院,广西桂林 541001)
近年研究发现,炎症因子在糖尿病肾病(DN)的发生、发展中起到一定作用。血清内脂素、C反应蛋白(CRP)作为炎症因子,是否通过炎症反应参与了DN的发展,目前研究较少。2009年 10月 ~2010年5月,我们观察了不同发展阶段 DN患者血清内脂素、CRP水平,以探讨其与 DN的关系,为 DN的诊断及临床防治提供一定的理论依据。现报告如下。
1 资料与方法
1.1 临床资料 选择在我院住院的 2型糖尿病(T2DM)患者 97例,均符合 1999年 WHO制定的糖尿病诊断标准,且排除恶性肿瘤、急慢性感染、糖尿病急性并发症、长期口服噻唑烷二酮类药物及调脂药、泌尿系感染及除糖尿病以外的继发性肾病等。根据尿白蛋白排泄率(UAER)分为 3组:正常蛋白尿组(A组 ,UAER<20 μg/min)35例 ,男 16例、女19例,年龄(58.16±8.81)岁,糖尿病病程(2.34±1.19)年 ,BMI(23.16 ±1.62)kg/m2,收缩压 (SBP)(127.16±7.40)mmHg、舒张压 (DBP)(74.63±5.39)mmHg;微量蛋白尿组 (B组,UAER 20~200 μg/min)30例,男 17例 、女 13例,年龄 (57.71 ±11.43)岁,糖尿病病程(6.56±2.16)年,BMI(23.27±1.78)kg/m2,SBP(130.00 ±9.73)mmHg、DBP(73.88±4.89)mmHg;大量蛋白尿组(C组,UAER>200μg/min)32例,男 15例、女 17例,年龄(54.25±8.37)岁,糖尿病病程(17.41±2.61)年,BMI(23.24±1.54)kg/m2,SBP(149.47±2.05)mm-Hg、DBP(75.63±5.27)mmHg。同期选择我院健康体检者 35例作为对照组,男 19例、女 16例,年龄(55.7±11.4)岁。各组性别、年龄具有可比性。
1.2 方法 所有受试者空腹 8~12 h,晨起抽空腹静脉血 3 ml,应用全自动生化分析仪测定空腹血糖(FPG)、血脂、血肌酐 (Scr)、尿素氮(BUN)、糖化血红蛋白(HbA1c)。另取静脉血 2~3 ml静置 1 h后,3 000 r/min离心 5 min,分离血清,标记后贮存于 -76℃低温冰箱,分别采用 ELISA法、免疫比浊法测定血清内脂素、CRP。连续收集 3 d尿液,记录尿量,采用高效免疫比浊法测定尿微量白蛋白,根据24 h尿量计算 UAER,测量 3次取平均值。
1.3 统计学方法 采用 SPSS17.0统计软件,数据以±s表示,多组指标比较采用单因素方差分析,两两比较采用 LSD和 SNK检验,相关分析采用Pearson相关分析和多元逐步回归分析。P≤0.05为差异有统计学意义。
2 结果
2.1 各组血生化指标比较 见表1。
2.2 Pearson相关因素分析 血清内脂素、CRP均与糖尿病病程、SBP、HbA1c、FPG、TG、TC、LDL-C、BUN、Scr、UAER呈不同程度正相关(r内脂素=0.943、0.699、0.511、0.371、0.362、0.398、0.485、0.623、0.832、0.890;rCRP=0.777、0.701、0.416、0.327、0.308、0.307、0.449、0.611、0.817、0.893,P均 <0.01),与 HDL-C呈负相关 (r分别为 =-0.617、-0.546,P均 <0.01),且两者互呈正相关(r=0.940,P均 <0.01),与其他指标无相关性。
2.3 多元线性逐步回归分析 分别以CRP、血清内脂素为应变量,年龄、糖尿病病程、BMI、SBP、DBP、HbA1c、FPG、TG、TC、LDL-C、HDL-C、BUN、Scr、UAER、CRP为自变量进行多元线性逐步回归分析。结果显示 ,糖尿病病程 、HbA1c、TG、TC、Scr、UAER、CRP是血清内脂素的独立危险因素(t分别为4.536、2.462、2.888、3.240、3.681、2.051、8.417,P<0.05或 <0.01);血清内脂素、UAER是 CRP的独立危险因素(t=11.147、4.355,P均 <0.01)。
表1 各组生化指标比较(±s)
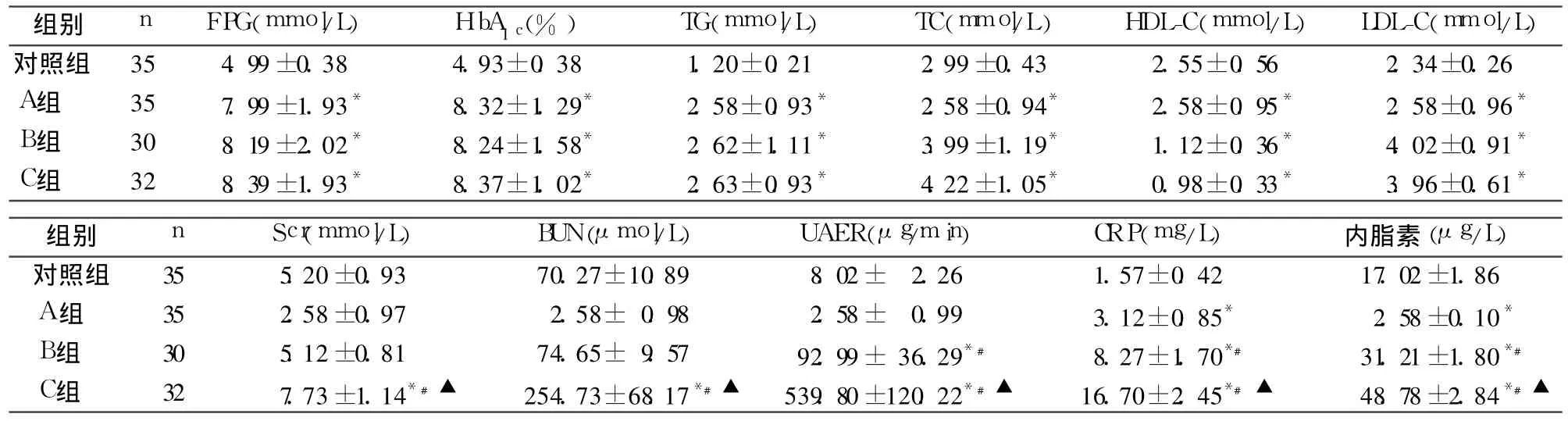
表1 各组生化指标比较(±s)
注:与对照组比较,*P<0.01;与 A组比较,﹟ P<0.01;与 B组比较,▲P<0.01
组别 n FPG(mmol/L) HbA1c(%) TG(mmol/L) TC(mmol/L) HDL-C(mmol/L) LDL-C(mmol/L)对照组 35 4.99±0.38 4.93±0.38 1.20±0.21 2.99±0.43 2.55±0.56 2.34±0.26 A组 35 7.99±1.93* 8.32±1.29* 2.58±0.93* 2.58±0.94* 2.58±0.95* 2.58±0.96*B组 30 8.19±2.02* 8.24±1.58* 2.62±1.11* 3.99±1.19* 1.12±0.36* 4.02±0.91*C组 32 8.39±1.93* 8.37±1.02* 2.63±0.93* 4.22±1.05* 0.98±0.33* 3.96±0.61*组别 n Scr(mmol/L) BUN(μmol/L) UAER(μg/min) CRP(mg/L) 内脂素(μg/L)对照组 35 5.20±0.93 70.27±10.89 8.02± 2.26 1.57±0.42 17.02±1.86 A组 35 2.58±0.97 2.58± 0.98 2.58± 0.99 3.12±0.85* 2.58±0.10*B组 30 5.12±0.81 74.65± 9.57 92.99±36.29*﹟ 8.27±1.70*﹟ 31.21±1.80*﹟C组 32 7.73±1.14*﹟▲ 254.73±68.17*﹟▲ 539.80±120.22*﹟▲ 16.70±2.45*﹟▲ 48.78±2.84*﹟▲
3 讨论
近年研究表明,炎症反应参与了 DN的发生、发展。CRP作为一种全身炎症反应的非特异性标记物,是血管炎症反应的敏感指标之一。肾脏细胞在病理状态下可产生 CRP、转化生长因子、IL-6等多种炎症因子,这些因子相互作用使炎症效应不断扩大,引起炎症级联反应而引发机体的氧化应激,使 LDL氧化为 ox-LDL,后者可直接损伤肾小球内皮细胞,炎症反应还可促进糖化及脂化终末产物修饰血管蛋白,引起管壁增厚、弹性下降。CRP可直接作用于入球小动脉加重肾小球高滤过、高灌注状态[1],还可上调黏附分子表达和下调一氧化氮的生成而加重内皮功能损伤[2],引起肾组织损伤。
血清内脂素是脂肪细胞分泌的参与体内炎症反应及代谢作用的一种重要脂肪细胞因子。国内外多项研究表明,T2DM患者血清内脂素水平高于正常健康者[3,4],本研究结果与其一致。血清内脂素水平与肥胖、内脏脂肪聚集、T2DM、代谢综合征密切相关[5~7]。Kang等[8]研究显示,血清内脂素可在肾小球足细胞和近曲肾小管细胞中合成,在糖尿病高血糖状态可明显促进内脂素的合成;Song等[9]研究发现,肾小球系膜细胞像脂肪细胞一样可合成内脂素,同时血清内脂素参与 DN的发生、发展,可能与炎症反应密切相关;Chen等[10]发现,血清内脂素水平与炎症标志物有显著关联,可通过慢性炎症反应参与DN的发生。同时有研究发现[2],胞外内脂素可激活 NF-κB,引起诱导型一氧化氮合酶表达上调并促进炎性反应,并可通过上调 NF-κB的活性,增强炎症反应和黏附分子的表达而引起内皮功能损伤,同时黏附分子水平的增加又与 DN发生密切相关[4],以上均提示血清内脂素通过促进炎症反应,加重对系膜细胞的损伤作用,加速了 DN进展。
本研究结果显示,糖尿病患者血清内脂素、CRP水平均高于对照组,提示 T2DM存在炎症反应状态,且随着 UAER的增加,两者水平逐渐增高。相关分析显示,血清内脂素、CRP与糖尿病病程、SBP、HbA1c、FPG、TG、TC、LDL-C、BUN、Scr、UAER均呈不同程度正相关,与 HDL-C呈负相关,且两者互呈正相关。提示 CRP参与 DN的发生、发展,与国内外报道一致[11,12]。
综上所述,我们认为血清内脂素、CRP参与了DN的发生、发展。两者联合检测,可反映 DN内皮损害及肾功能损害情况,为进一步明确 DN的发病机制提供依据。
[1]商永芳,张蓉,徐倩,等.早期糖尿病肾病患者血清超敏 CRP水平的变化[J].临床医药实践,2006,(4):267-268.
[2]Verma S,Wang CH,Li SH,et al.A self-fulfilling prophecy:C-reactive protein attenuates nitric oxide production and inhibits angiogenesis[J].Circulation,2002,106(8):913-919.
[3]Bemdt J,Kloting N,Kralisch S,et al.Plasma visfatin concentrations and fat depot-specific mRNA expression in humans[J].Diabetes,2005,54(10):2911-2916.
[4]Chen MP,Chung FM,Chang DM,et al.Elevated plasma level of visfatin/pre-B colony-enhancing factor in patientswith type 2 diabetes mellitus[J].JClin Endocrinol Metab,2006,91(1):295-299.
[5]Dogru T,Sonmez A,Tasci I,et al.Plasma visfatin levels in patients with newly diagnosed and untreated type 2 diabeted mellitus and impaired glucose tolerance[J].Diabetes Res Clin Pract,2007,76(1):24-29.
[6]Filippatos TD,Derdemezis CS,Gazi IF,et al.Increased plasma visfatin levels in subjects with the metabolic syndrome[J].Eur J Clin Invest,2008,38(1):71-72.
[7]Haider DG,Schindler K,Schaller G,et al.Increased plasma visfatin concentrations in morbidly obese subjects are reduced after gastric bangding[J].J Clin Endocrinol Metab,2006,91(4):1578-1581.
[8]Kang YS,Song HK,Lee MH,et al.Visfatin is upregulated in type 2 diabetic rats and targets renal cells[J].Kidney Int,2010,78(2):170-181.
[9]Song HK,Lee MH,Kim BK,et al.Visfatin:a new player in mesangial cell physiology and diabetic nephropathy[J].Am J Physiol Renal Physiol,2008,295(5):1485-1494.
[10]Chen MP,Chung FM,Chang DM,et al.Elevated plasma level of visfatin/pre-B cell colony-enhancing factor in patients with type 2 diabetes mellitus[J].J Clin Endocrinol Metab,2006,91(1):295-299.
[11]Navarro JF,Mora C,Maca M,et al.Inflammatory parameters are independently associated with urinary albumin in type 2 diabetes mellitus[J].Am J Kidney Dis,2003,42(1):53-61.
[12]Jager A,van Hinsbergh VW,Kostense PJ,et al.C-reactive protein and soluble vascular cell adhesion-1 areassociated with elevated urinary albumin excretion but do not explain its link with cardiovascular risk[J].Arterioscler Thromb Vasc Biol,2002,22(4):593-598.
