CD36基因多态性对 2型糖尿病患者血脂和 CRP的影响
2011-05-23郑寿焕李金姬张春子杨秀丽李美子
郑寿焕,李金姬,张春子,杨秀丽,李美子
(延边大学附属医院,吉林延吉 133000)
CD36是一种多功能的清道夫受体,可激活细胞释放前炎症反应性细胞因子、白介素等[1],并参与脂质代谢及动脉粥样硬化的发生。人 CD36基因定位于 7号染色体的 q11.2带,该区域存在 2型糖尿病(T2DM)的易感位点。为探讨 CD36内含子 3[TG]多态性对 T2DM患者血脂、C反应蛋白(CRP)的影响,我们进行了相关研究。现报告如下。
1 资料与方法
1.1 临床资料 选择 2004年 12月 ~2009年 12月在我院住院的 T2DM患者(T2DM组)193例,男 106例、女 87例,年龄(54.0±12.1)岁。根据血脂水平分组,即总胆固醇(TC)>6.45 mmol/L为 TC异常组,≤6.45 mmol/L为 TC正常组;TG>1.88 mmol/L为 TG异常组,≤1.88 mmol/L为 TG正常组;HDL-C<0.9 mmol/L为 HDL-C异常组,≥0.9 mmol/L为HDL-C正常组;LDL-C>3.12 mmol/L为 LDL-C异常组,≤3.12 mmol/L为 LDL-C正常组。根据 CRP分组,≤5.0 mg/L为 CRP正常组,>5.0 mg/L为CRP异常组。同期随机选择在我院健康体检者 80例作为对照组,临床和实验室检查均正常,排除肝、肾、内分泌和心脑血管疾病。男 38例、女 42例,年龄(45.7±17.9)岁。两组性别、年龄具有可比性。
1.2 方法
1.2.1 CD36基因多态性检测 ①基因组 DNA提取:抽取受检者肘静脉血 3 ml,用 Promega公司产Wizard 基因组 DNA纯化试剂盒提取 DNA。所得DNA经紫外分光光度计定量,并置于 -70℃保存备用。②PCR扩增目的基因片段:根据美国国立卫生研究院维护的基因序列数据库中所报告的序列设计、北京华美公司合成的 CD36内含子 3基因引物:上游引物:5′-ATTTATAAAAGAAGTTGCAC-3′,下游引物:5′-GTTTACCTACAATTTAATAA-3′;PCR循环参数:94℃预变性 3 min,94℃变性 1 min,49℃退火 1 min,72℃延伸 1 min,循环 35次,最后 72℃延伸 5 min。用 5%琼脂糖凝胶电泳分析 PCR扩增产物。③PCR扩增产物直接测序:PCR产物用凝胶电泳 DNA回收试剂盒纯化回收 DNA片段后,送北京奥莱博生物技术有限责任公司,完成 PCR扩增产物测序。
1.2.2 血脂、CRP检测 抽取受检者肘静脉血 3 ml,采用日立 7600-101全自动生化分析仪检测 TC、TG、HDL、LDL、CRP水平 。
1.3 统计学方法 采用 SPSS13.0软件进行统计分析,CD36内含子 3[TG]重复序列多态性各组间分布情况比较采用 χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 两组 CD36内含子 3[TG]重复序列基因多态性分布比较 PCR反应扩增产物测序结果显示,两组CD36内含子 3全部为杂合子且存在[TG]重复序列,[TG]重复次数为 11~16次,如图 1所示。据[TG]重复序列出现的频数分为 11/>11、12/>12、>12/>12,各频数在对照组中分别为 37.5%(30/80)、45.0%(36/80)、17.5%(14/80),在 T2DM组中分别为 28.5%(55/193)、50.3%(97/193)、21.2%(41/193),同频数比较差异均无统计学意义。
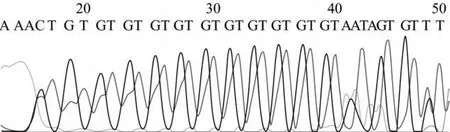
图1 PCR扩增产物直接测序结果
2.2 CD36内含子 3[TG]重复序列基因多态性对T2DM患者血脂、CRP的影响 见表1。
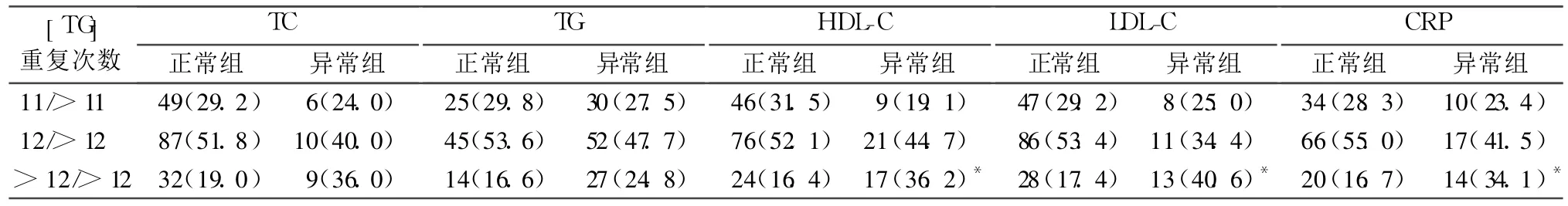
表1 CD 36内含子 3[TG]重复序列基因多态性分布时 T2DM患者血脂、CRP的影响[例(%)]
3 讨论
CD36是巨噬细胞表面的一种 B类清道夫受体,广泛存在于单核细胞、血小板、内皮细胞、视网膜色素上皮细胞、脂肪细胞等,参与炎症、止血、免疫清除、脂质代谢和动脉粥样硬化等病理生理过程[2]。Zhang等[3]研究指出,CD36表达增加可能是导致糖尿病患者动脉粥样硬化的机制之一,高糖介导 CD36mRNA翻译增加使巨噬细胞表面 CD36表达增高,为糖尿病时动脉粥样硬化加剧提供了基础。
目前已明确,高 LDL-C和低 HDL-C对动脉粥样硬化的形成具有重要作用。T2DM患者脂质代谢紊乱的三联症(即 TG升高、LDL升高、HDL降低)是心血管疾病的危险因素[4]。高脂血症可导致肾小球高滤过,加重糖尿病患者的肾脏损害[5]。LDL-C升高,可促进动脉中层平滑肌细胞过度增生,加速动脉粥样硬化,增加肾小球毛细血管内压,导致肾小球高滤过。过高的 LDL-C滞留于内皮下,经细胞氧化修饰形成氧化型低密度脂蛋白(ox-LDL)。ox-LDL能增加氧自由基的产生,从而促进肾小球内过氧化物阴离子生成,加快糖尿病肾病进展。另外,LDL-C尤其 ox-LDL具有化学趋化作用,被巨噬细胞摄取后刺激其产生生产因子和细胞因子,促进肾间质纤维化[6]。LDL-C水平增高,还可导致免疫复合物堆积,并黏附大量的巨噬细胞,两者的复合物可释放炎性介质[7]。对糖尿病肾病患者而言,炎性状态使 LDL易氧化为 ox-LDL,高水平的 ox-LDL具有细胞毒作用,可损害肾小球小动脉血管内皮细胞和平滑肌细胞,造成白蛋白尿的进一步增加[8]。Sampson等[9]证实,ox-LDL与 CD36表达存在相关性,体外培养的巨噬细胞在高糖环境下细胞表面 CD36表达增高,同时伴有巨噬细胞摄取 ox-LDL增加。
CRP是机体受到损伤或发生各种急慢性炎症后产生的一种敏感反应蛋白,是临床上最有效的炎症标志物之一。荣嵘等[10]研究表明,T2DM患者血清 CRP与糖尿病并发症密切相关。CRP能直接作用于血管内皮,并促进早期动脉粥样硬化的发生;CRP还参与血栓形成、白细胞黏附,促进单核细胞的活化及转化,影响血管内皮细胞功能,从而加速和(或)加重 T2DM患者血管并发症。Abrahamian等[11]研究显示,糖尿病肾病患者增高的 CRP与增加的尿蛋白排泄有关,提示 CRP参与糖尿病肾病的发生、发展。国外研究表明[12],CD36在前炎症因子和氧化应激介导的肾损伤中起关键性作用。ox-LDL通过 CD36和 PKC依赖途径激活巨噬细胞中的转录因子 NF-κB。实际上 ox-LDL能触发炎症因子如TNF-α/β、IL-1β、IL-2、IL-6及 IFN-β/γ的分泌,而且有 ox-LDL诱导的巨噬细胞或泡沫细胞凋亡的发生机制依赖于 CD36和半胱天冬氨酸酶-3的激活。在动脉粥样硬化斑块中,许多前炎症因子及抗炎症因子被表达,这些炎症因子可调节 CD36的表达。
本研究结果显示,对照组与 T2DM组 CD36内含子 3[TG]重复序列基因多态性分布比较差异无统计学意义;而 T2DM各组间 HDL-C组、LDL-C组及CRP组比较差异均有统计学意义。CD36内含子 3[TG]>12/>12重复序列在 HDL-C异常组占36.2%,在 HDL-C正常组占 16.4%(P<0.05);LDL-C异常组占 40.6%,在 LDL-C正常组占 17.4%(P<0.05);在 CRP异常组占 34.1%,在 CRP正常组占16.7%(P<0.05)。说明 CD36内含子 3[TG]重复序列基因多态性与 T2DM患者的 HDL-C、LDL-C、CRP水平有关。CD36内含子 3[TG]>12/>12重复序列可能是 T2DM患者的 HDL-C水平降低、LDL-C和 CRP水平升高的遗传因素。
综上所述,我们认为 CD36内含子 3[TG]重复序列基因多态性与 T2DM患者 HDL-C、LDL-C、CRP水平有关。但 CD36内含子 3[TG]重复次数对 CD36的表达、血脂及 CRP的影响途径和机制尚不明确,需进一步研究。
[1]Okamura DM,Pennathur S,Pasichnyk K,et al.CD36regulates oxidative stress and inflammation in hypercholesterolemic CKD[J].J Am Soc Nephrol,2009,20(3):495-505.
[2]高磊,鲍羿,洪斌,等.B类清道夫受体 CD36的研究进展[J].医学分子生物学杂志,2006,3(1):61-64.
[3]Zhang HM,Zhang XL,Zhou X,et al.Mechanism linking atherosclerosis and type 2 diabetes:increased expression of scavenger receptor CD36in monocytes[J].Chin Med J(Engl),2005,118(20):1717-1722.
[4]Susztak K,Ciccone E,Mc Cue P,et al.Multiple metabolic hits converge on CD36as novel mediator of tubular epithelial apoptosis in diabetic nephropathy[J].PLoSMed,2005,2(2):e45.
[5]Athyros VG,Papageorgiou AA,Elisaf M,et al.Statins and renal function in patients with diabetes mellitus[J].Curr Med Res Opin,2003,19(7):615-617.
[6]Chen HC,Guh JY,Shin SJ,et al.Insulin and heparin suppress superoxide production in diabetic rat glomeruli stimulated with lowdensity lipoprotein[J].Kidney Int Suppl,2001,78:s124-s127.
[7]陈家坚,叶余辉,梁亮.高脂血症患者超敏 C反应蛋白与心血管病危险因素的相关研究[J].华北国防医药,2009,2(1):22-23.
[8]Mojiminiyi OA,Abdella N,Moussa MA,et al.Association of C-reactive protein with coronary heart disease risk factorsin patientswith type 2 diabetes mellitus[J].Diabetes Res Clin Pract,2002,58(1):37-44.
[9]Sampson MJ,Davies IR,Braschi S,et al.Increased expression of a scavenger receptor(CD36)in monocytes from subjects with type 2 diabetes[J].Atherosclerosis,2003,167(1):129-134.
[10]荣嵘,杨敏,贾政,等.2型糖尿病患者血清超敏 C反应蛋白与多项血脂关系的研究[J].北京医学,2008,30(5):296-298.
[11]Abrahamian H,Endler G,Exner M,et al.Association of lowgradeinflammation with nephropathy in type 2 diabetic patients:role of elevated CRP-levels and 2 different gene-polymorphisms of proinflammatory cytokines[J].Exp Clin Endocrinol Diabetes,2007,115(1):38-41.
[12]Iwao Y,Nakajou K,Nagai R,et al.CD36isone of important receptors promoting renal tubular injury by advanced oxidation protein products[J].Am J Physiol Renal Physiol,2008,295(6):F1871-F1880.
