胞内劳森氏菌PCR检测方法的建立与应用
2011-05-21董炳梅王金良苗立中沈志强
董炳梅,唐 娜,2,王金良,2,苗立中,2,沈志强,2*
(1.山东绿都生物科技有限公司;2.山东省滨州畜牧兽医研究院,山东 滨州 256600)
猪增生性肠炎(Porcine proliferative enteritis,PPE)是由胞内劳森氏菌(Lawsonia intracellularis,LI)引起的猪的接触性传染病。主要引起6周龄~20周龄的生长肥育猪出现急性出血性下痢,间歇性下痢、食欲下降和生长缓慢等临床症状。该病呈世界性分布。相关文献显示,猪群的患病率为15%~35%,患病猪日增重量可降低0.012 kg±0.01 kg[1-2]。造成的经济损失严重。
LI是一种专性胞内寄生菌,无法在无细胞培养基中培养[3],因此常规细菌学方法不能对PPE进行诊断。国外使用的诊断方法主要有组织病理学诊断、血清免疫学诊断以及分子生物学诊断技术[4]。PCR方法检测样本需要量小、操作相对简便、耗时短、特异性高,可以检测到pg级的细菌DNA[5],因此该方法已成为较常用的PPE诊断方法。本试验根据PPE的发病情况,并针对粪便样品检测灵敏性普遍较低的现象,最终选取固相吸附法提取DNA并结合PCR技术的方法,进一步提高了LI检测的敏感性与特异性,为PPE的有效诊治提供了参考方法。
1 材料和方法
1.1 菌株、病毒株与血清 LI菌株为本实验室分离;大肠杆菌(E.coli)、沙门氏菌(Salmonella)、猪流行性腹泻病毒(PEDV)和伪狂犬病病毒(PRV)均由本实验室保存;PPE血清、肠道组织与粪便样品均采自山东地区某PPE未免疫猪场。
1.2 主要实验材料 异硫氰酸胍(GuSCN)购自百灵威化学技术有限公司;TaqDNA聚合酶和dNTPs均购自宝生物(大连)生物工程公司;PPE ELISA诊断试剂盒购自Savnova Biotech AB公司。
1.3 引物设计与PCR扩增 固相吸附法提取样品基因组DNA,根据GenBank登录的LIaspA基因(AM180252.1)设计上下游引物,PPE-1:5'-GCAGCA CTTGCAAACAATAAACT-3';PPE-2:5'-TTCTCCTT TCTCATGTCCCATAA-3',预期扩增LI片段为294bp。PCR反应程序为:94℃ 5 min;94℃ 30 s、56℃30 s、72℃ 60 s,45个循环;72℃5 min。回收阳性PCR产物,引物合成及测序均由上海生工生物工程技术服务有限公司进行,并与GenBank登录的相关基因进行同源性比较。
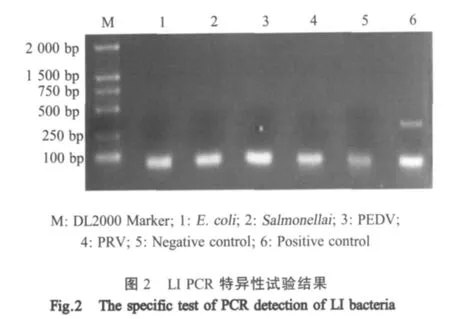
1.4 特异性试验 以相同条件,分别对LI细胞培养物、E.coli、Salmonella、PEDV、PRV和阴性对照进行PCR扩增,验证该方法的特异性。
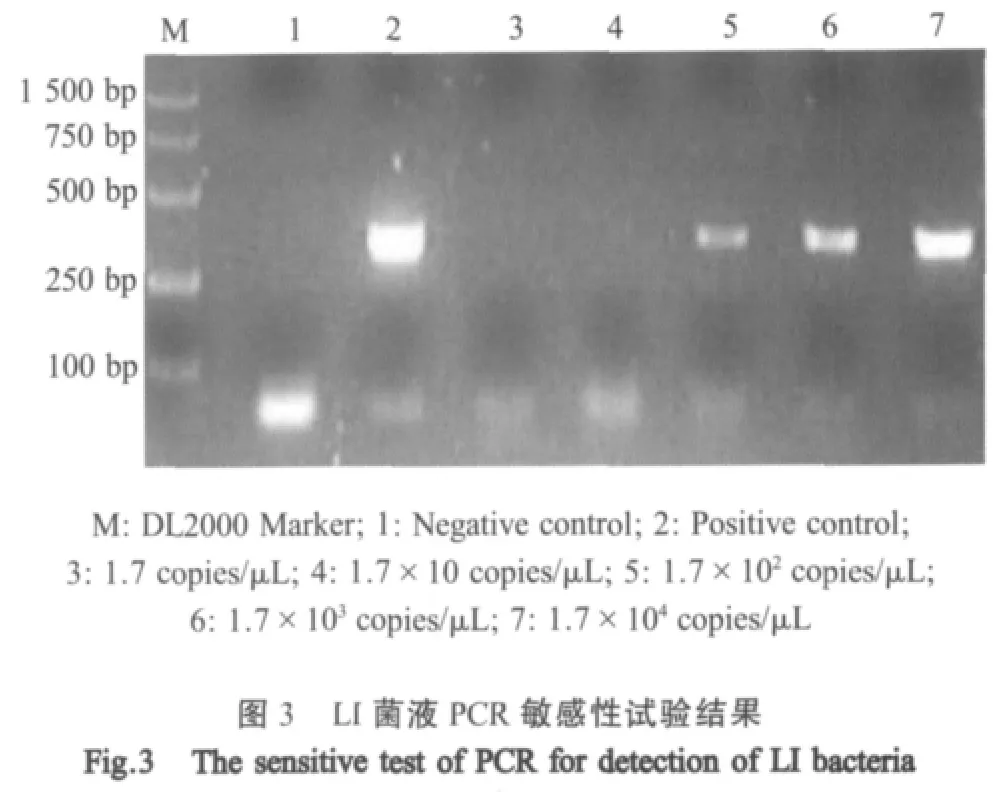
1.5 敏感性与重复性试验 提取LI细胞培养物DNA测定其含量并计算其拷贝数,将DNA按10-2~10-6倍比稀释后进行PCR扩增,琼脂糖电泳检测。取3个不同培养代次的LI与阴性对照,重复检测3次,验证该方法的重复性与稳定性。
1.6 应用性检测与符合性试验 应用该方法检测102份采自山东地区临床疑似PPE发病猪的组织样品/粪便样本,同时应用ELISA试剂盒检测样品相应的血清,以验证两种方法的符合率。
1.7 粪便样本DNA不同提取方法对LI PCR敏感性的影响 取0.2 g粪便样品,分别应用固相吸附法、文献[6]的Chelex-100+Triton X-100法和蛋白酶K-CTAB法提取基因组DNA,应用紫外分光光度计分别测定含量并计算拷贝数;将DNA按10-2~10-10倍比稀释,进行PCR扩增,检测不同方法的敏感性。
2 结果
2.1 PCR扩增与序列分析 采用固相吸附法提取LI细胞培养物的基因组DNA,PCR扩增,获得大小约为300 bp的片段(图1);测序结果与GenBank登录的相关基因PHE/MN1-00(AM180252.1)相应区域同源性达99%。

2.2 特异性试验 在相同条件下分别对LI细胞培养物、E.coli、Salmonella、PEDV和PRV等样品的基因组DNA进行PCR扩增。结果表明,LI细胞培养物 PCR扩增结果为阳性,E.coli、Salmonella、PEDV、PRV和阴性对照均为阴性(图2),表明该方法具有良好的特异性。
2.3 敏感性与重复性试验 应用固相吸附法提取基因组DNA,DNA浓度测定结果为2.67 ng/μL,LI基因拷贝数为1.7×106copies/μL;选取 10-2~10-65个梯度进行PCR扩增结果显示,PCR最低检出量为1.7×102copies/μL(图3);采用该方法重复3次检测3个代次LI细胞培养物与阴性对照,结果一致。
2.4 临床样品检测符合率试验 应用本实验建立的固相吸附法及PCR方法对102份临床样品进行检测,阳性率达12.75%;对相应的血清进行ELISA检测,阳性率为18.6%;两种方法的符合率为88.04%(表1)。

2.5 粪便样本DNA提取方法的比较 针对PCR检测方法极易受粪便样品中PCR抑制因子的影响,本研究分别应用固相吸附法、Chelex-100+Triton X-100法和蛋白酶K-CTAB法提取基因组DNA,浓度分别为 456 ng/μL、522.7 ng/μL 和 386 ng/μL,LI基因拷贝数分别为 2.9×108copies/μL、3.32×108copies/μL和 2.45×108copies/μL;选取 10-2~10-109个浓度梯度进行PCR扩增。结果显示,应用固相吸附法提取DNA后,PCR最低检出量为2.9×102copies/μL;而应用Chelex-100+Triton X-100法与蛋白酶K-CTAB法提取DNA后,PCR最低检出量为分别为3.32×103copies/μL 和 2.45×106copies/μL。因此,应用固相吸附法所提取LI模板DNA更适合PCR检测(图4)。

表1 PCR与ELISA方法符合率检测结果Table 1 The coincidence between PCR and ELISA assay
3 讨 论
PPE是一种在各种养殖条件下均可出现的疾病,传统细菌分离方法与常规细菌诊断技术很难确诊该病。PCR技术既适用于组织样品,又适用于粪便样品。在粪便样品的检测中,无论是否出现临床症状,PCR检测的阳性结果均可表明动物已处于感染活跃期。研究表明,当样品滤液中含有10个以上LI菌体时,便可被PCR检测为PPE阳性,适用于临床诊断[7-9]。
PCR检测方法的敏感性极易受样品处理的回收率和粪便样本中PCR抑制因子的影响[10]。因此,本研究采用固相吸附法提取LI基因组DNA结合PCR技术,阳性样品最低检出量为1.7×102copies/μL。该方法对E.coli、Salmonella、PEDV和PRV与阴性对照的检测结果均为阴性,证明该方法具有良好的特异性。临床样品检测阳性率为12.75%;该方法在粪便样品检测灵敏度偏低的情况下,与ELISA方法的符合率仍可达到88.04%,表明该方法可以满足临床PPE的诊断及流行病学监测的需要。比较不同LI基因组DNA提取方法对粪便样品PCR灵敏度检测影响结果显示,固相吸附法所提取的模板DNA浓度与 LI基因拷贝数(456 ng/μL 和 2.9×108copies/μL)虽略低于 Chelex-100+Triton X-100法(522.7 ng/μL 3.32×108copies/μL);但PCR检测结果证明,固相吸附法最低检出量为2.9×102copies/μL,显著优于Chelex-100+Triton X-100 法(3.32×103copies/μL)和蛋白酶K-CTAB法(2.45×106copies/μL),固相吸附法在样品回收率方面虽略低于Chelex-100+Triton X-100法,但显著消除了PCR抑制因子的影响,提高PCR敏感性。因此,本试验采用的固相吸附法结合PCR技术,对PPE的诊断能够提供较好的试验方法。
[1]Jacobson M,Fellstrom C,Jensen W M.Porcine proliferative enteropathy:an important disease with questions remaining to be solved[J].Vet J,2010,184(3):264-268.
[2]Rodr guez J C,Alvarez M,Rodr guez L,et al.A longitudinal study of porcine proliferative enteropathy in a commercial pig farm in Yucatan Mexico[J].Arq Bras Med Vet Zootec,2005,57(3):401-404.
[3]Watarai M,Yoshiya M,Sato A,et al.Cultivation and characterization of Lawsonia intracellularis isolated from rabbit and pig[J].J Vet Med Sci,2008,70(7):731-733.
[4]王元凯,严亚贤.胞内劳森菌与猪增生性肠炎的研究进展[J].中国兽医科学,2008,38(06):540-543.
[5]Huerta B,Arenas A,Carrasco L,et al.Comparison of diagnostic techniques for porcine proliferative enteropathy(Lawsonia intracellularis infection)[J].J Comp Pathol,2003,129(2-3):179-185.
[6]胡晓红,彭惠民,刘昕,等.PCR及real-time PCR评价细菌DNA提取方法[J].重庆医科大学学报,2008,33(2):155-158.
[7]Nathues H.Literature review of the diagnosis of porcine proliferative enteropathy[J].Berl Munch Tierarztl Wochenschr,2007,120(11-12):499-507.
[8]Kim J,Choi C,Cho W S,et al.Immunohistochemistry and polymerase chain reaction for the detection ofLawsonia intracellularisin porcine intestinal tissues with proliferative enteropathy[J].J Vet Med Sci,2000,62(7):771-773.
[9]Guedes R M,Gebhart C J,Winkelman N L,et al.Comparison of different methods for diagnosis of porcine proliferative enteropathy[J].Can J Vet Res,2002,66(2):99-107.
[10]Pedersen K S,Holyoake P,Stege H.Diagnostic performance of different fecalLawsoniaintracellularis-specific polymerase chain reaction assays as diagnostic tests for proliferative enteropathy in pigs:a review[J].J Vet Diagn Invest,2010,22(4):487-494.
