一株野鸭源基因III型新城疫病毒主要生物学特性及基因组序列测定分析
2011-05-21刘怀然刘培欣李东伟华育平孔宪刚
石 跃,刘怀然,刘培欣,李东伟,杨 煦,华育平,孔宪刚*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/禽传染病研究室,黑龙江 哈尔滨 150001;2.东北林业大学野生动物资源学院,黑龙江 哈尔滨 150040;3.哈尔滨师范大学生命科学与技术学院,黑龙江 哈尔滨 150025)
新城疫(Newcastle disease,ND)是由 ND病毒(NDV)引起,主要危害家禽的一种急性、高度接触性传染病[1]。我国对ND的防控采用的是严格的疫苗免疫,已经基本上控制了ND的流行,但与此同时来自疫苗的免疫压力和宿主的选择压力也加速了NDV的变异。近年来不断有高水平免疫鸡群发生病例,以及NDV感染家养水禽鸭、鹅发病的报道。野生水禽被认为是NDV的天然宿主,体内多携带对鸡无致病性的NDV弱毒株,但有证据表明家禽爆发ND与持续存在于野鸟体内的NDV有关[2]。本研究对从黑龙江地区获得的一株野鸭源NDV分离株进行生物学特性鉴定,表明该病毒株的ICPI值达到强毒株的标准,而基因组测序结果显示它与疫苗株Mukteswar同源性很高。本研究为进一步了解野鸟源病毒株与疫苗株的潜在关系提供依据。
1 材料和方法
1.1 主要材料 NDV Mallard/CH/HLJ383/06(简称WB383),分离于2006年采自黑龙江三江自然保护区野生绿头鸭泄殖腔拭子,拭子样品由东北林业大学提供;9日龄~10日龄SPF鸡胚、1日龄及15日龄SPF鸡均由哈尔滨兽医研究所实验动物中心提供;NDV标准强毒株(F48E9)阳性血清、DH5α感受态细胞由本实验室保存;TRIzol reagent购自Invitrogen公司;M-MLV购自MBI Fermentas公司;ExTaq、dNTP、pMD18-T均购自TaKaRa公司;DNA胶回收试剂盒购自上海生工生物工程技术服务有限公司。
1.2 病毒纯化及F基因扩增 鉴定为阳性的NDV按常规方法在鸡胚成纤维细胞(CEF)上进行蚀斑纯化[3]。用引物P4358(5'-GCCATTGCCTAAATACAAT CC-3')和引物 P6031(5'-GGCTCCTCTTACCGTTCTA C-3')扩增全长F基因,克隆至pMD18-T载体中,进行序列测定。参照GenBank登录的NDV各参考病毒株F基因序列构建F基因遗传进化树。
1.3 1日龄雏鸡脑内致病指数(ICPI)测定 将蚀斑纯化的NDV分离株按照OIE方法进行1日龄雏鸡ICPI的测定,共测定两次。
1.4 15日龄SPF鸡致病性试验 取10只15日龄SPF鸡,以103TCID50/0.1 mL剂量通过滴鼻点眼方式接种WB383分离株,隔离器饲养3周,记录SPF鸡的发病和死亡情况,接种5 d后取3只鸡剖检,观察病变情况,并检测存活鸡的血清抗体效价。
1.5 病毒全基因组序列测定与分析 根据WB383分离株F基因序列分析结果,参照GenBank登录的Mukaswar株序列(EF201805),设计11对引物用于扩增WB383病毒基因组全长,引物由上海生工生物工程技术服务有限公司合成(如果需要引物序列作者可以提供)。扩增片段克隆至pMD18-T载体中,由北京六合华大基因公司进行序列测定。
2 结果与讨论
2.1 F基因进化分析 自野生绿头鸭的泄殖腔拭子分离出一株具有血凝性病毒,经血凝抑制试验鉴定为NDV,命名为Mallard/CH/HLJ383/06,简称WB383。RT-PCR扩增其F基因核苷酸序列,将其测序结果与NDV参考株进行比较,结果表明WB383株与Mukteswar同源性最高为99.9%,属于ClassⅡ的基因Ⅲ型(图 1)。
2.2 致病性试验 对WB383分离株进行的两次ICPI指数测定平均值为1.81,明显高于NDV中等毒力病毒株判断标准(ICPI<1.50)(表1)。结果表明,与最近报道的江苏分离株鉴定结果相似,基因Ⅲ型病毒株ICPI值均有所升高[10],接近近年来我国流行的基因Ⅶ型NDV的ICPI值水平。15日龄SPF鸡致病性实验结果显示接种3 d后,均出现临床发病症状,无死亡病例。接种后5 d,剖检可见2/3鸡腺胃壁变薄,乳头覆盖大量粘液,乳头突起不明显,无出血现象;接种后14 d,血清抗体血凝抑制效价达到1∶25~1∶28,表明它对于15日龄SPF鸡的致病力仍低于同水平ICPI值的基因VII型NDV株[4]。以上试验结果表明,虽然野鸟源病毒株WB383的ICPI值已达到强毒株判断标准,但仍属于基因Ⅲ型中发型病毒株,致病性的改变也许正处于一个动态的过程中,有潜在引起鸡群发病的可能。

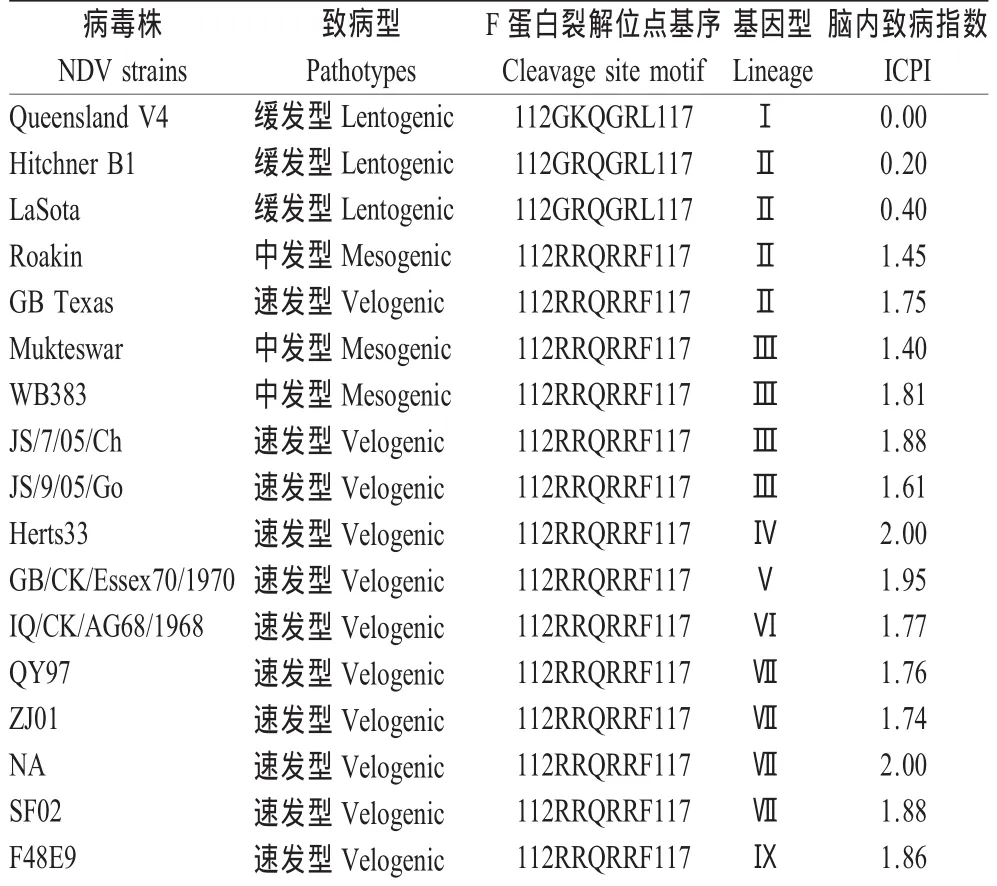
表1 Mallard/CH/HLJ383/06与其他NDV毒株的ICPI值比较Table 1 ICPI value comparision of Mallard/CH/HLJ383/06 with other NDV strains
2.3 全基因序列比较 通过RT-PCR扩增出11条目的片段,测序后通过DNAStar软件进行拼接。结果表明,WB383病毒株的基因组全长为15186 nt,长度与基因Ⅰ型、Ⅱ型、Ⅳ型等较古老的基因型NDV株相同,基因组长度符合“6的整数倍”原则[5]。在GenBank登录的NDV全长序列中,WB383与Mukteswar株、JS/705/Ch株、JS/9/05/Go株同源性最高,核苷酸同源性高达99%以上,结构蛋白氨基酸同源性为99.0%~99.7%。
NDV F蛋白裂解位点的氨基酸序列是决定病毒毒力主要因素之一,强毒株在该位点的氨基酸基序为112R/KRQK/RRF117,而弱毒株基序则为112G/EK/RQG/ERL117。HN蛋白具有受体识别和神经氨酸酶的作用,与病毒的嗜性相关,也是NDV重要的毒力相关因子之一[6]。近年来,随着NDV反向遗传操作系统的建立和应用,研究表明除了F和HN基因外,其他几个基因也与NDV毒力相关[7]。Rout等研究表明NDV的L蛋白通过影响病毒的复制水平影响病毒的毒力,所以该蛋白的变化对NDV毒力演化的作用很关键[8]。
Mukteswar病毒株是从印度分离强毒株经鸡胚致弱多代获得的,是我国Ⅰ系疫苗株的原始病毒株[9]。鸡源JS/7/05/Ch株和鹅源JS/9/05/Go株与疫苗株Mukteswar同源性最高,但它们的ICPI值却高于Mukteswa株,同时由于我国一直没有基因Ⅲ型强毒NDV流行的报道,偶尔分离到的基因Ⅲ型病毒株与Mukteswar具有很高的同源性,由此推测这两株分离株很可能是疫苗株Mukteswar的返强病毒株[10]。
WB383与Mukteswar全基因组序列间核苷酸同源性高达99.8%,共有33个核苷酸差异,导致16个氨基酸突变,低于JS/7/05/Ch和JS/9/05/Go变异的25个氨基酸。WB383株与Mukteswar株相比变异的16个氨基酸中,有9处氨基酸变异为WB383株所独有,而Mukteswar与JS/7/05/Ch、JS/9/05/Go株在此处相同(表2)。分析这4株病毒的结构蛋白,F蛋白差别最小,WB383、JS/7/05/Ch和JS/9/05/Go与疫苗株Mukteswar的F蛋白仅在氨基酸203位发生A-T的一致性变异;HN蛋白同源性差别最大,在0.7%~1.8%之间且变异的15处氨基酸位点均不相同,这可能主要与3株病毒分离自不同的宿主有关;L蛋白发生氨基酸变异的点也较多,WB383株与Mukteswar株相比较有5处变异,JS/7/05/Ch和JS/9/05/Go均为13处变异。相对于Mukteswar疫苗株,WB383、JS/7/05/Ch和JS/9/05/Go株有4处一致性氨基酸变异。虽然3株病毒的主要毒力因子F和HN蛋白的氨基酸残基相比于Mukteswar株都发生了改变,但是三者发生一致性突变的位点却多集中在L基因上。据此,我们推测WB383株与JS/7/05/Ch和JS/9/05/Go分离株一样可能为疫苗株Mukteswar在不同宿主体内进化而来,由于宿主或免疫压力而发生变异,这些变异以点突变为主,积累到一定程度引起致病性的改变。至于HN蛋白及L蛋白的氨基酸点变异是否与病毒嗜性、毒力是否相关,尚需进一步验证。
表2 Mukteswar株与WB383、JS/7/05/Ch和JS/9/05/Go蛋白变异位点Table 2 Protein and mutation site of NDV strains Mukteswar and WB383,JS/7/05/CH,JS/9/05/Go
综上所述,自不同地区(江苏,黑龙江)及不同禽源(鸡、野鸭、鹅)均分离到与疫苗株同源病毒株,而且毒力升高或具有升高趋势,表明NDV可以在鸡群-家养水禽-野生水禽间传播而形成一个天然的NDV循环库,并在宿主选择压力及其它因素作用下发生变异,进而导致宿主嗜性及致病性改变。现阶段应扩大NDV流行病学监测范围,加强对野鸟特别是野生水禽的NDV流行病学监测,为ND防控和新型疫苗研制提供数据。
[1]Aldous E W,Mynn J K,Aexander D J,et al.A molecular epidemiological study of avian paramyxovirus type I(Newcastle disease virus)isolates by phylogenetic analysis of a partial nucleotide sequence of the fusion protein gene[J].Avian Pathol,2003,32:239-256.
[2]Alexander D J,Campbell G,Manvell R J,et al.Characterization of an antigenically unusual virus responsible for two outbreaks of Newcastle disease in the republic of Ireland in 1990[J].Vet Res,1992,130:65-8.
[3]孙敏华,刘怀然,孔宪刚,等.2003年~2006年东北地区新城疫病毒部分分离株分子遗传学特征[J].中国预防兽医学报,2008,30(5):354-358.
[4]刘怀然,孙敏华,孔宪刚,等.不同宿主源NDV毒株对SPF鸡致病性研究[J].中国预防兽医学报,2009,31(2):99-109.
[5]Calain P,Roux.The rule of six,a basic feature for efficient replication of Sendai virus defective interfering RNA[J].J Virol,1993,67:4822-4830.
[6]Hung Z,Panda Z,Elankumaran S,et al.The hemagglutinin-neuraminidase protein of Newcastle disease virus determines tropism and virulence[J].J Virol,2004,78:4176-4184.
[7]Estevez C,King D,Yu Qing-zhou,et al.Evaluation of Newcastle disease virus chimeras expressing the Hemagglutinin-Neuraminidase protein of velogenic strains in the context of a mesogenic recombinant virus backbone[J].Virus Res,2007,129:182-190.
[8]Rout S N,Samal S K.The large polymerase protein is associated with the virulence of Newcastle disease virus[J].J virol,2008,82(16):7828-7836.
[9]Iyer S G,Dobson N.A successful method of immunization against Newcastle disease of fowls[J].Vet Rec,1940,52:891-894.
[10]仇旭升,孙庆,刘秀梵,等.两株基因Ⅲ型强毒新城疫的全基因组测序及其与I系苗的亲缘性分析[J].微生物学报,2009,49(3):302-308.
