稳定表达绵羊肺腺瘤病毒表面蛋白A549细胞系的建立
2011-05-21刘霄卉罗军荣斯日古楞周建华马学恩
刘霄卉 ,罗军荣,2,斯日古楞,周建华,马学恩*
(1.内蒙古农业大学兽医学院,内蒙古 呼和浩特 010018;2.江西农业大学动物科学院,江西 南昌 330045;3.中国农业科学院哈尔滨兽医研究所,黑龙江 哈尔滨 150001)
绵羊肺腺瘤病(Ovine pulmonary adenomatosis,OPA)又名“驱赶病”(Jaagsiekte),是引发绵羊肺脏肿瘤的一种接触性传染病,偶发生于山羊。其病原为绵羊肺腺瘤病毒(Jaagsiekte retrovirus,JSRV),该病毒属于β反转录病毒,基因组为线性单股正链RNA,全长7.4 kb,具相互重叠的 gag、pro、pol、env基因。其中env基因的ORF编码囊膜蛋白Env。该蛋白随后被病毒蛋白酶水解为跨膜蛋白(Transmembrane protein,TM)和表面蛋白(Surface protein,SU)[1]。研究表明,SU位于病毒的囊膜外,包含受体结合位点和主要的抗原决定簇,并通过识别结合相应的特异性受体,介导膜融合过程,进而使病毒粒子侵入宿主细胞内,Caporale等发现,JSRV Env蛋白是致瘤蛋白[3,5-8]。近年来研究发现,缺失Env蛋白中的TM会导致该蛋白失去细胞转化能力,表明TM为Env细胞转化能力的决定因素之一[4]。此外,缺失SU的信号肽到SU与TM的连接区域也使Env丧失转化能力,表明SU蛋白中也可能有多个区域参与细胞转化[10]。SU在JSRV ENV细胞转化中的作用似乎依赖于靶细胞的类型,但如何影响这些细胞的转化尚不明确[2]。SU在JSRV细胞转化中作用是国内外研究的热点。SU可用于检测OPA特异抗原及OPA发病机理的研究[9]。
本研究利用真核表达载体pcDNA3.1(+),构建了JSRVsu基因的真核表达质粒pcDNA3.1-SU,并转染人肺癌细胞系A549细胞,建立了稳定表达SU的A549细胞系,为进一步研究SU蛋白在细胞转化中的作用奠定基础。
1 材料和方法
1.1 实验材料 pcDNA3.1(+)真核表达载体购自Invitrogen公司;E.coliDH5α感受态细胞和A549细胞株由中国农业科学院哈尔滨兽医研究所提供;重组原核表达质粒(pGEX-4T-1-SU)由本课题组构建保存[11];抗SU单克隆抗体(MAb)由本室制备[12]。
1.2 主要试剂和工具酶 限制性内切酶和T4 DNA连接酶购自TaKaRa公司;凝胶回收、质粒抽提纯化试剂盒购自OMEGA公司;真核细胞转染试剂Lipofectamine 2000购自Invitrogen公司;F-12K细胞培养液、胎牛血清(FBS)及筛选用G418购自GIBCO公司;辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG购自中山金桥公司;荧光素(FITC)标记的山羊抗小鼠IgG购自Sigma公司;超敏发光液购自普利莱基因技术有限公司。
1.3 引物设计 根据GenBank登录的JSRV-NM株env基因(DQ838494)SU区序列设计相应引物,并引入限制性内切酶EcoRⅠ和XhoⅠ酶切位点以及翻译起始密码子和终止密码子。上游引物(SU-F)为:5'-GGAATTCATGTTACAGCGGATAC-3';下游引物(SU-R)为:5'-CCCTCGAGTCAGCTAAGAGTCGTG-3',扩增产物大小为898 bp,引物由上海生工生物工程技术服务有限公司合成。
1.4 重组表达载体的构建及鉴定 以pGEX-4T-1-SU为模板,SU-F、SU-R为引物,进行PCR扩增。将扩增后的目的基因纯化后,与pcDNA3.1(+)同用EcoRⅠ和XhoⅠ进行双酶切处理,并经1%的琼脂糖凝胶电泳鉴定并回收,连接,转化感受态菌。转化后所得的菌落用PCR法、限制性内切酶及DNA测序鉴定。将鉴定正确的阳性克隆菌用去内毒素小量质粒提取试剂盒提取质粒,命名为pcDNA3.1-SU。重组质粒用XbaⅠ消化并纯化后用紫外可见分光光度计测定其浓度及纯度,-20℃贮存备用。
1.5 表达SU蛋白的细胞系建立
1.5.1 G418工作浓度确定 为测定抗性细胞筛选试剂G418对A549细胞最小致死量,将A549细胞以0.5×105个细胞/孔接种于24孔细胞培养板中,加入终浓度分别为100 mg/L、200 mg/L、300 mg/L、400 mg/L、500 mg/L和 600 mg/L G418,于 37℃5%CO2条件下培养,每3 d换液一次,共培养15 d~20 d,观察A549细胞生长情况。以细胞完全死亡的G418最小浓度为筛选的最佳工作浓度。
1.5.2 细胞转染 转染前1 d,用含10%FBS的F-12K培养液将A549细胞接种于24孔细胞培养板。次日(细胞单层为90%~95%),按转染试剂Lipofectamine 2000说明书要求,取0.8 μg pcDNA3.1-SU质粒转染A549细胞,并设空载体pcDNA3.1(+)转染作为对照。48 h后改用含终浓度500 mg/L G418的完全F-12K培养液进行筛选。
1.5.3 稳定表达SU细胞系的建立 以有限稀释法对阳性转染细胞克隆进行连续3次克隆纯化,以间接免疫荧光(IFA)方法检测SU的表达,使其克隆孔免疫荧光阳性率达90%以上。阳性克隆的再扩增培养以250 mg/L的G418维持,按常规进行传代培养。建立稳定表达JSRV SU的细胞株克隆保存于液氮。
1.6 稳定表达细胞系的鉴定
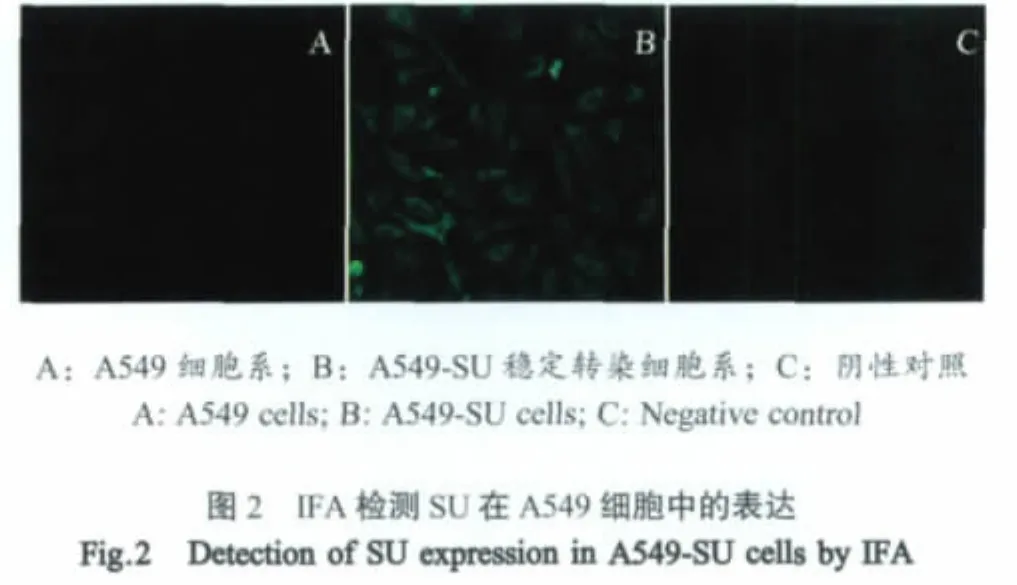
1.6.1 IFA鉴定 将克隆化后的细胞株以1×105细胞/孔接种于24孔板,同时以空载体转染的细胞为阴性对照;未转染pcDNA3.1-SU质粒的A549细胞作为空白对照。以抗SU MAb为一抗,FITC标记的羊抗鼠IgG为二抗,进行IFA反应。
1.6.2 Western blot方法鉴定 收集克隆化的细胞系,以抗SU MAb为一抗,HRP标记的山羊抗小鼠IgG为二抗,进行western blot鉴定。同时设阴性对照和空白对照。
1.7 表达蛋白的细胞内定位 将克隆化后的细胞株,同1.6.1方法进行间接免疫荧光标记,加入碘化丙啶(PI,100 μg/mL)于 4℃避光染核 15 min,PBST 漂洗3次,利用Laser scanning共聚焦显微镜分析表达的SU蛋白在细胞内的定位情况。
2 结果与讨论
2.1 稳定表达SU细胞系的建立 以pGEX-4T-1-SU为模板进行PCR,扩增JSRVsu基因。PCR产物经1%琼脂糖凝胶电泳鉴定,显示的扩增后条带约为900 bp,与预期片段大小相符(图1)。

从转化菌中提取重组质粒pcDNA3.1-SU,经PCR、EcoRⅠ和XhoⅠ双酶切鉴定及核苷酸序列测定并比对分析后显示,所克隆的su基因片段的读码框架和插入方向正确,表明构建了含有su基因的pcDNA3.1-SU。将pcDNA3.1-SU线性化后转染A549细胞后,挑取G418抗性细胞克隆,经3次有限稀释法纯化,建立了SU稳定表达细胞系A549-SU。
2.2 稳定表达SU细胞系的鉴定 以抗SU MAb为检测抗体,对稳定表达SU的细胞系A549-SU进行IFA反应,检测SU的细胞内表达情况。显微镜观察显示所有细胞均呈现绿色荧光,而在空白对照和阴性对照中没有观察到荧光(图2),表明SU蛋白获得表达。
2.3.2 Western blot检测结果 将A549-SU细胞裂解产物以抗SU MAb作为检测抗体,进行western blot。结果显示,重组质粒pcDNA3.1-SU转染的A549细胞裂解物在35 ku处出现特异带,而空白对照和阴性对照则没有任何反应带(图3),表明克隆至表达载体中的su基因得到正确和有效的表达。

用标记FITC抗SU MAb指示SU,以PI标记细胞核,利用激光扫描共聚焦显微镜进行观察,结果显示,SU蛋白主要分布于细胞质中,但部分细胞的细胞核中也有少量存在(图4)。
由于OPA感染羊血液中无循环性抗JSRV抗体的存在[8],即没有病毒阳性血清可检测JSRV SU蛋白的表达,因此本研究以前期制备的抗SU MAb[12]检测目的基因的表达。
通过IFA及western blot方法检测证实,所构建的重组质粒pcDNA3.1-SU可在真核细胞内稳定表达JSRV SU,而且蛋白分子量与预计相符。经激光共聚焦显微镜观察,所有细胞均呈现绿色荧光,且荧光部位集中于细胞质,而在细胞核中仅见微弱荧光,显示SU主要定位于细胞质。
综上所述,本实验构建含有su基因的pcDNA3.1-SU真核表达载体,建立了稳定表达SU的细胞系A549-SU,为研究SU在细胞转化中的作用以及对OPA发病机理的研究建立了体外研究重要平台。
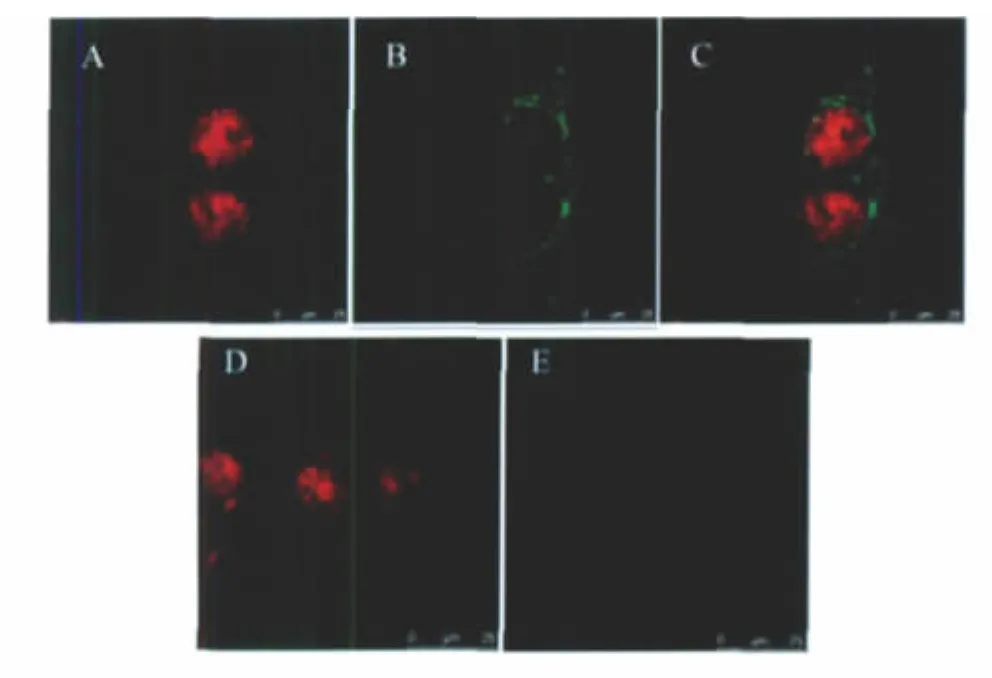
图4 共聚焦分析结果Fig.4 Localization of su in A549 cells by confocal microscopy
[1]Demartini J,Bishop J,Allen T,et al.Jaagsiekte sheep retrovirus proviral clone JSRV(JS7),derived from the JS7 lung tumor cell line,induces ovine pulmonary carcinoma and is integrated into the surfactant protein A gene[J].J Virol,2001,75(9):239-246.
[2]Liu S L,Miller A D.Oncogenic transformation by the jaagsiekte sheep retrovirus envelope protein[P],Oncogene(2007)26,789-801.
[3]Maeda N,FU Wu-xia,Ortin A.Roles of the Ras-MEK-mitogen-activated protein kinase and phosphatidylinositol 3-kinase-Akt-mTOR pathwaysin Jaagsiektesheep retrovirus-induced transformation of rodent fibroblast and epithelial cell lines[J].Virology,2005,79:4440-4450.
[4]Palmarini N,Maeda C,Murgia C,et al.A phosphatidylinositol 3-kinase docking site in the cytoplasmic tail of the Jaagsiekte sheep retrovirus transmembrane protein is essential for envelope-induced transformation of NIH 3T3 cells[J].Virology,2001,75:11002-11009.
[5]Marco C,Christina C,Patrizia C,et al.Expression of the Jaagsiekte sheep retrovirus envelope glycoprotein is sufficient to induce lung tumors in sheep[J].J Virol,2006,8:8030-8037.
[6]Griffiths D J,Martineau H M.Cousens.Pathology and pathogenesis of ovine pulmonary adenocarcinoma[J].Comp Path,2010,l:1-24.
[7]Rai S K,Duh F M.Candidate tumor suppressor HYAL2 is a glycosylphosphatidylinositol(GPI)-anchored cell-surface receptor for jaagsiekte sheep retrovirus,the envelope protein of which mediates oncogenic transformation[J].Proc Natl Acad Sci.USA 2001,98:4443-4448.
[8]Allen T E,Sherrill K J.The jaagsiekte sheep retrovirus envelope gene induces transformation of the avian fibroblast cell line DF-1 but does not require a conserved SH2 binding domain[J].Gen Virol,2002,83:27.
[9]Denis F Y,Robert V,Daniel W V.Isolation,identification,and partial cDNA clong of genomic RNA of jaagsiekte retrovirus,the etiological agent of sheep pulmonary adenomatosis[J].J Virol,1991,65:5061-5067.
[10]De Heras M,Ortin A,Benito A,et al.In-situ demonstration of mitogen-activated protein kinase Erk 1/2 signalling pathway in contagious respiratory tumours of sheep and goats[J].J Compara Pathol,2006,135:1-10.
[11]斯日古楞,么宏强,马学恩,等.绵羊肺腺瘤病毒内蒙毒株囊膜蛋白基因在大肠杆菌中的分段表达[J].黑龙江畜牧兽医,2007,10:7-10.
[12]刘霄卉,斯日古楞,罗军荣,等.绵羊肺腺瘤病毒囊膜基因表面蛋白的表达及其单克隆抗体的制备[J].中国预防兽医学报,2008,6:469-472.
