ZA-76对大鼠脉络膜新生血管形成、兔眼血流及血管内皮细胞的影响△
2011-05-21徐新荣张奕华彭司勋
徐新荣 张奕华 吉 洁 彭司勋
年龄相关性黄斑变性(age-related macular degeneration,AMD)继发的脉络膜新生血管(choroidal neovascularization,CNV)是老年人不可逆性视功能损害的主要原因之一。CNV的药物治疗主要有皮质类固醇抗炎药和VEGF拮抗剂。长期使用皮质类固醇会导致眼压升高;VEGF拮抗剂需要反复眼内注射,有发生眼内炎、视网膜脱离、晶状体损伤等并发症的风险,且长期使用的生物安全性尚待进一步观察。因此,寻找多途径防治CNV的药物有积极意义。
炎症过程在CNV的发生发展中起重要作用。基于此,我们将自主合成的非甾体抗炎药苯基呋咱氮氧化物与双氯芬酸藕联化合物ZA-76应用于激光诱导的棕色挪威大鼠CNV模型,观察ZA-76对CNV形成的抑制作用,通过检测 ZA-76对环氧化酶-2(COX-2)和VEGF表达的影响、对高眼压兔眼血流以及人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)生长的作用,探讨其作用机理。
1 材料与方法
1.1 实验材料及试剂 HUVEC来源于中科院上海细胞库;DMEM培养基、胎牛血清为Gibco公司产品;胰蛋白酶、四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO)为Sigma公司产品;彩色微球及相关试剂为美国E-Z Trac公司产品;ZA-76由中国药科大学新药中心提供;100 g·L-1荧光素钠溶液为广西梧州制药公司产品;VEGF一抗为 Biological公司产品;COX-2一抗、MaxVisionTM二抗及DAB显色剂为福州迈新生物技术公司产品。
1.2 ZA-76对鼠眼CNV的抑制作用及对VEGF、COX-2表达的影响
1.2.1 CNV动物模型制作与分组 雄性棕色挪威大鼠(北京维通利华公司)30只(60眼),体质量约180~200 g。5 g·L-1托品卡胺+去氧肾上腺素散瞳后,100 g·L-1水合氯醛(3.5 mL·kg-1)腹腔注射麻醉,在132 D前置镜下,距视盘2~3个视盘直径,用多波长氪激光机围绕视盘均匀光凝8个点。参数:波长531 nm,光斑直径200 μm,曝光时间0.2 s,功率150~200 mW。模型动物随机分为治疗组和对照组,每组15只(30眼)。治疗组在光凝后第2天开始腹腔注射20 g·L-1ZA-76(20 mg·kg-1),对照组给等体积的溶媒二甲基亚砜,均每天1次,连续4周。
1.2.2 眼底照相及眼底荧光血管造影 光凝后2周、4周进行眼底照相、眼底荧光血管造影(FFA)。散瞳及麻醉方法同前,舌下静脉注射100 g·L-1荧光素钠溶液0.2 mL,立即开始双眼摄片,观察15 min,观察CNV的形成情况,并评估CNV形成率。CNV评判标准:光凝点早期低荧光、晚期荧光素渗漏范围不扩大为1级;光凝点早期强荧光、晚期荧光素渗漏范围扩大为2级。
1.2.3 病理切片观察CNV 观察期满颈椎脱臼处死大鼠后立即摘取眼球,沿角巩缘剪开,去除角膜、晶状体及玻璃体制成眼杯,体积分数10%甲醛固定24 h后,逐级酒精脱水、二甲苯透明、浸蜡、包埋,做4 μm厚切片,用于HE染色和免疫组织化学检测。HE染色,二甲苯脱水透明,中性树胶封片,光镜放大200倍观察CNV。
1.2.4 免疫组织化学检测VEGF、COX-2的表达
上述切片脱蜡水化,置于0.01 mol·L-1、PH 6.0 柠檬酸盐缓冲液中微波中档抗原修复20 min,0.01 mol·L-1、PH 7.4 PBS 液冲洗,正常山羊血清封闭,室温孵育10 min,弃血清;分别滴加 VEGF、COX-2以1∶100比例稀释的一抗,37℃孵育1 h,PBS冲洗;滴加即用型快速免疫组织化学MaxVisionTM二抗,37℃孵育10~15 min,PBS冲洗;滴加新鲜配制的DAB显色剂3~5 min,显微镜下观察。充分冲洗后,苏木素复染,清水冲洗返蓝,梯度酒精脱水、二甲苯透明,中性树胶封片。
以细胞浆着色呈棕黄色为阳性细胞。切片在显微镜下照相(×200),图像分析系统(PCI works V 7.0,PCI GEOMATICS,Canada)计算 VEGF、COX-2 阳性染色密度。每组5张切片,每张切片选择5个视野观察染色结果,半定量测定阳性反应物密度,平均密度=IOD值/面积,结果取平均值。
1.3 高眼压兔眼血流测定 新西兰白兔(本院实验动物中心),雌雄不拘,体质量2.0~3.0 kg。治疗组和对照组分别用20 g·L-1ZA-76(50 μL)及等体积溶媒滴左眼,每组6只动物。200 g·L-1乌拉坦(5 mL·kg-1)耳缘静脉注射麻醉,每小时1/3剂量维持麻醉。左眼插入静脉输液针并连接高置生理盐水灌注瓶,使眼压升至40 mmHg(1 kPa=7.5 mmHg);经右侧颈动脉插管至左心室用于彩色微球注射,测定高眼压兔眼0 min、30 min、60 min和120 min的眼血流,每个时间点有约2×106个微球(0.2 mL)经颈动脉插管注入;并立即经股动脉插管采血1 min,血样置于肝素化试管,记录体积。然后处死动物,摘取左眼,分离视网膜、脉络膜、虹膜及睫状体,分别称质量。血样及组织标本按公司提供的流程处理,各检测时间点不同组织血流的计算公式如下:Qm=(Cm×Qr)/Cr,Qm 是组织血流(μL·min-1·mg-1),Cm是每毫克组织微球数,Qr是血流量(μL·min-1),Cr是血样总微球数。
1.4 ZA-76对HUVEC细胞增殖的影响
1.4.1 HUVEC细胞培养及分组干预 将复苏的细胞置于37℃、体积分数5%CO2饱和湿度培养箱中常规培养,第2天更换培养液继续培养,每3天更换1次培养液,细胞近铺满时,胰蛋白酶消化传代,取对数生长期细胞用于实验。调整细胞密度为50×103mL-1,接种于 96 孔培养板中,每孔 200 μL,每排接种6个复孔(每排8孔),最边的复孔只加100%DMEM培养基,不接种细胞。铺板的细胞培养至70%~80%汇合时,更换100%DMEM培养基每孔200 μL同步化24 h,然后分别换含 ZA-76 100 mg·L-1、200 mg·L-1、400 mg·L-1的条件培养基,每孔200 μL,干预 24 h、48 h。
1.4.2 MTT法检测HUVEC细胞活性 将用不同条件培养基干预24 h、48 h的HUVEC细胞分别加入MTT 溶液,每孔20 μL(5 g·L-1),于 37 ℃、体积分数5%CO2及饱和湿度条件下的细胞培养箱中孵育4 h,去上清,每孔用 PBS洗3次,去上清,每孔加DMSO 150 μL,充分振荡10 min,使结晶充分溶解,全自动酶标仪570 nm波长处测定各孔的OD值。实验中只加培养液的孔为空白对照孔,以此孔调零。
1.5 统计学分析 采用SPSS 13.0统计软件,CNV形成率比较用卡方检验,其他数据比较用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 眼底照相及FFA观察CNV形成 2组动物视网膜光凝后眼底照相均可见气泡产生,光凝后2周、4周光凝点可见明显瘢痕,对照组光凝点瘢痕较治疗组明显,但光凝后2周、4周各组光凝点瘢痕无明显差别(图1)。光凝后2周、4周FFA可见对照组视网膜光凝点晚期荧光素渗漏范围扩大点数及强度明显高于治疗组。光凝后2周,对照组光凝点晚期荧光素渗漏范围扩大227点,占总光凝点数240点的94.58%;治疗组光凝点晚期荧光素渗漏范围扩大194点,占总光凝点数的80.83%。光凝后4周,对照组光凝点晚期荧光素渗漏范围扩大228点,占总光凝点数的95.00%;治疗组光凝点晚期荧光素渗漏范围扩大191点,占总光凝点数的79.58%。2组光凝后2周、4周,光凝点CNV形成率差异均有显著统计学意义(χ2=21.04、25.71,均为P<0.01)。光凝后2周、4周各组内光凝点晚期荧光素渗漏范围及强度无明显差别(图2)。

Figure 1 Color fundus photos after retinal photocoagulation,eight laser lesions were induced at approximately equal distances around the disk in the rat eye.A,B and C were from the control group;D,E and F were from the ZA-76 treatment group.Photo A and D were taken after photocoagulation immediately,the bladder were seen;B,E:Two weeks after photocoagulation,the scar around the laser lesion were seen,the control group was more obvious than the treatment;C,F:Four weeks after photocoagulation.Intensity of laser scars between 2 weeks and 4 weeks had no significant difference 视网膜光凝后眼底照相,围绕视盘大致等距的8个光凝点。A、B、C为对照组;D、E、F为治疗组。A(对照组)和D(治疗组)为光凝后即刻图像,可见气泡形成;B(对照组)和E(治疗组):光凝后2周,光凝点瘢痕形成,对照组比治疗组明显;C(对照组)和F(治疗组):光凝后4周,光凝点瘢痕与2周时无明显差别
2.2 免疫组织化学法检测VEGF、COX-2的表达对照组视网膜光凝区VEGF、COX-2阳性表达较强,治疗组VEGF、COX-2表达呈弱阳性(图3)。对照组阳性染色密度:VEGF为(71.55±9.89)mm-2,COX-2为(58.78 ±7.02)mm-2;治疗组阳性染色密度:VEGF 为 (51.13 ± 6.15)mm-2,COX-2 为(37.22±5.18)mm-2;2组光凝区 VEGF、COX-2阳性染色密度比较,差异均有显著统计学意义(t=4.83、3.66,均为P<0.01)。
2.3 高眼压兔眼血流测定结果 治疗组脉络膜血流在30 min、60 min、120 min均明显增加,与对照组比较,差异有统计学意义;视网膜血流2组比较差异无统计学意义,可能因为兔眼视网膜血管少,药物难以起作用(表1)。
2.4 MTT法检测HUVEC细胞增殖 不同浓度ZA-76处理HUVEC 24 h、48 h后进行MTT检测,400 mg·L-1ZA-76干预24 h,HUVEC细胞OD值与对照组比较差异有统计学意义;干预48 h ZA-76各浓度组HUVEC细胞OD值与对照组比较差异均有统计学意义,400 mg·L-1ZA-76 作用更显著(表2)。
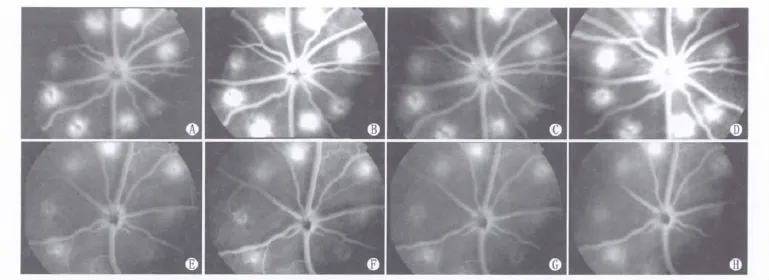
Figure 2 Fundus fluorescein angiography photos at 2 weeks and 4 weeks after laser photocoagulation.A(2 weeks,early-phase angiogram),B(2 weeks,late-phase angiogram),C(4 weeks,early-phase angiogram)and D(4 weeks,late-phase angiogram)were from the control group;E(2 weeks,early-phase angiogram),F(2 weeks,late-phase angiogram),G(4 weeks,early-phase angiogram)and H(4 weeks,late-phase angiogram)were from the ZA-76 treatment group.There was intense leakage in laser induced lesions in the control group,whereas leaking was diminished in the ZA-76 treatment group;Intensity and size of leaking had no significant differences between 2 weeks and 4 weeks of control or treatment group 视网膜光凝后2周、4周FFA图像。A(2周早期)、B(2周晚期)、C(4周早期)和D(4周晚期)为对照组;E(2周早期)、F(2周晚期)、G(4周早期)和H(4周晚期)为治疗组。对照组光凝点晚期荧光素渗漏范围及强度明显高于治疗组;2组2周、4周时组内光凝点晚期荧光素渗漏范围及强度无明显差别

Figure 3 Scars were seen in the laser lesions,the control group(A:VEGF;C:COX-2)was more obvious than the treatment group(B:VEGF;D:COX-2);The brown positive expression was seen in the laser lesions,the treatment group was weaker than the control group 光凝区见瘢痕形成,对照组(A:VEGF;C:COX-2)较治疗组(B:VEGF;D:COX-2)明显;光凝区见棕色阳性表达物,治疗组弱于对照组
表1 ZA-76对兔眼脉络膜、视网膜血流的影响Table1 Effects of ZA-76 on choroid and retinal blood flow in the rabbit eyes(n=6,±s,μL·min-1·mg-1)

表1 ZA-76对兔眼脉络膜、视网膜血流的影响Table1 Effects of ZA-76 on choroid and retinal blood flow in the rabbit eyes(n=6,±s,μL·min-1·mg-1)
Note:Compared with the control group,*P <0.05
Group 0 minute 30 minutes 60 minutes 120 minutes Choroid Control 9.57 ±0.54 5.24 ±0.56 3.88 ±0.36 2.70 ±0.32 ZA-76 10.51 ±1.69 14.65 ±3.47* 8.73 ±0.79* 5.61 ±0.63*Retina Control 9.57 ±0.54 5.24 ±0.56 3.88 ±0.36 2.70 ±0.32 ZA-76 10.15 ±0.93 5.78 ±0.71 4.85 ±0.56 3.33 ±0.49

表2 不同浓度的ZA-76对HUVEC细胞增殖影响Table2 Effects of ZA-76 with different concentrations on HUVEC proliferation
3 讨论
基础和临床研究表明,炎症在CNV形成中起重要作用[1-2]。COX-2是炎症过程中的重要活性酶之一,与CNV形成有关[3]。COX-2可通过多种途径促进血管新生:(1)前列腺素途径:前列腺素E2能诱导毛细血管生成,而前列环素是VEGF诱导血管内皮细胞渗透性增高的关键性调控因子[4];(2)血栓素A2途径:COX-2与内皮细胞的运动及形成毛细血管样结构的能力有关;(3)金属蛋白酶(MMP)途径:COX-2的大量表达导致 MMP-2蛋白增多,MMP-9 mRNA表达增多,细胞迁移和浸润能力增加[5]。
基于炎症在CNV形成中所起的作用,抗炎药物已广泛应用于CNV的治疗。如曲安奈德玻璃体内注射结合经瞳孔温热疗法或光动力疗法能抑制CNV形成;非甾体抗炎药Nepafenac滴眼可减少VEGF的产生,从而抑制CNV形成[6];塞内昔布可抑制兔实验性脉络膜新生血管的形成[7]。我们先前的研究发现,IL-1拮抗剂CK-112、CK-116及有抗炎作用的中药单体柚皮素能抑制大鼠实验性CNV的形成[8-9]。
ZA-76是一氧化氮(NO)供体3-羟甲基-4-苯基-呋咱氮氧化物与双氯芬酸(DC)偶联而成的一氧化氮供体型DC(NODC),抗炎镇痛活性好,胃肠道副作用小,体内有明显的NO释放[10]。本研究FFA结果显示,ZA-76能显著抑制CNV的形成;免疫组织化学结果表明,对照组COX-2表达较治疗组强,而CNV的形成治疗组较对照组轻,表明COX-2表达增强与CNV形成有关。ZA-76下调COX-2的表达,抑制CNV形成的机制可能是:抑制前列腺素E2的产生,从而抑制炎症细胞趋化、浸润、活化和多种炎症因子、血管生长因子的释放,抑制血管内皮细胞的活化、增殖、移动,降低血管渗透性和对Bruch膜的破坏作用,从而起到抑制CNV形成和发展的作用。血管内皮细胞在CNV的形成中起了重要作用。本研究观察ZA-76对HUVEC细胞增殖的抑制作用,结果显示,各浓度组ZA-76干预48 h对HUVEC细胞增殖均有明显抑制作用,高浓度组尤为显著,这可能是ZA-76抑制 CNV形成的机制之一。ZA-76抑制COX-2表达的同时,还抑制VEGF的表达。VEGF是CNV形成的关键因子,炎症通过一系列复杂的途径引起VEGF大量表达,促进新生血管形成。COX-2可能是VEGF的上游调节因子之一,抑制COX-2表达可导致VEGF表达减弱,但是否存在其他途径,有待进一步研究。
脉络膜血流受损是AMD晚期继发CNV的重要因素,多种细胞因子参与其中。脉络膜血流改善,可能改善脉络膜毛细血管-Bruch膜-RPE局部的微环境,调节促血管生成与抑制血管新生因子间的平衡,从而影响CNV形成进程[11]。NO是重要的血管张力调节因子,ZA-76能在体内释放NO。从ZA-76对高眼压兔眼血流的影响研究中观察到,ZA-76能明显改善脉络膜血流,这可能是ZA-76抑制CNV形成的机制之一。
ZA-76是一种新合成的非甾体类抗炎药,拥有自主知识产权。初步的研究表明,ZA-76可抑制激光诱发大鼠CNV形成,对CNV相关疾病的防治具有潜在价值。但确切机制有待深入研究。
1 Bok D.Evidence for an inflammatory process in age-related macular degeneration gains new support[J].Proc Natl Acad Sci USA,2005,102(20):7053-7054.
2 Donoso LA,Kim D,Frost A,Callahan A,Hageman G.The role of inflammation in the pathogenesis of age-related macular degeneration[J].Surv Ophthalmol,2006,51(2):137-152.
3 Castro MR,Lutz D,Edelman JL.Effect of COX inhibitors on VEGF-induced retinal vascular leakage and experimental corneal and choroidal neovascularization[J].Exp Eye Res,2004,79(2):275-285.
4 Kuwano T,Nakao S,Yamamoto H,Tsuneyoshi M,Yamamoto T,Kuwano M,et al.Cyclooxygenase 2 is a key enzyme for inflammatory cytokine-induced angiogenesis[J].FASEB J,2004,18(2):300-310.
5 Karahan N,Güney M,Baspinar S,Oral B,Kapucuoglu N,Mungan T.Expression of gelatinase(MMP-2 and MMP-9)and cyclooxygenase-2(COX-2)in endometrial carcinoma[J].Eur J Gynaecol Oncol,2007,28(3):184-188.
6 Takahashi K,Saishin Y,Saishin Y,Mori K,Ando A,Yamamoto S,et al.Topical nepafenac inhibits ocular neovascularization[J].Invest Ophthalmol Vis Sci,2003,44(1):409-415.
7 乔 岗,周希瑗,邓 鑫,李 琳.塞内昔布抑制兔脉络膜新生血管的形成[J].眼视光学杂志,2005,7(4):257-260.
8 Zou Y,Xu X,Chiou GC.Effect of interleukin-1 blockers,CK112,and CK116 on rat experimental choroidal neovascularizationin vivoand endothelial cell culturesin vitro[J].J Ocul Pharmacol Ther,2006,22(1):19-25.
9 吉 洁,徐新荣.柚皮素对激光诱导的大鼠脉络膜新生血管的抑制作用[J].中华眼底病杂志,2010,26(1):79-81.
10李瑞文,张奕华,季 晖,于晓琳,彭司勋.苯基呋咱氮氧化物与双氯芬酸偶联化合物的合成及其抗炎镇痛活性[J].药学学报,2002,37(1):27-32.
11 Friedman E.The role of the atherosclerotic process in the pathogenesis of age-related macular degeneration[J].Am J Ophthalmol,2000,130(5):658-663.
