过氧化氢诱导人视网膜色素上皮细胞衰老及其机制探讨△
2011-05-21牛膺筠周占宇
赵 颖 牛膺筠 周占宇
年龄相关性黄斑变性(age-related macular degeneration,AMD)是我国老年人主要致盲眼病之一。AMD的发生与视网膜色素上皮(retinal pigment epithelium,RPE)细胞的慢性氧化损伤关系密切[1]。我们此前研究发现,过氧化氢诱导的累积性氧化损伤可以引起体外培养的人RPE细胞形态呈老年性改变,并导致其凋亡和坏死[2],但具体机制尚不清楚。因此,本研究在前期研究基础上,通过过氧化氢氧化损伤制作体外培养的人RPE细胞衰老模型,对人RPE细胞衰老的机制进行研究。
1 材料与方法
1.1 材料 DMEM-F12培养基、新生牛血清、胰蛋白酶、青霉素和链霉素(美国Gibco生物技术公司),人RPE细胞(ARPE-19细胞株,货号:CRL-2302;美国细胞培养收集公司),过氧化氢(美国 Sigma公司),碘化丙啶和罗丹明123染料(美国 Molecule Probe公司),Caspases-9单克隆抗体(美国Santa Cruz公司),PV6001免疫组织化学试剂盒和DAB显色试剂盒(北京中山生物技术公司)。
1.2 实验方法
1.2.1 实验分组 取生长良好的人RPE传代细胞,以每孔1×106个接种于4个6孔板中,培养24 h后,将原培养基吸出,换入新的DMEM-F12培养液,取4孔为正常对照组,其他20孔作为过氧化氢处理组加入600 μmol·L-1的过氧化氢,按过氧化氢的作用时段不同设1 h组、6 h组、12 h组、24 h组及72 h组,每组4孔。
1.2.2 流式细胞术测定细胞周期 各组经胰蛋白酶消化收获细胞,1 000 r·min-1离心5 min,离心半径为12 cm,弃上清液,轻震荡离心管使细胞脱壁,缓慢加入1 mL体积分数75%的冷乙醇固定,4℃过夜。1 000 r·min-1离心5 min,PBS液洗2次,加入100 μL 的 10 ×PI溶液,加入 100 μL RnaseA,37 ℃孵育30 min;流式细胞仪检测分析(激发光波长488 nm,发射光波长590 nm),得出 G0/G1期细胞所占比例。
1.2.3 检测线粒体膜电位 各组经胰蛋白酶消化制备成细胞悬液,1 000 r·min-1离心5 min,弃上清后重悬于不含钙镁的Hank液,加入罗丹明123(调整至终浓度 1 mg·L-1),37℃ 孵育 30 min,1 000 r·min-1离心5 min,PBS清洗2次。流式细胞仪检测分析(激发光488 nm,发射光波长525 nm),检测线粒体膜电位的变化。
1.2.4 免疫组织化学法检测Caspase-9的表达 40 g·L-1多聚甲醛固定细胞。实验步骤按照PV6001免疫组织化学试剂盒说明进行,设空白对照(即用PBS代替一抗)。光镜下观察结果。Caspase-9阳性表达于RPE细胞浆中,呈大量特异性黄色着色。应用OPTON VIDAS图像分析系统对结果进行分析,得到平均光密度值。
1.2.5 统计学分析 采用 SPSS 12.0统计软件,数据以均数±标准差表示,两样本均数比较用t检验,组内各时间段间比较用方差分析和q检验。
2 结果
2.1 过氧化氢对RPE细胞周期的影响 与正常对照组相比,过氧化氢作用6 h组RPE细胞处于静止期(G0期)和合成前期(G1期)的细胞所占比率增高(P<0.01),呈G0/G1期阻滞现象,且随作用时间的延长而增加,72 h时达到最高(P <0.01),呈效应-时间依赖性(表1)。
2.2 人RPE细胞线粒体膜电位的变化 流式细胞仪分析各组细胞罗凡明123的荧光强度,其荧光强度降低表明线粒体膜电位降低。与正常对照组比较,过氧化氢作用各时段细胞线粒体膜电位明显降低。过氧化氢作用1 h,即可检测到RPE细胞膜电位降低(P<0.05),且随时间延长逐渐降低,呈效应-时间依赖性(表1)。
2.3 免疫组织化学法检测人RPE细胞Caspase-9的表达变化 在正常对照组,Caspase-9表达于细胞膜和细胞浆上,呈少量特异性浅黄色着色(图1)。在不同时段的过氧化氢处理组,Caspase-9呈特异性棕黄色着色,且随时间的延长而增强,24 h组达到高峰(图2),72 h组略有回落,但仍较正常对照组高,差异具有统计学意义(表1)。
Figure 1 Expression of Caspases-9 protein in human RPE cells of normal group(DAB,×400) 正常对照组Caspase-9蛋白表达(DAB染色,×400)

Figure 2 Expression of Caspases-9 protein in human RPE cells of 24 hours group treated with H2O2(DAB,×400) 过氧化氢处理24 h组Caspase-9蛋白表达(DAB染色,×400)
3 讨论
RPE细胞的损伤、衰老及死亡在AMD发病和病程发展中起到重要作用[3]。由于人RPE细胞在眼部的特殊位置和作用,导致其特别容易受到氧自由基的攻击。随着年龄的增长,蓄积性的氧化损伤导致人RPE细胞功能和结构的异常,进而导致AMD等视网膜疾病的发生[4]。
表1 过氧化氢作用不同时段G0/G1期细胞所占比率、线粒体膜电位以及Caspase-9的表达情况Table1 Changes of G0/G1cell ratio,mitochondrial membrane potential and Caspases-9 protein expression in RPE cells treated by H2O2in different time(±s,n=4)
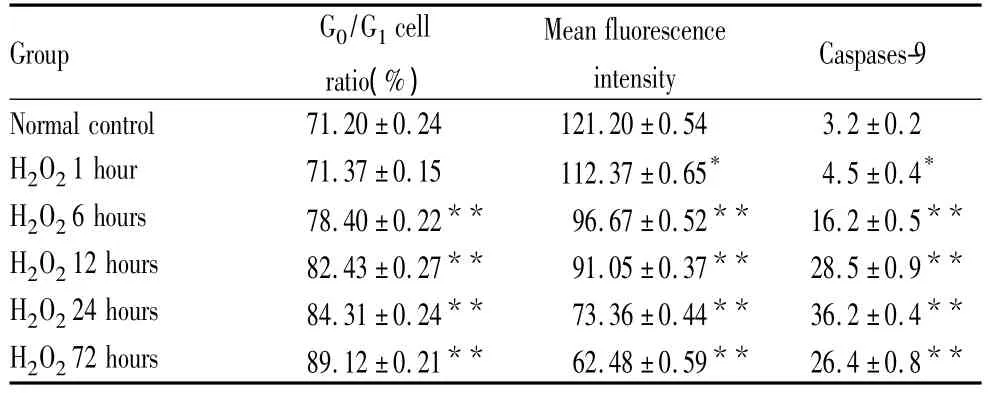
表1 过氧化氢作用不同时段G0/G1期细胞所占比率、线粒体膜电位以及Caspase-9的表达情况Table1 Changes of G0/G1cell ratio,mitochondrial membrane potential and Caspases-9 protein expression in RPE cells treated by H2O2in different time(±s,n=4)
Note:Compared with normal control group,*P <0.05,**P <0.01
Group G0/G1cell ratio(%)Caspases-9 Normal control 71.20±0.24 121.20 ±0.54 3.2 ±0 Mean fluorescence intensity.2 H2O21 hour 71.37±0.15 112.37 ±0.65* 4.5 ±0.4*H2O26 hours 78.40±0.22** 96.67±0.52** 16.2±0.5**H2O212 hours 82.43±0.27** 91.05±0.37** 28.5±0.9**H2O224 hours 84.31±0.24** 73.36±0.44** 36.2±0.4**H2O272 hours 89.12±0.21** 62.48±0.59** 26.4±0.8**
细胞周期异常是反映细胞衰老的重要指标,细胞衰老最显著的特征是细胞阻滞于静止期和DNA合成前期(G0/G1),失去了对有丝分裂原的反应能力和合成DNA的能力,不能进入有丝分裂期[5]。本研究通过流式细胞术测定RPE细胞周期,发现过氧化氢处理后,RPE细胞出现生长停滞,停留在静止期和合成前期的细胞增多,并且随过氧化氢作用时间的延长,生长停滞越发明显,呈效应-时间依赖性。进一步证明了过氧化氢长时间作用可以诱发体外培养的人RPE细胞的衰老。
近年来,细胞衰老的线粒体功能障碍研究成为国内外研究衰老机制的一个热点[6]。线粒体膜电位是由能量代谢过程中线粒体内膜两侧电子的不对称性形成的跨膜电位,参与ATP的代谢过程,对于维持线粒体功能起到重要作用。本研究采用了国内外常用的罗丹明123染色,流式细胞仪分析法检测线粒体膜电位[7]。罗丹明123是亲脂性阳离子荧光染料,线粒体膜电位正常的状态下,罗丹明123进入线粒体呈强荧光,如果线粒体膜电位去极化则会减少对罗丹明123的摄取而导致荧光减弱。所以罗丹明123荧光的强弱反映了线粒体膜电位的变化。我们研究发现,与对照组比较,过氧化氢作用1 h即可见RPE细胞线粒体膜电位降低,且随时间延长逐渐降低,呈效应-时间依赖性。由此可见,线粒体损伤是过氧化氢诱导RPE细胞衰老的早期事件,线粒体是RPE细胞氧化损伤的重要效应细胞器。
线粒体膜电位降低的同时线粒体膜表面出现透过性转运孔。多种凋亡因子会通过透过性转运孔释放到细胞质中,形成级联反应,正反馈地促进凋亡因子的释放,促使细胞凋亡[8]。Caspase-9是线粒体凋亡途径中的核心上游因子[9]。本实验研究发现在不同时段的过氧化氢处理组,Caspase-9呈特异性棕黄色着色,随时间的延长而增强,24 h达到高峰,72 h时表达有所降低。我们前期研究发现,过氧化氢处理24 h可以引起体外培养的人RPE细胞凋亡达到高峰[2]。以上结果表明,Caspase-9介导的线粒体凋亡途径在RPE衰老过程中起到重要的作用。
综上所述,过氧化氢氧化损伤导致了人RPE细胞生长停滞,细胞衰老。其机制与线粒体膜电位降低导致的线粒体代谢障碍和Caspase-9介导的线粒体凋亡途径有关。如何抑制RPE细胞的氧化损伤,稳定线粒体结构和功能,有待进一步的研究。
1 Kopitz J,Holz FG,Kaemmerer E,Schutt F.Lipids and lipid peroxidation products in the pathogenesis of age-related macular degeneration[J].Biochimie,2004,86(11):825-831.
2 牛膺筠,赵 颖,周占宇,刘夫玲,刘成桂,黄琰霞.人视网膜色素上皮细胞累积性氧化损伤的机制探讨[J].中华眼科杂志,2006,42(6):507-512.
3 Curcio CA,Johnson M,Huang JD,Rudolf M.Apolipoprotein B-containing lipoproteins in retinal aging and age-related macular degeneration[J].J Lipid Res,2010,51(3):451-467.
4 Suter M,Reme C,Grimm C,Wenzel A,Jäättela M,Esser P,et al.Age-related macular degeneration:the lipofusion component N-retinyl-N-retinylidene ethanolamine detaches proapoptotic proteins from mitochondria and induces apoptosis in mammalian retinal pigment epithelial cells[J].J Biol Chem,2000,275(50):39625-33630.
5 Leontieva OV,Gudkov AV,Blagosklonny MV.Weak p53 permits senescence during cell cycle arrest[J].Cell Cycle,2010,9(21):4323-4327.
6 Reddy PH.Mitochondrial medicine for aging and neurodegenerative diseases[J].Neuromolecular Med,2008,10(4):291-315.
7 Badisa BR,Darling-Reed SF,Goodman CB.Cocaine induces alterations in mitochondrial membrane potential and dual cell cycle arrest in rat c6 astroglioma cells[J].Neurochem Res,2010,35(2):288-297.
8 Green DR,Kroemer G.The pathophysiology of mitochondrial cell death[J].Science,2004,305(5684):626-629.
9 归东梅,石 磊,杨 飏,李 迅,高殿文.促红细胞生成素对慢性高眼压下大鼠视网膜Caspase-9表达的影响[J].眼科新进展,2010,30(8):727-736
