IL-1α对猪小梁细胞ELAM-1、MAPK通路蛋白表达的影响△
2011-05-21朱玉广吉艳艳钟莹莹杜孝楠
朱玉广 王 杰 吉艳艳 朱 艳 钟莹莹 杜孝楠 张 荣
青光眼小梁细胞和Schlemm管内皮细胞能特异性表达内皮白细胞黏附因子-1(endothelial leukocyte adhesion molecule-1,ELAM-1)[1]。在正常人眼小梁内皮细胞中,外源性白细胞介素-1α(interleukin-1α,IL-1α)可以刺激小梁细胞内源性IL-1α及ELAM-1的表达,活化核因子-κB(nuclear factor-κB,NF-κB),模拟青光眼IL-1的持续表达状态[2]。在血管内皮细胞中,ELAM-1介导的细胞信号转导主要是通过丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)通路进行的,ELAM-1作为跨膜信号转导体,活化MAPK级联效应,形成Ras/Raf-1/磷酸化MEK复合物,引起c-fos表达上调[3]。我们推测,ELAM-1对小梁细胞的作用可能同时伴随MAPK信号通道的改变。为了验证此推测,我们设计此课题,以探讨青光眼的发病机制。
1 材料与方法
1.1 实验材料 取新杀成年猪眼球,无菌条件下低温冰盒运回实验室,进行原代培养。
1.2 主要试剂 DMEM培养液、胎牛血清(GIBCO公司);兔抗人纤维连接蛋白(FN)多克隆抗体、兔抗人层粘连蛋白(LN)多克隆抗体、猪重组IL-1α(R&D公司)、兔抗鼠多克隆免疫球蛋白G(Santa Cruz公司);磷酸化的ERK1/2抗体及磷酸化的P38抗体(美国Santa Cruz公司)。
1.3 小梁细胞的培养和鉴定 采用组织块培养法培养猪眼小梁细胞,免疫组织化学染色(SP法)对传第3代的小梁细胞分别进行FN、LN染色鉴定[4]。
1.4 细胞分组 待爬片的小梁细胞接近融合时,将细胞爬片血清饥饿培养24 h后的细胞分成2组:对照组和IL-1α组。对照组加入无血清培养基,IL-1α组加入10 mg·L-1IL-1α,放入含体积分数5%CO2培养箱中37℃培养30 min。
1.5 SP法测定 猪眼小梁细胞ELAM-1表达。每组随机选取5个视野,计算每个视野阳性细胞均数。
1.6 Western blotting测定 应用 Western blotting技术,以β-actin作为内参照,比较IL-1α对猪眼小梁细胞磷酸化的ERK1/2、JNK和P38蛋白表达的影响。采用Bio-Rad图像分析系统进行分析,用目的蛋白条带的平均光强度值与β-actin条带的平均光强度值的比值表示该蛋白表达的相对强度。
2 结果
2.1 小梁细胞的鉴定 猪眼传第3代的小梁细胞免疫组织化学FN、LN染色阳性,可鉴定为小梁细胞。
2.2 猪眼小梁细胞ELAM-1的表达 正常猪眼小梁细胞不表达ELAM-1,经IL-1α刺激后小梁细胞ELAM-1的表达显著增加(图1)。同对照组相比差异有显著统计学意义(P<0.01)。
2.3 猪眼小梁细胞磷酸化的ERK1/2、JNK和P38的表达 检测结果显示,与对照组相比,经IL-1α作用的猪眼小梁细胞,磷酸化的ERK1/2、JNK和P38的表达明显增加,其中IL-1α对JNK通路的影响最大(P<0.05,图2)。
3 讨论
青光眼小梁细胞和Schlemm管内皮细胞能特异性表达ELAM-1[1],这种表达与青光眼类型、病变严重程度、青光眼治疗史无关。在培养的小梁细胞系中仍保留此种性状。ELAM-1是目前唯一被发现的青光眼房水外流通道细胞(包括小梁细胞和Schlemm管内壁的内皮细胞)的分子标志。但目前ELAM-1在青光眼发病中的作用未明,小梁网的结构和功能与微血管内皮层类似,ELAM-1在两者中可能具有相同的调节机制[5-6],有研究表明青光眼的病理机制和病理改变与多种血管性疾病相同[1]。对ELAM-1的研究必将加深对青光眼发病机制的了解。

Figure 1 Effect of IL-1α on expression of ELAM-1 in pig trabecular meshwork cells IL-1α对猪眼小梁细胞ELAM-1表达的影响
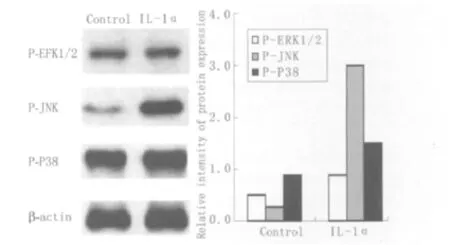
Figure 2 Effect of IL-1α on expression of ERK1/2,JNK and p38 protein in pig trabecular meshwork cells IL-1α对猪眼小梁细胞磷酸化的ERK1/2、JNK和P38表达的影响
小梁网的结构和功能与微血管内皮层的类似[5]。在血管疾病中ELAM-1的表达与液体压力梯度和氧化应激有关[6],因此我们有理由推测青光眼房水外流通道特异性表达ELAM-1可能与青光眼发病的主要危险因素眼压升高和氧化应激有关,并且可能与血管疾病中ELAM-1的表达具有相同的调节机制。
研究显示,ELAM-1的表达与IL-1/NF-κB自反馈途径有关[1]。青光眼小梁细胞能持续表达IL-1α,且这种内源性的IL-1α在ELAM-1的自反馈调控中起主要作用。在正常人眼小梁内皮细胞中,外源性IL-1α可以刺激内源性IL-1α及ELAM-1的mRNA和蛋白表达,活化NF-κB,模拟青光眼IL-1的持续表达状态[2]。
在血管内皮细胞中,ELAM-1介导的细胞信号转导是通过MAPK途径实现的,ELAM-1作为跨膜信号转导体,活化 MAPK级联,形成 Ras/Raf-1/磷酸化MEK复合物,引起c-fos基因表达上调[3]。已经发现在小梁细胞也存在MAPK途径[7]。我们可以推测,IL-1α对小梁细胞的作用可能同时伴随了MAPK途径的改变。MAPK通路主要包括:(1)丝裂原活化蛋白激酶信号通路(ERK1/2);(2)c-Jun N端激酶信号通路(JNK);(3)p38 MAPK 信号通路[8]。
小梁网的结构和功能与微血管内皮层类似[5]。我们推测,IL-1α对小梁细胞的作用可能同时伴随了MAPK途径的改变。
我们的结果显示,正常猪眼小梁细胞不表达ELAM-1,经IL-1α刺激后小梁细胞ELAM-1的表达显著增加。经IL-1α作用的猪眼小梁细胞,磷酸化的ERK1/2、JNK和P38的表达显著增加,其中JNK通路的表达改变最明显。外源性IL-1α作用于猪眼小梁细胞后,MAPK通路所包括的ERK、JNK和p38通路均发生活化,其中对JNK通路的影响最大。
Wang 等[9]认为小梁细胞 IL-1/NF-κB/ELAM-1的表达可能是青光眼自我代偿机制之一。我们认为,IL-1/ELAM-1/MAPK蛋白的表达也可能是青光眼自我代偿机制。当房水外流通路组织受到外界刺激如眼压升高时,小梁细胞可通过MAPK信号通道的活化以代偿应激反应,通过MAPK途径影响细胞的增殖和细胞与细胞外基质的黏附性,改变细胞形态[10],提高房水外流通畅性来影响眼压。
1 Wang N,Chintala SK,Fini ME,Schuman JS.Activation of a tissue-specific stress response in the aqueous outflow pathway of the eye defines the glaucoma disease phenotype[J].Nat Med,2001,7(3):304-309.
2 Birke MT,Birke K,Lütjen-Drecoll E,Schlötzer-Schrehardt U,Hammer CM.Cytokine-dependent ELAM-1 induction and concomitant intraocular pressure regulation in porcine anterior eye perfusion culture[J].Invest Ophthalmol Vis Sci,2011,52(1):468-475.
3 Hu Y,Kiely JM,Szente BE,Rosenzweig A,Gimbrone MA Jr.E-selectin-dependent signaling via the mitogen-activated protein kinase pathway in vascular endothelial cells[J].Immunology,2000,165(4):2142-2148.
4 张 虹,单长梅,李贵刚,陈莲一.开放式压力控制培养系统对人眼小梁细胞超微结构及纤维连接蛋白合成的影响[J].华中科技大学学报(医学版),2007,36(4):510-513.
5 Sainani GS,Maru VG.The endothelial leukocyte adhesion molecule.Role in coronary artery disease[J].Acta Cardiol,2005,60(5):501-507.
6 Suarez T,Vecino E.Expression of endothelial leukocyte adhesion molecule 1 in the aqueous outflow pathway of porcine eyes with induced glaucoma[J].Mol Vis,2006,12(15):1467-1472.
7 Shearer T,Crosson CE.Activation of extracellular signal-regulated kinase in trabecular meshwork cells[J].Exp Eye Res,2001,73(1):25-35.
8 Fischer AJ,Scott MA,Ritchey ER,Sherwood P.Mitogen-activated protein kinase-signaling regulates the ability of Müller glia to proliferate and protect retinal neurons against excitotoxicity[J].Glia,2009,57(14):1538-1552.
9 Wang N,Chintala SK,Fini ME,Schuman JS.Ultrasound activates the TM ELAM-1/IL-1/NF-kappaB response:a potential mechanism for intraocular pressure reduction after phacoemulsifica-tion[J].Invest Ophthalmol Vis Sci,2003,44(5):1977-1981.
10周 崎,赵家良,刘玉琴.内皮细胞白细胞粘附分子-1对猪眼小梁细胞形态和细胞骨架的作用[J].中华眼科杂志,2004,40(9):614-619.
