氢醌抑制HL-60细胞分化上调过氧化物酶2-Cys过氧化物氧还蛋白表达
2011-05-14韦潇湘王春双陈长艳陆彩玲郭松超李习艺
韦潇湘,唐 深,王春双,陈长艳,陆彩玲,郭松超,李习艺
(广西医科大学1.公共卫生学院;2.基础医学院;广西南宁 530021)
氢醌(hydroquinone,HQ)又名对苯二酚[C6H(OH)],是苯在生物体内的代谢产物,在苯血液毒性中发挥重要的作用,可导致再生障碍性贫血、骨髓异常增生综合征、白血病及淋巴瘤等多种造血系统功能障碍,研究HQ血液毒性机制对探讨苯的毒性机制具有重要的意义。前期研究发现,在人胚肺成纤维细胞MRC-5及人脐血单个核细胞中,HQ的毒性可能与过氧化物酶2-Cys过氧化物氧还蛋白(peroxiredoxins)(2-Cys Prxs)有关[1-2]。2-Cys Prxs是细胞内一类抗氧化蛋白家族,它们都有两个高度保守的具有氧化还原活性的半胱氨酸残基,即过氧化活性的胱氨酸残基cys51和还原活性的半胱氨酸残基cys172。2-Cys Prxs在氧化应激中发挥重要的作用[3],保护细胞免受氧自由基损害,同时它们在细胞增殖与分化中也起着重要的作用[4]。HL-60细胞株是人前髓细胞株,其髓系祖细胞特性明显,具有多向分化能力,在豆蔻酰佛波醇(phorbol 12-myristate 13-acetate,PMA)或二甲亚砜(DMSO)诱导下可分别向单核系或粒系分化,适用于粒系、单核系分化研究[5-6]。本实验主要研究HQ对HL-60细胞向单核系、粒系分化的影响,并探讨2-Cys Prxs在其中的作用。
1 材料与方法
1.1 细胞与试剂
HL-60细胞购自上海细胞生物所,IMDM培养基购自美国海克隆实验室公司,PMA和HQ购自Sigma公司,硝基四氮唑蓝(NBT)购自Sanland公司,Cell Counting Kit-8(CCK-8试剂盒)、显影定影试剂盒购自碧云天生物技术研究所。cDNA合成试剂盒、PCR试剂盒与荧光定量 PCR引物购自沈阳TaKaRa公司;Trizol购自美国 Invitrogen公司,Western印迹抗体购自Santa Cruz公司及Fermantas公司,其余试剂为国产分析纯。
1.2 细胞培养
HL-60细胞培养于IMDM培养基,含胎牛血淸200 ml·L-1,青霉素 100 kU·L-1,链霉素 100 mg·L-1。在37℃,含体积分数为0.05 CO2的培养箱内培养传代。
1.3 HL-60 细胞染毒
根据前期实验结果及文献[2,5-6],细胞分为正常对照组、PMA 20 nmol·L-1、PMA 20 nmol·L-1+HQ 1,5 和50 μmol·L-1,以及 1.25%DMSO对照、DMSO+HQ 1,5 和 50 μmol·L-1组,各组细胞数为1×109L-1。HQ用前用无血清IMDM配制,正常对照组加入相应体积无血清IMDM。分别在48和96 h收集细胞。
1.4 细胞形态学观察
取各个实验组的HL-60细胞悬液5 μl推片晾干,乙醇 50 ml·L-1固定 5 min,乙醇 80 ml·L-1固定5 min后晾干,瑞氏-姬姆萨染液染色5~10 min冲洗晾干,光镜下观察。
1.5 NBT还原酶检测HL-60细胞分化
收集各个实验组的HL-60细胞,锥虫(台盼)蓝检测细胞活力,取200 μl含有1×1 O5个活细胞的细胞悬液,加入200 μl 1%NBT 溶液含终浓度为2 mg·L-1的佛波酯(PMA)混合,放入37℃孵育60 min,再将细胞离心后去除上清液,每份标本加入200 μl DMSO,在室温下振荡20 min,测波长570 nm的吸光度值(absorbance,A)[7-8]。A 值越大表明细胞分化程度越佳。
1.6 HL-60细胞增殖检测
参照CCK-8试剂说明书收集各组HL-60细胞,弃原培养液,每组细胞加入含 CCK-8 100 ml·L-1的培养基,37℃继续培养1 h后,测定A450nm。
1.7 荧光定量PCR检测2-Cys Prxs基因表达
1.7.1 总 RNA 制备
离心收集各实验组的细胞,弃培养液,加入1 ml Trizol,室温放置 10 min,加 0.2 ml氯仿,振荡 15 s,静置3 min,4℃,12 000×g离心15 min,取水相加入0.5 ml异丙醇,室温放置10 min,4℃,12 000 ×g离心10 min,75%乙醇洗涤干燥后溶于纯焦碳酸二乙酯,紫外分光光度仪检测提取总RNA的质量和浓度。要求A260/A280在1.8~2.1范围,并计算 RNA含量。
1.7.2 cDNA 的合成
反应体系 20 μl,取随机引物(100 μmol·L-1)1 μl,每一份标本取总 RNA 1 μg,RNA 酶抑制剂(40 kU·L-1)0.5 μl,dNTP 混合物 (各 10 μmol·L-1)1 μl,5 倍反应缓冲液4 μl,逆转录酶100 U,加纯焦碳酸二乙酯至 20 μl。按 42℃ 30 min,95℃ 2 min,进行逆转录。合成好的cDNA置于-20℃保存备用。
1.7.3 实时荧光定量 PCR检测2-Cys Prxs基因表达
20 μl反应体系中包括:上下游引物 10 μmol·L-1各 0.8 μl,SYBR ® Premix Ex TaqTM(2 × )10 μl,ROX Reference DyeⅡ(50 × )0.4 μl,双蒸水 7 μl,cDNA标本1 μl。各基因扩增片段长度如下:PrxⅠ为141 bp,PrxⅡ为129 bp,PrxⅢ为98bp,PrxⅣ为75 bp,引物序列见表 1。按 95℃,30 s;40个循环(95℃,5 s;60℃,34 s)进行反应,反应结束后,仪器自动记录每个反应管中的荧光信号到达所设定的域值时所经历的循环数(threshold cycles,Ct)值。以β肌动蛋白基因为内参,采用双ΔCt法计算目的基因表达量,每个样品目的基因表达量除以内参基因β肌动蛋白表达量即为样品基因相对含量[8]。以2-(实验组ΔCt-对照组ΔCt)表示实验组目的基因相对于正常对照组表达的变化倍数。其中实验组ΔCt和对照组ΔCt分别是实验组和对照组目的基因与内参基因β肌动蛋白的Ct的差值。

表1 过氧化物氧还蛋白(Prx)Ⅰ,PrxⅡ,PrxⅢ,PrxⅣ及β肌动蛋白引物序列Tab.1 Primer of peroxiredoxin(Prx)Ⅰ,PrxⅡ,PrxⅢ,PrxⅣand β-actin in real time PCR
1.8 Western印迹法检测PrxⅢ蛋白的表达
各实验组细胞用Trizol抽提RNA的同时抽提总蛋白,用Bradford法定量蛋白,调整总蛋白上样量,以β肌动蛋白为内参照。SDS-PAGE电泳后,0.1 A恒流转膜35 min;5%脱脂牛奶封闭1 h,一抗4℃孵育过夜,TBST洗膜3次,每次10 min,二抗常温孵育1 h,TBST洗膜3次,每次10 min,在暗房进行化学发光试剂染膜后显影成像。以目标条带与β肌动蛋白条带积分吸光度(integrated absorbance,IA)的比值定量蛋白表达。
1.9 统计学分析
2 结果
2.1 氢醌对HL-60细胞形态的影响
图1染色结果显示,正常对照组细胞胞体较大,胞核大而圆,胞质碱深染,核质比例大。DMSO,HQ+DMSO组可见细胞胞体明显缩小,胞核凹陷,核质比例缩小,杆状核、分叶核细胞增多,细胞趋于向成熟粒系分化。PMA和HQ+PMA组可见部分细胞易贴壁,细胞核浆比例变小,核形状不规则,有明显的扭曲或折叠,呈肾形或U形、马蹄形等,呈现向单核或巨噬细胞分化的特征。

图1 氢醌(HQ)对HL-60细胞形态的影响 (瑞氏-姬姆萨染色 ×400).A:正常对照细胞,箭头示细胞胞核大而圆;B:豆蔻酰佛波醇乙酯(phorbol 12-myristate 13-acetate,PMA)处理细胞48 h后,箭头示U形细胞;C:1.25%二甲亚砜(DMSO)处理细胞96 h后,箭头示多叶核细胞;D:PMA+HQ 50 μmol·L-1处理细胞48 h后,箭头示不规则核细胞;E:DMSO+HQ 5 μmol·L-1处理细胞96 h后,箭头示细胞胞核凹陷;F:DMSO+HQ 50 μmol·L-1处理细胞96 h后,箭头示多叶核细胞.Fig.1 Effect of hydroquinone(HQ)on morphological changes in HL-60 cells(Wright Giemsa ×400).
2.2 氢醌对HL-60细胞分化的影响
表2所示各实验组的HL-60细胞对NBT还原力。与正常对照组比较,PMA组和DMSO组HL-60细胞NBT还原力明显增加(P<0.05),说明PMA和DMSO可分别诱导HL-60细胞向单核细胞和粒细胞分化。与PMA和DMSO对照组比较,PMA+HQ和DMSO+HQ各组细胞对NBT还原力均下降,PMA+HQ 5 和 50 μmol·L-1组与 PMA 组比较有明显差异(P <0.05),说明 HQ 1 和5 μmol·L-1可以抑制 HL-60 细胞向单核系分化;DMSO+HQ 50 μmol·L-1组和DMSO对照组比较有显著差异(P<0.05),表明HQ 50 μmol·L-1可抑制细胞向粒系分化。

表2 氢醌对HL-60细胞分化的影响Tab.2 Effect of HQ on differentiation of HL-60 cells
2.3 氢醌对HL-60细胞增殖的影响
如表 3 所示,HQ 50 μmol·L-1+PMA 作用于HL-60细胞后,细胞CCK-8还原值与单独PMA组比较明显下降;HQ 5,50 μmol·L-1+DMSO 组细胞CCK-8的还原值与单独DMSO组比较明显下降。这表明 HQ 5 和 50 μmol·L-1与诱导剂的共同作用可以抑制HL-60细胞增殖。

表3 氢醌对HL-60细胞增殖的影响Tab.3 Effect of HQ on proliferation of HL-60 cells
2.4 氢醌对HL-60细胞2-Cys Prxs基因表达的影响
总RNA凝胶电泳后,28 s亮度明显强于18 s,5 s很弱,说明RNA完整性较好(图2),分光光度计测A260/A280在1.8~2.1。各目的基因在 HL-60 细胞表达相对定量检测结果显示,PrxⅠ~PrxⅣ各引物融解曲线均呈清晰的单一峰型,说明设计的引物扩增出的扩增产物没有非特异性扩增,引物可用。各基因表达Ct值在16~24,各基因的相对表达量在0.15~2。与正常对照组比较,PMA组2-Cys Prxs基因表达水平均有降低的趋势,PrxⅢ的表达水平与正常对照组比较有明显差异(P<0.05);DMSO组的2-Cys Prxs基因表达水平显著降低(P<0.01)。给予 HQ 刺激后,在PMA+HQ 5 μmol·L-1组,PrxⅢ,PrxⅣ的表达高于对照组(P<0.01),在PMA+HQ 50 μmol·L-1组,PrxⅠ,PrxⅢ,PrxⅣ的表达水平与正常对照组和PMA组相比明显增高(P<0.01)。PrxⅡ在各处理组的表达水平低于对照组,但没有统计学意义。而随着 HQ 浓度的增加,只有 HQ 50 μmol·L-1+DMSO组PrxⅠ,PrxⅢ的表达水平与DMSO组相比明显增高(P <0.01),HQ 5 μmol·L-1+1.25%DMSO各组与单独DMSO组比较,2-Cys Prxs各基因表达水平的差别没有统计学意义(表4,表5)。

图2HQ作用HL-60细胞后的核蛋白体RNA琼脂糖凝胶电泳图.M:标志物;条带1~5:分别为正常对照,PMA,PMA+HQ1,5 和50 μmol·L-1组.Fig.2 RNA agarose gel electrophoresis of HL-60 cells affected by HQ.

表4 HQ对PMA诱导的HL-60细胞向单核系分化过程中过氧化物酶2-Cys过氧化物氧还蛋白(2-Cys Prx)基因表达的影响Tab.4 Effect of HQ on expression of 2-Cys peroxiredoxins(2-Cys Prxs)in HL-60 cells during monocytic differentiation induced by PMA
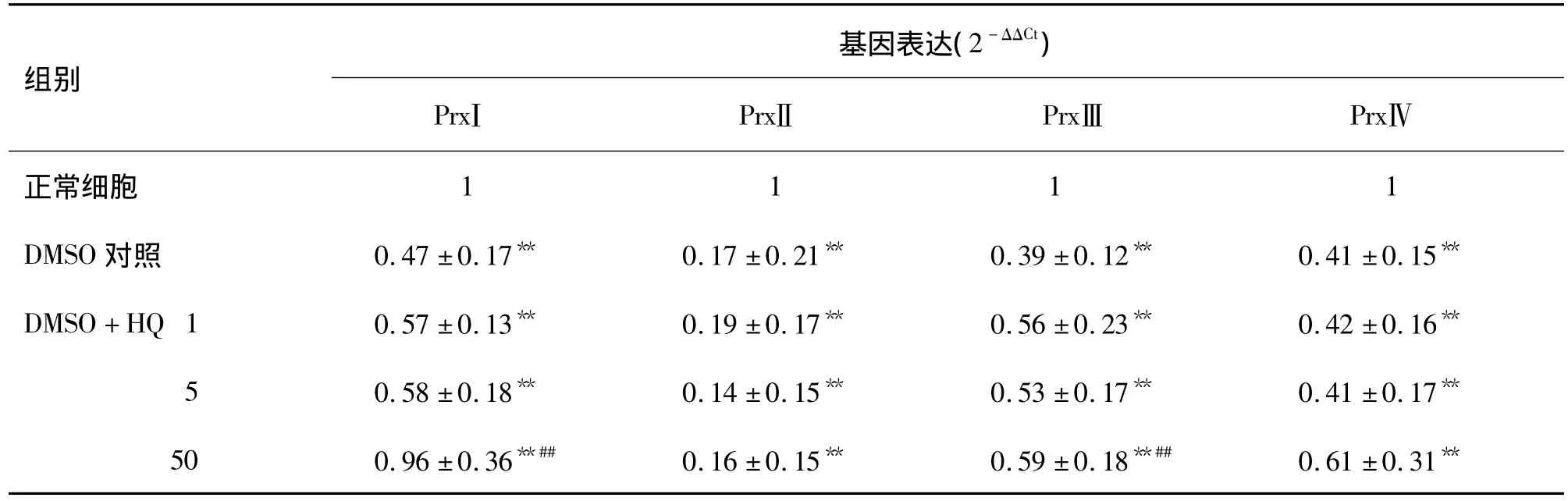
表5 HQ对DMSO诱导的HL-60细胞向粒系分化过程中2-Cys Prxs基因表达的影响Tab.5 Effect of HQ on expression of 2-Cys Prxs in HL-60 cells during granulocytes differentiation induced by DMSO
2.5 氢醌对HL-60细胞PrxⅢ蛋白表达的影响
如图3和图4所示,PMA对照组和DMSO对照组PrxⅢ蛋白表达水平均低于正常对照组。在PMA诱导分化的实验组中,给予HQ共同处理后,各组PrxⅢ蛋白表达量有显著增加的趋势(P<0.01)。在DMSO诱导分化的实验组中,只有在HQ 50 μmol·L-1+DMSO组PrxⅢ表达量明显高于DMSO对照组(P<0.01)但低于正常对照组(P<0.05)。蛋白免疫印迹结果与荧光定量PCR结果是一致的,说明PrxⅢmRNA表达水平变化和蛋白表达水平的变化是一致的。
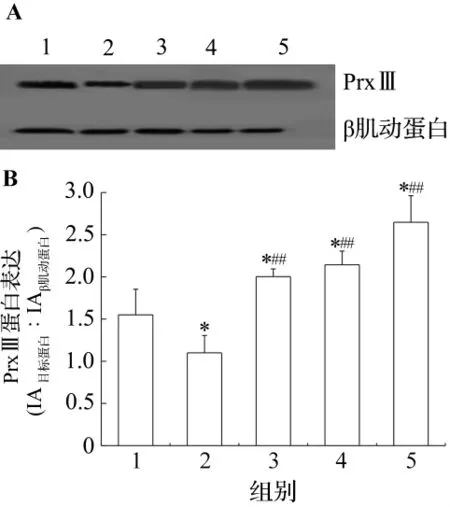
图3HQ对PMA诱导的HL-60细胞向单核系分化过程中PrxⅢ蛋白表达的影响.A:Western印迹;B:半定量结果.1~5分别为正常对照,PMA对照,PMA+HQ 1,5和50 μmol·L-1组.±s,n=6.*P<0.05,与正常对照组比较;##P<0.01,与PMA对照组比较.Fig.3 Effect of HQ on expression of PrxⅢ protein in HL-60 cells during monocytic differentiation induced by PMA detected by Western blotting.

图4HQ对1.25%DMSO诱导的HL-60细胞向粒系分化过程中PrxⅢ蛋白表达的影响.A:Western印迹;B:半定量结果.1~5分别为正常对照,DMSO对照,DMSO+HQ 1,5和50 μmol·L-1组.±s,n=6.*P<0.05,与正常对照组比较;##P<0.01,与DMSO组比较.Fig.4 Effect of HQ on expression of PrxⅢ protein in HL-60 cells during grannlocytes differentiation induced by 1.25%DMSO detected by Western blotting.
3 讨论
本研究结果显示,HQ作用后,PMA诱导HL-60细胞向单核系分化受到抑制,与Oliveira等[7]所报道的一致。但关于HQ对HL-60细胞向粒系分化的影响,Oliverira[7]与 Hedli等[9]报道不一,可能是由于HQ剂量不同所致。而在本实验中,HQ 1 μmol·L-1对粒系分化无影响,但较高剂量HQ可抑制细胞向粒系分化,这些结果提示细胞向单核系分化较向粒系分化对HQ所引起的细胞毒性作用更为敏感。在本实验中也发现,较高剂量HQ抑制分化的同时伴随细胞增殖的抑制,说明一定剂量HQ可以影响细胞的分化与增殖,它可能就是通过这种途径而发挥其在血液系统中的毒性作用。
本研究结果显示,PrxⅠ,PrxⅢ和PrxⅣ与HQ对HL-60细胞分化和增殖抑制的生物学效应有关。其中PrxⅢ在所有分化抑制的细胞组表达显著增高,而在分化未受到抑制的组未见诱导表达,提示其在HQ抑制分化过程中扮演重要角色。但在本次实验中,未能用RNAi技术抑制PrxⅢmRNA表达来进一步观察PrxⅢ是否真正地参与HQ抑制HL-60细胞分化的过程,因此还不能说明PrxⅢ与此过程有真正的因果关系,这在后续的实验中会继续研究。PRXⅢ定位于线粒体,在线粒体抗氧化防御机制中起着重要作用,并且参与细胞的增殖、分化、转化和凋亡等活动[10-11]。Yang 等[10]研究表明 PrxⅢ与红细胞的分化有关,Wonsey等[11]也发现PrxⅢ是Myc的靶基因,参与Myc介导的增殖、凋亡和肿瘤转化。但PrxⅢ在粒系分化中的作用如何尚未见报道,其在HQ对HL-60细胞分化影响过程中的具体作用及机制如何,其表达水平的变化是分化的原因还是结果等问题都还有待进一步研究。
[1] Li X,Tang S,Huang H,Yang L,Liu J,Zhuang Z.Induction of a cell-survival adaptive response in MRC-5 cells by hydroquinone[J].Mutat Res,2008,652(2):180-185.
[2] 唐 深,李习艺,陆彩玲,曾晓春,肖德强,孙 斌,等.氢醌刺激脐血单个核细胞适应性反应基因表达[J].中国公共卫生,2009,25(11):1339-1340.
[3] Fujii J,Ikeda Y.Advances in our understanding of peroxiredoxin,a multifunctional,mammalian redox protein[J].Redox Rep,2002,7(3):123-130.
[4] Butterfield LH,Merino A,Golub SH,Shau H.From cytoprotection to tumor suppression:the multifactorial role of peroxiredoxins[J].Antioxid Redox Signal,1999,1(4):385-402.
[5] Zheng X,Ravatn R,Lin Y,Shih WC,Rabson A,Strair R,et al.Gene expression of TPA induced differentiation in HL-60 cells by DNA microarray analysis[J].Nucleic Acids Res,2002,30(20):4489-4499.
[6] Saegusa S,Totsuka M,Kaminogawa S,Hosoi T.Saccharomyces cerevisiae and Candida albicans stimulate cytokine secretion from human neutrophil-like HL-60 cells differentiated with retinoic acid or dimethylsulfoxide[J].Biosci Biotechnol Biochem,2009,73(12):2600-2608.
[7] Oliveira NL,Kalf GF.Induced differentiation of HL-60 promyelocytic leukemia cells to monocyte/macrophages is inhibited by hydroquinone,a hematotoxic metabolite of benzene[J].Blood,1992,79(3):627-633.
[8] Li D,Wang Z,Chen H,Wang J,Zheng Q,Shang J,et al.Isoliquiritigenin induces monocytic differentiation of HL-60 cells[J].Free Radic Biol Med,2009,46(6):731-736.
[9] Hedli CC,Rao NR,Reuhl KR,Witmer CM,Snyder R.Effects of benzene metabolite treatment on granulocytic differentiation and DNA adduct formation in HL-60 cells[J].Arch Toxicol,1996,70(3-4):135-144.
[10] Yang HY, Jeong DK, Kim SH, Chung KJ,Cho EJ,Yang U,et al.The role of peroxiredoxinⅢ on late stage of proerythrocyte differentiation[J].Biochem Biophys Res Commun,2007,359(4):1030-1036.
[11] Wonsey DR, Zeller KI, Dang CV. The c-Myc target gene PRDX3 is required for mitochondrial homeostasis and neoplastic transformation[J].Proc Natl Acad Sci USA,2002,99(10):6649-6654.
