竹节人参皂苷对乙醇致肝细胞L-O2损伤的保护作用
2011-05-14李有贵计东风郑贤林时连根
李有贵,计东风,钟 石,郑贤林,时连根
(1.浙江大学动物科学学院特种经济动物科学系,浙江杭州 310029;2.浙江省农业科学院蚕桑研究所,浙江杭州 310021)
竹节人参(Panax japonicus C.A.Mey)系五加科植物,为《中国药典》收载的名贵常用中药,其主要化学成分为竹节人参皂苷[1-2],具有保护乙醇性胃黏膜损伤和抗氧化等多方面的作用[3-4]。近年来,本课题组研究发现,人工栽培竹节人参总皂苷具有显著的体外清除自由基的作用[5],可降低乙醇性肝损伤小鼠血清和肝组织中丙二醛(malondialdehyde,MDA)含量,提高谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和超氧化物歧化酶(superoxide dismutase,SOD)活性;细胞实验研究发现,其可通过上调GPX3,SOD1和SOD3的mRNA水平,从而发挥抗氧化作用[5]。但竹节人参皂苷单体对乙醇性肝细胞损伤的作用尚未见报道。因此,本研究对通过高效液相色谱-蒸发光散射检测法(HPLC-ELSD)分离纯化得到的纯度大于98%的竹节人参皂苷单体,观察其对人源性肝细胞L-O2的生长、细胞内MDA含量及GSH-Px和SOD活性的影响,探讨竹节人参皂苷对乙醇损伤肝细胞的保护作用及可能的作用机制,为竹节人参的开发利用提供科学依据。
1 材料与方法
1.1 细胞株、试剂和仪器
人胚肝细胞L-O2,中国科学院上海生物化学与细胞生物学研究所。噻唑蓝(MTT)和二甲亚砜(DMSO),美国Sigma公司;RPMI 1640培养基,美国Gibco BRL公司;胎牛血清(fetal bovine serum,FBS),杭州四季青生物材料研究所;胰蛋白酶和磷酸盐缓冲液,美国Amresco公司;MDA含量、SOD和GSH-Px活性测定试剂盒,南京建成生物工程研究所(批号20100520)。CO2培养箱,美国Thermo公司;Leica-DM2500正置显微镜,德国 Leica公司;Nikon-TS100型倒置光学显微镜,日本Nikon公司;Infinite M200酶标仪,瑞士TECAN公司;超低温冰箱,日本Sanyo公司;96和6孔培养板,美国Corning公司;Agilent 1200液相系统,包括四元泵,自动进样器,自动收集器,真空脱气机,蒸发光散射检测器(Sedex 85),法国Sedere公司;操作软件为 Agilent chemstation,美国 Agilent公司;micrOTOF QⅡ型质谱仪,德国Bruker Daltonics公司。针式过滤器,美国Pall公司。
1.2 竹节人参总皂苷的提取
竹节人参采自浙江临安青凉峰自然保护区人工种植的3年生根茎,由浙江省农业科学院农信所洪林副研究员鉴定,65℃干燥,常温粉碎过120目筛备用。准确称取竹节人参粉末10 g,加入乙醚(料液比1 g∶40 ml),超声波提取4 h,弃去乙醚液,取残渣挥发乙醚,加甲醇(料液比1 g∶40 ml)超声波提取4 h,取甲醇提取液,挥发干燥。提取物加去离子水50 ml溶解后置分液漏斗中,用水饱和的正丁醇萃取5次,每次30 ml,合并正丁醇萃取液。正丁醇萃取液先用1%氢氧化钠溶液洗涤3次,每次50 ml,弃去碱液,再用正丁醇洗涤3次,每次50 ml,弃去水液。取正丁醇萃取液,蒸干,加甲醇溶解,即得竹节人参总皂苷粗提液[6]。
1.3 竹节人参皂苷的纯化及质谱分析
竹节人参总皂苷粗提液过0.45 μm过滤器,滤过液上机进行HPLC分离。色谱柱:ZORBAX SB-C18(150 mm ×2.1 mm,5 μm);柱温:35℃;流动相:0.1%醋酸水溶液(A)和乙腈(B),梯度洗脱〔(0~20 min,(17% ~20%)B;20~21 min,(20% ~24%)B;21~30 min,(24% ~29%)B;30 ~40 min,(29% ~33%)B;40~45 min,(33% ~41%)B;45 ~57 min,(41% ~55%)B;57~58 min,(55% ~90%)B;58~63 min,95%B;63~64 min,(95% ~17%)B;64~70 min,17%B〕,流速 0.6 ml·min-1,蒸发光散射检测器,蒸发温度40℃,载气为压缩空气,压力0.34 MPa,增益系数为1。对每一个皂苷组分进行自动收集,同时进行质谱分析。
质谱分析条件:micrOTOF QⅡ型质谱仪采用ESI离子源;扫描方式:负离子;流速 0.3 ml·min-1;喷雾气体60 kPa及干燥气体(6.0 L·min-1)均为氮气(N2);干燥温度220℃;毛细管电压3500 V,毛细管出口电压-170.0 V;以氩气作为碰撞气体对各个物质进行碰撞诱导解离电压在30~50 eV间变化,扫描质荷比(mass-to-charge ratio,m/z)范围为 50 ~3000。
1.4 竹节人参皂苷样品溶液的制备
精密称取纯化的竹节人参皂苷Rg1,Re,Rf,F3,Rg2和 Rd,用无血清培养液(含 0.1%DMSO)溶解后,依次稀释配制成 0.32,0.64,1.28,2.56 和5.12 g·L-1梯度的样品溶液,针式过滤器除菌后使用,现配现用。
1.5 细胞培养
人胚肝细胞L-O2采用RPMI 1640培养基(加10%灭活FBS,不含抗生素)置于37℃,5%CO2培养箱中饱和湿度培养,2 d换液1次。实验中所用细胞均处于对数生长期,活细胞数大于95%。
1.6 MTT法检测L-O2细胞存活率
取对数生长期细胞 L-O2经胰酶消化后,用RPMI 1640培养液吹打配成细胞1×108L-1悬液,加入 96 孔培养板,每孔 100 μl,在 5%CO2,37℃ 培养箱中培养24 h。待细胞完全贴壁后,分别加入6种人参皂苷 100 μl,终浓度分别为 0.16,0.32,0.64和1.28 g·L-1,每组 8 孔;正常对照孔(含细胞 100 μl)加入含0.1%DMSO 的无血清培养液100 μl;空白对照孔(不含细胞)加入等量的含人参皂苷无血清培养液,用于MTT测定调零。培养箱中孵育48 h后,加入 20 μl MTT 5 g·L-1,继续培养 4 h,去上清液,加入DMSO 150 μl,在摇床上振动摇匀,在酶标仪570 nm波长下测得各孔吸光度(absorbance,A)值。实验重复3次。按下式计算肝细胞的存活率。存活率(%)=(实验组A570nm-正常对照组A570nm)/正常对照组A570nm×100%。
1.7 选择损伤人胚肝细胞L-O2乙醇浓度
在96孔培养板中加入1×108L-1L-O2细胞悬液,每孔100 μl。待细胞完全贴壁后,实验孔分别加入100 μl乙醇溶液,终浓度分别为 25,50,75,100,200,400和 800 mmol·L-1,正常对照孔加入含0.1%DMSO 的无血清培养液100 μl,空白对照孔加入等量的含人参皂苷无血清培养液。每组8孔。培养箱中孵育48 h后,按1.6方法测定各孔A值。按下式计算对肝细胞的抑制率。抑制率(%)=(正常对照组A570nm-实验组A570nm)/正常对照组A570nm×100%,以确定损伤L-O2细胞的乙醇浓度。
1.8 乙醇损伤的人胚肝细胞L-O2存活的测定
在96孔培养板中加入L-O2细胞1×108L-1悬液100 μl。待细胞完全贴壁后,实验孔加入50 μl乙醇溶液,终浓度为 200 mmol·L-1,同时加入 50 μl竹节人参皂苷样品液,终浓度分别为0.16,0.32,0.64 和1.28 g·L-1,每个浓度设 8 个复孔,并设正常对照组(细胞,未加乙醇)、乙醇损伤模型组(细胞,加乙醇,不加药物)和空白对照孔(不含细胞,用于MTT测定调零)。培养箱孵育48 h,按1.6方法测定各孔A值。按1.7方法计算对肝细胞的抑制率。
1.9 肝细胞 L-O2 MDA含量、SOD活性和GSH-Px活性的测定
取对数生长期的细胞经胰酶消化后,分别用RPMI 1640培养液吹打制成细胞1×109L-1悬液,分别加入24孔培养板,在5%CO2,37℃培养箱培养24 h,待细胞完全贴壁后,按1.8方法加入乙醇终浓度200 mmol·L-1和 Rg10.16,Rf 0.64 和 Re 1.28 g·L-1,每个浓度设4个复孔,并设正常对照组(细胞未加乙醇)和乙醇损伤模型组(细胞加乙醇,不加药物)。培养箱孵育48 h后收集细胞,用生理盐水配置成相同细胞浓度,超声波破碎后,按MDA,SOD和GSH-Px测定试剂盒方法测定MDA含量、SOD活性和GSH-Px活性。
1.10 统计学分析
2 结果
2.1 竹节人参皂苷的组成和结构鉴定
由图1所示,从人工种植的竹节人参中分离获得6个皂苷组分,通过标准品比对,结合高效液相色谱-电喷雾电离-质谱(high performance liquid chromatography-electrospray ionization-mass spectroscope,HPLC-ESI-MS)分析,认为分别是 Rg1,Re,Rf,F3,Rg2和Rd,其分子结构图及基团见图2和表1,ESI-MS和相应的碰撞诱导解离(collision induced dissociation,CID)数据见表 2,其中 ESI-MS-CID 图谱以Re为例(图3)。
利用四级杆飞行时间质谱分析(以人参皂苷Re为例),在ESI/MS一级质谱检测中,加合离子

图1 高效液相色谱-电喷雾电离-质谱分析竹节人参皂苷粗提物.峰1:Rg1;峰2:Re;峰3:Rf;峰4:F3;峰5:Rg2;峰6:Rd.Fig.1 High performance liquid chromatography-electrospray ionization-mass spectroscope profile of saponins from P.japonicus.

图2 竹节人参皂苷的化学结构式.R1,R2和R3见表1.Fig.2 Chemical structures of saponins from P.japonicus.
[M-H]-为人参皂苷-氢离子、[M+AcO]-为人参皂苷+醋酸根,即m/z 945,1005.5分别代表Re的945[M-H]-和 1005.5[M+AcO]-;在(-)-ESI/MS 二级质谱检测中,负离子CID产生系列脱糖碎片离子,m/z 945,799,783,637和475分别代表 Re的945[M-H]-,799[M-Rha-H]-,783[M-Glc-H]-,637[M-Glc-Rha-H]-和 475 [M-2Glc-Rha-H]。
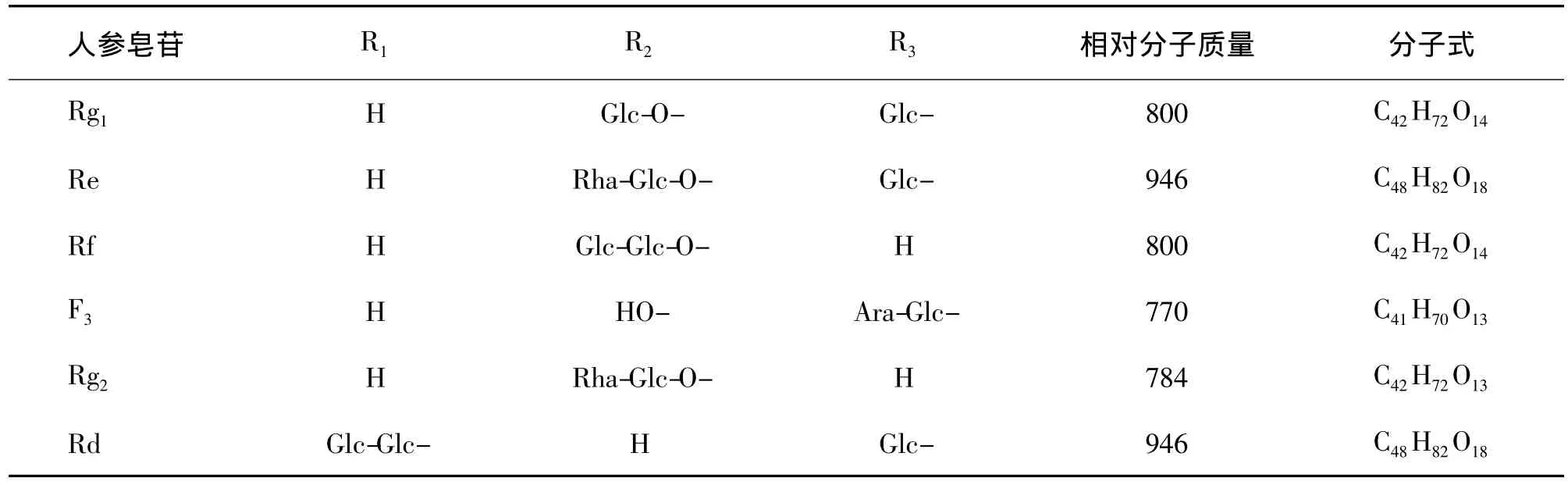
表1 竹节人参皂苷结构式基团Tab.1 Structural information on saponins from P.japonicus

表2 电喷雾电离-质谱(ESI-MS)和碰撞诱导解离(CID)竹节人参皂苷分析结构Tab.2 Electrospray ionization-mass spectroscope(ESI-MS)and corresponding collision induced dissociation(CID)data in the negative ion mode of saponins from P.japonicus
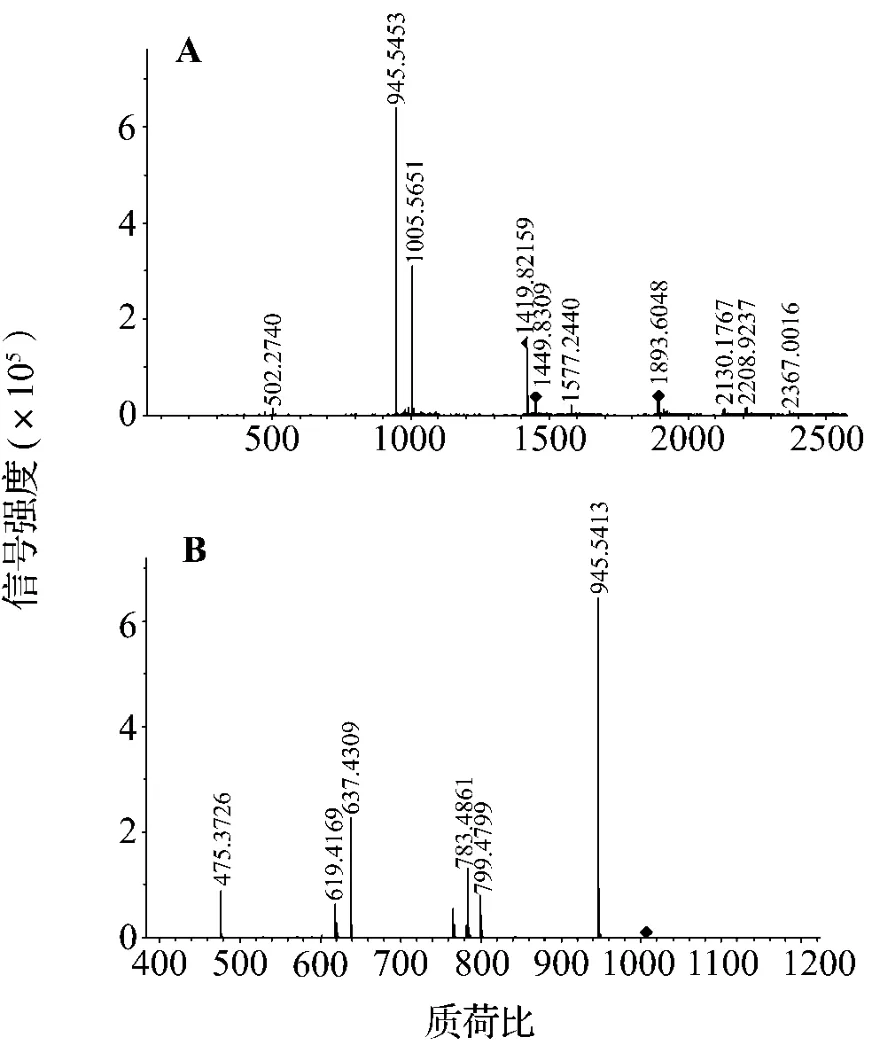
图3 人参皂苷Re ESI-MS图谱(A)和CID图谱(B).Fig.3 ESI-MS spectrum(A)and CID spectrum(B)of saponin Re from P.japonicus obtained in the negative ion mode.
2.2 竹节人参皂苷对正常人胚肝细胞L-O2增殖的影响
由图4可知,不同竹节人参皂苷单体与细胞L-O2共孵育48 h,其对正常L-O2细胞增殖的影响明显不同,其中Rg1和Re表现出明显的促肝细胞L-O2增殖的作用(P <0.05,P <0.01);Rf浓度在0.16 ~0.64 g·L-1时具有促肝细胞 L-O2 增殖的作用,其中 Rf 0.64 g·L-1组细胞增殖率达 28.5%(P<0.01),但随着浓度的升高则表现出一定的抑制作用(P <0.05);Rd在浓度高于0.16 g·L-1时,具有明显的抑制肝细胞L-O2增殖的作用,Rd 0.16 g·L-1时抑制率高达 49.7%(P < 0.01);F3> 0.64 g·L-1时则显著抑制细胞 L-O2 生长(P < 0.01),F30.64 g·L-1时抑制率达 31.1%;Rg20.16 ~ 1.28 g·L-1对肝细胞 L-O2 则无明显作用。

图4 竹节人参皂苷对正常人胚肝细胞L-O2增殖的影响.于对数生长期的人胚肝细胞分别加入不同浓度的人参皂苷,正常对照孔加入等量含0.1%DMSO的无血清培养液,培养48 h后用MTT法测定A570 nm.±s,n=8.*P<0.05,**P<0.01,与正常对照组(0)比较.Fig.4 Effect of saponins from P.japonicus on normal L-O2 cells.
2.3 竹节人参皂苷对乙醇损伤肝细胞的保护作用
当乙醇浓度较低时(<50 mmol·L-1),其对肝细胞L-O2并不表现出抑制作用,相反可以促进细胞增殖,可能是由于细胞L-O2以乙醇作为能量从而加速了细胞增殖;随着浓度的不断升高,乙醇对细胞L-O2表现出明显的抑制作用,其IC50约为200 mmol·L-1(图 5)。因此,本研究采用乙醇 200 mmol·L-1制备乙醇损伤细胞模型。

图5 乙醇对人胚肝细胞L-O2的损伤.于对数生长期的人胚肝细胞分别加入乙醇50~1600 mmol·L-1,培养48 h.±s,n=8.Fig.5 Injury to L-O2 cells induced by ethanol.

图6 竹节人参皂苷对乙醇损伤肝细胞L-O2的保护作用.于对数生长期的人胚肝细胞分别加入乙醇溶液终浓度为200 mmol·L-1,同时分别加入终浓度为0.16~1.28 g·L-1竹节人参皂苷,培养48 h后用MTT法测定 A570 nm.± s,n=8.**P <0.01,与正常对照组比较;#P <0.05,##P <0.01,与乙醇损伤模型组(0)比较.Fig.6 Protective effect of saponins from P.japonicus against ethanol-induced cytotoxicity on L-O2 cells.
由图6可知,不同竹节人参皂苷单体对乙醇损伤肝细胞 L-O2的作用不同,其中在 Rg1和 F30.16 g·L-1时可显著降低乙醇对细胞 L-O2的损伤(P<0.01),但随浓度的增加其保护作用逐渐降低;Rf <0.64 g·L-1时对乙醇损伤肝细胞L-O2的保护作用逐渐增大,但 Rf>0.64 g·L-1时则表现出明显的毒性作用(P <0.01);Re 0.16 ~1.28 g·L-1可减轻乙醇对肝细胞L-O2的抑制,对乙醇损伤肝细胞L-O2具有明显的保护作用(P<0.01);Rg2对乙醇损伤肝细胞L-O2无明显影响;Rd则可增强乙醇对肝细胞 L-O2的损伤(P <0.01),Rd浓度 >0.32 g·L-1时,可使细胞 L-O2 几乎全部死亡。
2.4 竹节人参皂苷Rg1,Rf和Re对肝细胞L-O2内液MDA含量、SOD和GSH-Px活性的影响
根据上述结果筛选出对乙醇损伤肝细胞具有一定保护作用的竹节人参皂苷Rg1,Rf和Re,进一步测定其对肝细胞 L-O2 MDA含量、SOD和 GSH-Px活性的影响,发现 Rg10.16 g·L-1,Re 1.28 g·L-1和 Rf 0.64 g·L-1具有明显的抗氧化作用,能够清除肝细胞内乙醇代谢产生的 MDA,增加 SOD和GSH-Px的活性(表5)。
3 讨论
肝脏作为体内乙醇代谢的最主要器官,主要通过乙醇脱氢酶和微粒体乙醇氧化酶系统进行氧化代谢。乙醇在肝细胞内通过细胞色素P450CYP2E1在铁离子参与下氧化成为乙醛,同时产生大量的氧应激产物如OH-,O2÷和H2O2等自由基,这些自由基可激活磷脂酶及脂质过氧化反应来降低膜磷脂,改变其通透性和流动性,从而改变与膜结合的酶、受体和离子通道的微环境,影响其功能[7-9]。本研究发现,乙醇与人胚肝细胞L-O2共孵育,当乙醇的浓度较低时(<50 mmol·L-1),其对 L-O2 细胞存活并不表现出抑制作用,相反可以促进细胞增殖,这可能是由于L-O2细胞以乙醇作为能量从而加速了细胞增殖;随着乙醇浓度的不断升高,乙醇对 L-O2细胞存活表现出明显的抑制作用,推测乙醇可能在代谢过程中产生了大量的氧应激产物,从而影响了细胞的生长和增殖。
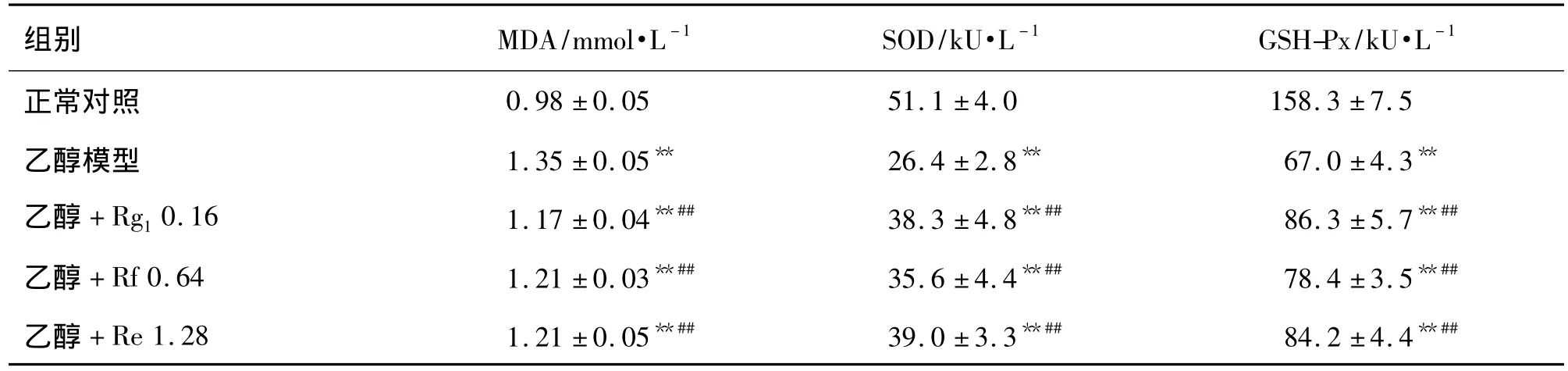
表5 竹节人参皂苷Rg1,Rf和Re对肝细胞L-O2内丙二醛(MDA)水平和超氧化物歧化酶(SOD),谷胱甘肽过氧化物酶(GSH-Px)活性的影响Tab.5 Effect of saponins Rg1,Rf and Re from P.japonicus on the malondialdehyde(MDA)level,superoxide dismutase(SOD)and glutathione peroxidase(GSH-Px)activities in ethanol-induced hepatic cells L-O2
有研究表明,一定剂量的竹节参总皂苷可显著提高运动后小鼠肝脏和脑组织中SOD和GSH活性,降低MDA含量,能直接清除自由基,并抑制脂质过氧化作用,表明竹节人参总皂苷能促进机体内源性抗氧化物质的产生,抑制MDA生成,是具有开发价值的天然抗氧化产物[10]。刘红等[11-13]通过脂质过氧化产物含量、MDA含量、前列腺素E2含量、SOD活性、GSH-Px活性和乳酸脱氢酶活性等指标测定,发现竹节人参提取物能通过消除和抑制大、小鼠体内氧自由基的产生,提高组织的抗氧化能力,对胃、脑和心肌等组织器官缺血再灌注损伤起到保护作用。
本研究应用HPLC-ELSD从竹节人参总皂苷分离纯化获得了6个人参皂苷单体,应用ESI-MS鉴定其为 Rg1,Re,Rf,F3,Rg2和 Rd;通过不同竹节人参皂苷单体与正常肝细胞L-O2共孵育48 h,测定发现竹节人参皂苷单体Rg1和Re表现出明显的促进L-O2 细胞增殖的作用;Rf <0.64 g·L-1时具有促进肝细胞L-O2增殖的作用,随着浓度的增加表现出一定的毒性作用;在浓度 >0.16 g·L-1时,Rd 具有显著的抑制 L-O2细胞增殖的作用,且 Rd 0.16 g·L-1时抑制率高达49.7%;F3 在浓度高于 0.64 g·L-1时则显著抑制L-O2生长,抑制率达 43.3%;Rg20.16 ~1.28 g·L-1对肝细胞 L-O2 则无明显作用。同时研究发现,Re对乙醇损伤的L-O2细胞具有明显的保护作用;Rf<0.64 g·L-1时对乙醇损伤的L-O2 细胞具有明显的保护作用,但 Rf>0.64 g·L-1时则表现出明显的毒性作用;在 Rg1和 F30.16 g·L-1时可降低乙醇对肝细胞 L-O2损伤,但随着剂量增加则表现出一定的毒性;Rg2对乙醇损伤的肝细胞L-O2无明显保护作用,但亦未表现出明显的毒性作用;Rd则可加强乙醇对L-O2细胞的损伤,在浓度大于0.32 g·L-1时,可使 L-O2 细胞几乎全部死亡。分析肝细胞内液相关生化指标MDA,SOD和GSH-Px发现,Rg1,Rf和 Re具有明显的抗氧化性能,能够清除肝细胞内乙醇代谢产生的MDA,提高抗氧化酶SOD和GSH-Px的活性,这可能是其保护乙醇性L-O2细胞损伤的一个重要原因。不同人参皂苷单体对乙醇损伤肝细胞的保护作用有待进一步研究。
[1] 左 锐,袁 丁.竹节参化学成分和药理活性研究进展[J].时珍国医国药,2005,16(9):838-839,841.
[2] 马 玲,谭德福.竹节参的研究概况[J].时珍国医国药,2005,16(12):1306-1307.
[3] 钱丽娜,陈 平,李小莉,江 亮,詹 莎.鄂产竹节参总皂苷成分抗氧化活性研究[J].武汉植物学研究,2008,26(6):674-676.
[4] 李有贵,徐 刚,陈 诗,钟 石,计东风.竹节人参对小鼠乙醇性胃黏膜损伤的保护作用[J].中国中药杂志,2007,32(21):2282-2285.
[5] Li YG,Ji DF,Zhong S,Shi LG,Hu GY,Chen S.Saponins from Panax japonicus protect against alcoholinduced hepatic injury in mice by up-regulating the expression of GPX3,SOD1 and SOD3[J].Alcohol Alcohol,2010,45(4):320-331.
[6] 向东山,翟 琨.竹节人参中总皂苷提取工艺研究[J].中国中药杂志,2008,33(16):2053-2056.
[7] Nordmann R,Ribière C,Rouach H.Implication of free radical mechanisms in ethanol-induced cellular injury[J].Free Radic Biol Med,1992,12(3):219-240.
[8] Díaz Gómez MI,Castro GD,de Layño AM,Costantini MH,Castro JA.Cytochrome P450 reductase-mediated anaerobic biotransformation of ethanol to 1-hydroxyethylfree radicals and acetaldehyde[J].Toxicology,2000,154(1-3):113-122.
[9] Albano E.Free radical mechanisms in immune reactions associated with alcoholic liver disease[J].Free Radic Biol Med,2002,32(2):110-114.
[10] Ali MB,Yu KW,Hahn EJ,Paek KY.Differential responses of anti-oxidants enzymes,lipoxygenase activity,ascorbate content and the production of saponins in tissue cultured root of mountain Panax ginseng C.A.Mayer and Panax quinquefolium L.in bioreactor subjected to methyl jasmonate stress[J].Plant Sci,2005,169(1):83-92.
[11] 刘家兰,李德清,刘 红.竹节人参提取物对实验性心肌缺血的保护作用[J].湖北民族学院学报(医学版),1999,16(1):6-8.
[12] 刘 红.竹节人参提取物对胃缺血再灌注损伤的防护[J].湖北民族学院学报(医学版),2002,19(2):1-3.
[13] 刘家兰,李德清,段先宇.竹节人参提取物对大鼠和小鼠脑缺血再灌注损伤的保护作用[J].湖北民族学院学报(医学版),2002,19(1):35-36,41.志谢:本课题中竹节人参皂苷分离和质谱析得到华东师
