在Sf9昆虫细胞-杆状病毒系统中表达毒蕈碱型M2及M5受体重组突变体
2011-05-14孙洪良郑建全王丽韫
牟 男,孙洪良,郑建全,王丽韫
(军事医学科学院毒物药物研究所军事毒理及生化药理室,北京 100850)
毒蕈碱(muscarine,M)型乙酰胆碱受体属于A类G蛋白耦联受体家族,具有7次跨膜结构,包括M1~M55种亚型,广泛分布于外周和中枢神经系统,参与多种生理功能的调控,包括血压、心率以及认知和记忆等复杂的生理活动。多年来,尽管M受体作为药物研究的一个重要靶标在重大疾病研究领域中的意义已为大家所认同[1-4],但5种受体亚型分布各异且功能各不相同,而且激动剂结合位点结构高度保守,导致M受体药物的亚型选择性差,临床上用药易出现明显的不良反应,导致作用于M受体系统的药物尤其亚型选择性新药的研究进展缓慢[5-6]。近来的研究表明,M 受体具有变构调节特性,变构调节是指变构调节剂激活变构位点(功能位点以外的特异性结合位点),通过易化(正性调节)或抑制(负性调节)受体功能位点的空间结构,起到调节其生物学功能的作用。M受体的5种受体亚型都存在着变构调节机制,这提示变构调位点低保守性可能是开发具有M受体亚型选择药物一个新的研究途径。研究表明,在5种M受体亚型中,M2受体亚型对变构调节最为敏感,M5受体亚型最不敏感。因此,建立M2与M5嵌合表达受体将为变构调节剂及作用位点的研究奠定可靠的理论基础[7-9]。本研究以 M2和 M5为靶标,分别构建 M2及M5受体亚型的突变重组体,旨在为M受体亚型特异性的变构调节剂及基因工程的研究提供一个理想的平台。
杆状病毒表达系统是近年应用广泛的真核表达系统,它具有真核表达系统的翻译后加工功能、表达水平高、蛋白产物有天然蛋白特性以及能同时表达多个外源基因等特点[10-11],同时该表达系统还能提供大量的蛋白,能够满足蛋白结构和高通量药物筛选等新方法技术研究的需求。本研究拟建立M2和M5受体亚型的突变表达株、点突变细胞株及M受体亚型相应结构域的蛋白表达系统(杆状病毒/Sf9昆虫细胞表达系统),为亚型选择型变构调节剂的研究提供技术平台。
1 材料与方法
1.1 试剂
质粒、菌株及细胞 E.coli DH5α,JM109和M2/M5-pcDNA3.1+DNA购自美国 Guthrie cDNA Resource Center,Sf9细胞购自中国医学科学院协和医科大学,DNA纯化试剂盒Wizard Plus SV Minipreps DNA Purification System,转染试剂 Cellfectin Invitrogen,限制性内切酶均购自日本TaKaRa公司。Bluo-gal IPTG,GIBCO Grace昆虫培养基,Bac-to-Bac®杆状病毒表达系统,GIBCO胎牛血清,sf-900ⅡSFM昆虫培养基购自美国Invitrogen公司。[3H]N-甲基-东莨菪碱(N-methyl-[3H]scopolamine,[3H]NMS)购自英国Amersham公司。
1.2 M2和M5受体重组基因的构建
1.2.1 M2和M5受体重组基因突变设计原则
根据参考文献[12]将野生M2型及M5受体进行以下突变,突变设计如下:① 将N-糖基化位点Asp突变为Asn,以保证在表达后能获得结构均一的蛋白,因为异源表达可能导致在不同的部位发生糖基化而影响蛋白的结构。②为了避免重组受体在昆虫细胞-杆状病毒系统中被蛋白酶降解,删除了M受体的第3个细胞内环,这是G蛋白结合识别部位,对于配体的识别部位没有影响,删除M2受体233~380氨基酸序列,删除M5受体246~431氨基酸序列。③为了方便表达后的检测以及纯化工作,在C端添加了凝血酶识别位点和6-组氨酸(6-histamine,6-His)标记,设计思路见图1。

图1 突变毒蕈碱(M)受体结构设计原则.A:N端糖基化位点Asp突变为Asn;B.删除M受体的第3个细胞内环;C.在C端添加了凝血酶识别位点和6-His标签.Fig.1 Mutation site designed in the muscarinic(M)receptor.
1.2.2 PCR突变过程及所用引物
使用M2/M5-pcDNA3.1+DNA为PCR模板,分为三步PCR:第一步使用两组引物1和引物2,引物3和引物4,引物1的序列将糖基化位点Asp突变成Asn,引物2由编码第5个跨膜区胞内部分序列和第6跨膜区胞内部分的核酸序列共同组成,引物3是其核苷酸序列与引物2序列完全互补,但5'端、3'端走向与之相反的正向引物,引物4为M2/M5羧基端序列。第二步以第一步的2个PCR产物为模板,使用引物1和引物4进行PCR,获得的产物为成功删除了第3个细胞内环的DNA序列;第三步PCR以第二步的产物为模板,使用引物1和引物5进行PCR,引物5加入了凝血酶切位点及6-His标签序列,具体过程见示意图2。获得具有突变序列的所有PCR产物均进行测序,测序工作均由北京博迈德生物有限公司完成。

图2 三步PCR法突变过程.步骤1:将糖基化位点Asp突变成Asn;步骤2:删除了第三个细胞内环的DNA序列;步骤3:加入了凝血酶切位点及6-His标签序列.Fig.2 Mutation performed by three-step PCR.
M2受体突变所用引物:正向引物P1:GCGAATTCATGGATGATTCAACAGATTCCTCTGATAATAGCCTGGCTC;反向引物P2:TGGTTCTGGGGCAAAGA-GGTGCCCTTTTCTTTCAGTGGTCCTGT;正向引物P3:ACCAAGACCCCGTTTCTCCACGGGAAAAGAAAGTCACCAGGACA;反向引物P4:TTGTATCCGCGATGTTCCGACCAAGGCGCACCATCACTAATGGTA;反向引物P5:CGCACCATCACTAATGGTAGTGGTAGTGGTAGTGTTAGATCTCG。M5受体突变所用引物:正向引物 P1:GCGAATTCATGGAAGGGGATTCTTACCACGATGCAACCACCGTCGATGGC;反向引物P2:CTCTCTTTGACTAGGACCACAGCTGGCTTTCTCTTCTCAG;正向引物P3:CTGAGAAGAGAAAGCCAGCTGTGGTCCTAGTCAAAGAGAG;反向引物P4:GTAATCACTACCACGCGGAACCAGGGGTAGCTTGCTGTTCCCCT;反向引物 P5:GCTCTAGATTAGTGATGGTGATGGTGATGGTAATCACTACCACGCGGAAC。
1.2.3 PCR 反应体系及条件
50 μl PCR 反应体系含有 1 μl DNA 模板,5 μl引物混合物(10 pmol·L-1),1 μl 10 ×PCR 缓冲液,1 μl dNTP(10 mmol·L-1),1 μl Taq 聚合酶(2.5 U),PCR反应参数为95℃变性5 min,94℃变性45 s,55℃退火 45 s,72℃45 s,30 ~35 循环,72℃ 延伸 7 min。样品在100 V电压条件下,上样于含有溴化乙锭500 mg·L-1的0.7%琼脂糖凝胶中电泳约90 min。
1.3 基因克隆质粒提取、酶切、连接、转化和克隆鉴定[13]
将目的DNA经特异性内切酶EcoRⅠ酶切后连接至pfastbac1质粒载体,转化DH10BacTM菌株,通过蓝白斑筛选挑取白斑,经培养、提取质粒。使用pUC/M13的扩增引物通过PCR的方法分析产物的长度来达到检验片段是否成功插入。
1.4 昆虫细胞的培养
在昆虫细胞培养基Sf-900Ⅱ,培养基中增加青霉素50 kU·L-1和链霉素 50 mg·L-1,在无 CO2的条件下,27℃生化培养箱中培养Sf9细胞。当Sf9细胞处于对数生长期时,使用Sf-900ⅡSFM无血清昆虫培养基继续培养,完全培养基浓度按80%,60%,40%,20%和0%驯化培养Sf9细胞,每个浓度至少培养细胞3代至稳定,直至完全适合Sf-900ⅡSFM的生长。
1.5 重组杆粒DNA转染Sf9细胞及收获重组杆状病毒
使用转染试剂盒,按说明书进行操作,即用线性化病毒DNA转染昆虫细胞Sf9,由于Sf9细胞的倍增时间是3 d,因此转染细胞应在细胞种植后的第3天进行。置27℃培养4~5 d,每天观察细胞病变并与正常细胞对照。从转染物中收获病毒时,上清通过离心澄清,用于滴定/扩增。连续感染传代,通过噬斑纯化得到重组病毒,并进一步用PCR进行鉴定。利用单细胞层培养物形成的空斑数量来确定杆状病毒上清的滴度,使用中性红凝胶染色计数空斑数量〔滴度(pfu/ml)=1/稀释倍数×空斑数×1/接种量(ml)〕。
1.6 表达产物的初步纯化及Western印迹法确定目的基因的表达
将收集转染72 h的昆虫细胞,及扩大培养的病毒上清,先干燥浓缩,然后用适当体积的Tris-HCl 20 mmol·L-1pH 7.5 稀释,过 QiagenNi-NTA Superflow Cartridge螯合柱进行亲和纯化,具体实验步骤参考试剂盒说明书。BSA法测定纯化的蛋白浓度,加入5×SDS电泳加样缓冲液后,100℃,煮沸5 min变性。12%SDS-PAGE进行蛋白电泳,抗6his-tag的鼠单抗(1∶2000),4℃过夜孵育,检测蛋白是否表达成功。
1.7 放射性配体受体结合实验分析重组受体的亲和活性
将转染72 h的昆虫细胞收集,加入Na+/K+PBS 5 mmol·L-1(Na2HPO44 mmol·L-1,KH2PO41 mmol·L-1,pH 7.4)制成匀浆,2000 × g 离心,膜蛋白重悬于 PB 缓冲液5 mmol·L-1,用 Lowry 等[14]法测定蛋白浓度后,进行[3H]NMS饱和实验,采用0.5 ml的反应体系,将蛋白匀浆 0.1 g·L-1(每管 20 μg)与[3H]NMS 0.05,0.1,0.125,0.5,1 和 2 nmol·L-1)混合,37℃孵育30 min;竞争性结合实验中,将蛋白匀浆(每管50 μg),37℃共同孵育30 min(均为复管,重复3 次)。用冰冷的缓冲液(Na+/K+PBS 50 mmol·L-1,pH 7.4)3 ml终止反应,用多孔细胞样品收集器经GF/C玻璃纤维滤纸抽滤,缓冲液冲洗3次,晾干后置于闪烁杯中,加入闪烁液3 ml,放置过夜,液闪计数仪(效率为40% ~50%)进行计数。
1.8 统计学分析
2 结果
2.1 M2及M5受体重组基因扩增产物鉴定
搭桥PCR结果表明,成功扩增出M2受体亚型核酸序列起始密码子至第3个细胞内端之间核酸序列及第六跨膜区至终止密码子之间序列共长1018 bp的重组M2受体核酸序列(图3)。以及M5受体亚型核酸序列起始密码子至第3个胞内环之间核酸序列及第六跨膜区至终止密码子间序列共长期实践1041 bp重组M5受体核酸序列(图4)。

图3 搭桥PCR法扩增野生型M2基因片段.M:DNA标志物;条带1:重组M2受体全长序列(1018 bp);条带2:启动子与第3个胞内环序列(731 bp);条带3:第6个跨膜区与终止密码子间序列 (287 bp).Fig.3 Amplification of recombinant gene fragments of wild M2receptor by overlap PCR.
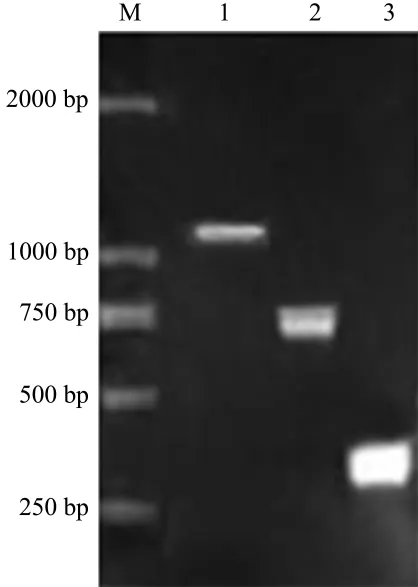
图4 搭桥PCR法扩增野生型重组M5受体基因片段.M:DNA标志物;条带1:重组M5受体全长序列(1018 bp);条带2:启动密码子与第3个胞内环序列(738 bp);条带3:第6个跨膜区与终止密码子间序列(303 bp).Fig.4 Amplification of recombinant gene fragments of wild M5by overlap PCR.
2.2 M2/M5重组转移载体的构建
将PCR扩增产物和pfastbac1质粒使用EcoRⅠ/XbaⅠ酶切后回收片段,随后进行连接,然后再将重组载体扩增,通过质粒抽提获得两个重组的pfastbac1质粒,质粒示意图见图5A,转化DH10BacTM菌株,通过蓝白斑筛选挑取白斑,经培养、提取质粒。由于杆状病毒基因组DNA>135 kb,使用pUC/M13的扩增引物通过PCR的方法分析产物的长度来达到检验片段是否成功插入的方法。基因组DNA本身的attTn7靶位之间的序列只有约为300 bp,因此成功的插入将会使对attTn7靶位之间的PCR产物增大,M2和M5的PCR产物应分布为1318 bp和1341 bp的基因片段,为此设计两条引物用来扩增 attTn7靶位之间的片段:正向引物,GTTTTCCCAGTCACGAC;反向引物,CAGGAAACAGCTATGAC。PCR结果证实插入片段方向及与载体大小均正确。这表明重组转移载体,即M2/M5重组转移载体的构建成功(图5B)。
2.3 转染前细胞无血清培养驯化及条件优化对细胞增殖的影响

图5 pfastbac1/M2(M5)重组质粒图谱(A)及琼脂糖凝胶电泳分析(B).条带1:重组M2基因片段;条带2:重组M5基因片段;条带3:空白对照组.Fig.5 Map of recombinant plasmid pfastbac1/M2(M5)(A)and agarose gel electrophoresis(B).
为了使细胞适合悬浮培养及不影响胞外分泌蛋白的表达和纯化工作,对Sf9细胞需要进行无血清驯化培养,本实验按照80%,60%,40%,20%和0%依次递减Sf-900ⅡSFM完全培养基中血清浓度,每个浓度至少驯化培养细胞3代至稳定,图6显示为在血清浓度分别为80%,40%,20%和0%驯化培养条件下,细胞增殖周期的变化,横坐标为驯化培养Sf9细胞生长时间段,纵坐标对应时间段细胞数目。从图中可以看出,血清刚开始递减,在含血清80%,40%培养条件下,细胞生长明显减慢,培养96 h后进入增殖期,当Sf9细胞完全适合了无血清Sf-900ⅡSFM的培养条件后,在同样接种密度条件下,细胞在生长至72 h进入增殖期,而且继续培养150~160 h,单位体积内细胞数量显著增加(7~8)×1011L-1,而刚开始接受驯化的细胞(80%或40%),受血清浓度的影响大,最大细胞密度仅为3×108L-1(n=3,P <0.01)。
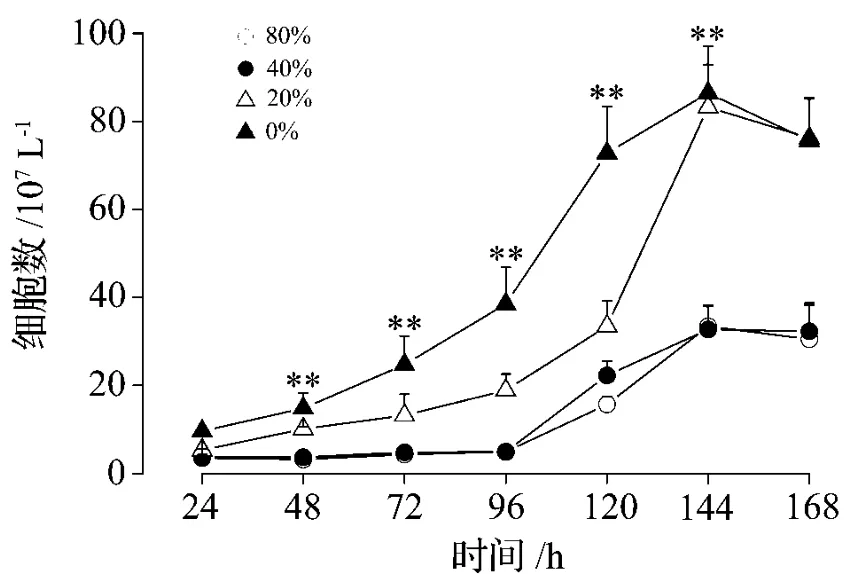
图6 昆虫Sf9细胞在不同血清浓度中的驯化培养.锥虫(台盼)蓝染色确定细胞活性.±s,n=3.**P<0.01,与含80%血清组比较.Fig.6 Domesticated cultivation of Sf9 cell in the medium with different concentrations of serum.
2.4 M2及M5重组杆状病毒的获得
重组载体质粒与线性化病毒DNA共转染昆虫细胞Sf9,经噬斑筛选和数代培养,得到重组杆状病毒。将其感染昆虫细胞后可见细胞病变(图7A),而正常对照细胞则无这种变化(图7B)。
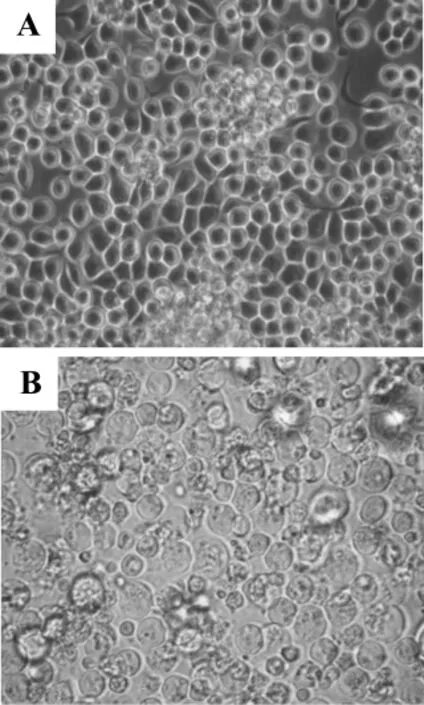
图7 转染重组M2/M5病毒颗粒后Sf9细胞形态学变化.A:正常昆虫Sf9细胞;B:转染重组M2/M5病毒颗粒后sf9细胞.Fig.7 Morphologic changes of Sf9 with or without transfection with recombinant M2/M5virus-like particles.
2.5 M2及M5重组蛋白的表达
重组杆状病毒感染昆虫细胞72 h后,过QiagenNi-NTA Superflow Cartridge螯合柱进行亲和纯化,获得重组M2/M5蛋白。经Western印迹分析,在相对分子质量为(3.5~3.8)×103处出现蛋白带(图8)。经蛋白定量测得昆虫细胞表达的目的蛋白量约为10 g·L-1培养上清,回收率可达1/3~1/2(3 ~5 g·L-1培养液)。

图8 Western印迹法检定Sf9细胞中M2和M5受体表达.条带1:重组M2受体(319氨基酸);条带2:重组M5受体(347氨基酸);条带3:空载体转染对照组.Fig.8 Expression of recombinant of M2and M5receptor in Sf9 cell detected by Western blotting.
2.6 表达的M2及M5重组蛋白受体的亲和力
图9结果表明,重组表达的M2及M5受体蛋白20 μg与[3H]NMS共同孵育,结合计数表明该均重组表达的M2及M5受体蛋白与[3H]NMS具有特异性的结合能力,增加[3H]NMS的浓度,特异性结合增加,存在着明显的量效关系,表明该M2/M5重组受体蛋白具有M受体功能位点的特异性结构特征。而空载体感染对照组粗提膜蛋白没有与[3H]NMS的特异性结合,提示本实验利用sf9昆虫细胞-杆状病毒表达系统成功表达了M2/M5受体蛋白质。

图9 放射性配体受体饱和实验分析[3H]N-甲基-东莨菪碱([3H]NMS)与Sf9细胞构建表达的M2和M5受体的亲和力.转染72 h的Sf9细胞,制备膜蛋白,每管含蛋白20 μg,与[3H]NMS,37℃共同孵育30 min.放射液闪计数测定受体与[3H]NMS的结合.±s,n=3.Fig.9 Binding affinity of[3H]N-methyl[3H]scopolamine([3H]NMS)to recombinant M2and M5muscarinic receptors expressed on Sf9 cell.
3 讨论
本研究根据M受体存在变构调节机制,变构位点低保守,利用Sf9-杆状病毒作为表达体系,使用分子生物学技术建立用于M受体变构调节剂研究的平台。根据参考文献[12],M受体的功能位点位于跨膜区,而变构位点位于功能位点的入口处,与其毗邻,主要在细胞外侧面的三个细胞外环,为减少影响表达的其他因素,本研究在克隆M2和M5受体亚型基因时,通过RT-PCR方法分别将人野生型M2,M5基因成功作如下突变:①将N-糖基化位点Asp突变为Asn;② 删除了M2受体233~380氨基酸序列,M5受体246~431氨基酸序列被删除;③ 两个受体亚型C端添加了凝血酶识别位点(CMV)和6-His标签。通过搭桥PCR的方法,采用具有互补末端的搭桥引物,使PCR产物形成了重叠链,从而在随后的扩增反应中通过重叠链的延伸,将M受体不同来源的扩增片段拼接起来,获得我们需要的全序列目的基因片段,进而建立了适合在Sf9-杆状病毒表达系统表达的M2/M5的重组野生型载体Bacmid,并转染Sf9细胞使蛋白得以表达,建立M受体野生型杆状病毒/Sf9昆虫表达系统。
具体操作时,最关键的步骤是重组病毒的筛选,本研究发现经过蓝白筛选后的重组病毒,尚存在假阳性的可能,为了进一步确证外源基因的重组,本研究运用PCR方法分析重组Bacmid基因组,证明确已获得插有目的基因片段的重组病毒。将重组杆状病毒感染昆虫细胞72 h后可见细胞明显变大变圆,而正常对照细胞则无这种变化。采用亲和层析/凝胶色谱层析等方法提取纯化蛋白,将纯化蛋白进行电泳分析证明M2/M5野生突变基因经过重组并在昆虫细胞中获得了表达。经蛋白定量测得昆虫细胞表达目的蛋白的量约为10 g·L-1培养上清,回收率3~5 g·L-1培养液。但这种昆虫细胞能否对M2和M5的受体前肽分子进行正确加工剪切,并形成具有成熟空间结构的受体形式还不清楚。为此,选用M受体非特异性拮抗剂[3H]NMS作为标记配体,经放射性配体受体结合实验,分析表达受体与[3H]NMS的结合能力,确定野生突变重组表达蛋白的特异性结合特征,结果表明该系统表达的两种受体蛋白均具有与[3H]NMS特异性的亲和性,特异性结合随着标记配体浓度增加而增加,进一步证明该突变的野生型M受体在昆虫细胞表达体系中正确表达,为后续研究建立突变重组受体、点突变受体,探讨作用于M受体的新型变构调节剂的构效机制奠定基础。
本研究成功构建了M2及M5受体亚型野生突变重组杆状病毒表达系统,为进一步构建M2/M5嵌插受体亚型野生突变重组杆状病毒表达系统和有关作用于M受体变构位点药物的筛选及机制研究建立药物平台。
[1] Wess J. Novelinsightsinto muscarinic acetylcholine receptor function using gene targeting technology[J].Trens Pharmacol Sci,2003,24(8):414-420.
[2] Hulme EC,Birdsall NJ,Buckley NJ.Muscarinic receptor subtypes[J].Annu Rev Pharmacol Toxicol,1990,30:633-673.
[3] Volpicelli LA,Levey AI.Muscarinic acetylcholine receptor subtypes in cerebral cortex and hippocampus[J].Prog Brain Res,2004,145:59-66.
[4] Nakamura T, Matsui M, Uchida K, Futatsugi A,Kusakawa S,Matsumoto N,et al.M(3)muscarinic acetylcholine receptor plays a critical role in parasympathetic control of salivation in mice[J].J Physiol,2004,558(Pt 2):561-575.
[5] Bonner TI,Buckley NJ,Young AC,Brann MR.Identification of a family of muscarinic acetylcholine receptor genes[J].Science,1987,237(4814):527-532.
[6] Sprang SR.G protein mechanisms:insights from structural analysis[J].Annu Rev Biochem,1997,66:639-678.
[7] Soudijn W,van Wijngaarden I,IJzerman AP.Allosteric modulation of G protein-coupled receptors[J].Curr Opin Drug Discov Dev,2002,5(5):749-755.
[8] Christopoulos A.Allosteric binding sites on cell-surface receptors:novel targets for drug discovery[J].Nat Rev Drug Discov,2002,1(3):198-210.
[9] Christopoulos A,Kenakin T.G protein-coupled receptor allosterism and complexing[J].Pharmacol Rev,2002,54(2):323-374.
[10] Kidd IM,Emery VC.The use of baculoviruses as expression vectors[J].Appl Biochem Biotechnol,1993,42(2-3):137-159.
[11] Wang H, Guo ZD, Li Z, Liu HR.Effects of various muscarinic ligands on M2AChR-Gi1alpha fusion protein expressed in Sf9 insect cells[J].Acta Pharmacol Sin,2002,23(3):230-236.
[12] Furukawa H,Hamada T,Hayashi MK,Haga T,Muto Y,Hirota H,et al.Conformation of ligands bound to the muscarinic acetylcholine receptor[J].Mol Pharmacol,2002,62(4):778-787.
[13] Awsubel FM,Brent R,Kingston RE,Moore DD,Seidman JG,Smith JA,等.颜子颖,王海林,译.精编分子生物学实验指南[M].北京:科学出版社,1998:253-271.
[14] Lowry OH,Rosebrough NJ,Farr AL,Randall RJ.Protein measurement with the Folin phenol reagent[J].J Biol Chem,1951,193(1):265-275.
