雌激素预处理增强肝缺血再灌注损伤大鼠雌激素受体表达
2011-05-14胡礼宏韩新生郭建荣
胡礼宏,韩新生,郭建荣
(1.宁波大学医学院附属李惠利医院麻醉科,浙江宁波 315040;2.西安交通大学医学院附属第二医院麻醉科,陕西西安 710004)
研究显示雌激素对心、脑等器官的缺血再灌注损伤(ischemia/reperfusion injury,I/R)均具有保护作用。其机制涉及雌激素抑制核因子κB(NF-κB)表达,促进还原型氧化氮合酶表达,减轻细胞凋亡,抗自由基,抗氧化等等[1-2]。近来研究发现,肝I/R后雌性动物的存活率明显要高于雄性动物,并发现雌激素对肝I/R损伤具有保护作用,可能是通过降低血清肿瘤坏死因子 α(tumor necrosis factor-α,TNF-α)水平,抑制肝组织NF-κB表达来实现的[3-5]。研究发现,肝中存在雌激素受体(estrogen receptor,ER),但是未见有关ER在肝I/R损伤中相关作用的报道。本研究拟用雄性大鼠肝I/R损伤模型观察雌激素预处理后ER的表达情况。
1 材料与方法
1.1 试剂
17-β-雌二醇(17-beta-estrogen),批号:20080150,购自美国Sigma公司;TNF-α试剂盒购自上海森雄科技实业有限公司,NF-κB p65、ERα 试剂盒、DAB和SABC试剂盒购自武汉博士德公司。
1.2 动物及模型制备
1.3 动物分组
90只大鼠随机分成3组,每组30只。假手术组仅行麻醉、开腹、分离肝门、关腹,术前1 h大鼠ip给予等量生理盐水。I/R组,肝缺血前1 h大鼠ip给予等量生理盐水;雌激素预处理+I/R组,在肝缺血前1 h大鼠ip给予雌二醇4 mg·kg-1。分别于肝缺血前(R0)、再灌注1 h(R1),R3,R6和R24时间点进行标本检测,每个时间点6只大鼠。
1.4 血清谷丙转氨酶(alanine aminotransferase,ALT)及TNF-α水平检测和肝组织形态观察
分别在各时间点沿着大鼠剑突剪开胸腔,暴露心脏,右心室取4 ml血液,分装于Eppendorf导管中,室温下 1000×g离心 10 min分离出血清,-20℃保存待测。用全自动生化检测仪检测血清ALT水平,ELISA法测定血清TNF-α水平。同时取肝左中叶组织,用冰生理盐水冲洗后用10%甲醛溶液浸泡固定,制作石蜡切片,观察肝组织形态学变化。
1.5 SABC法检测肝组织NF-κB和ERα的表达
切片行多聚赖氨酸处理,采用SABC法检测肝组织NF-κB和ERα的表达情况。400倍显微镜下,细胞膜、细胞核和(或)细胞浆呈棕色视为阳性肝细胞。每张切片随机计数10个视野,观察阳性肝细胞数和总细胞数,计算阳性率(%)=阳性肝细胞数/总细胞数×100%。
1.6 统计学分析
2 结果
2.1 雌激素预处理对肝缺血再灌注损伤大鼠血清ALT及TNF-α水平的影响
表1及表2结果显示,肝I/R后,血清ALT及TNF-α水平明显升高。I/R后各个时间点,I/R和雌二醇+I/R组ALT及TNF-α水平明显高于缺血前,随着再灌注时间延长逐渐上升,于再灌注6 h达到高峰,到再灌注24 h时已显著下降。与假手术组相比,再灌注6 h时,I/R和雌二醇+I/R组ALT水平分别升高了11.7 倍和8.1 倍(P <0.01),TNF-α 水平分别升高了5.2倍和3.2倍(P <0.01)。组间同时间点比较,雌二醇+I/R组明显低于I/R组(P<0.05)。假手术组缺血前后各时间点的血清ALT及TNF-α水平无明显变化。
2.2 雌激素预处理对肝缺血再灌注损伤大鼠肝组织形态的影响
镜下可见假手术组各时间点肝组织变化无显著性差异。缺血前,假手术组、I/R组和雌二醇+I/R组无明显损伤。假手术组再灌6 h肝组织无改变(图1A),I/R组再灌注后,可见逐渐增多的肝细胞水肿和脂肪变性(图1B);再灌注6 h时除可见增多的细胞水肿外,还可见点状细胞坏死和嗜酸性变性;再灌注24 h时仍可见细胞水肿和脂肪变性(照片未提供),但点状细胞坏死和嗜酸性变性较再灌注6 h时有所减轻;雌二醇+I/R组再灌6 h变化趋势同I/R组(图1C),但各时间点的损伤程度明显轻于I/R组,未见点状坏死(照片未提供)。

表1 雌激素预处理对大鼠肝缺血再灌注(I/R)损伤血清谷丙转氨酶(ALT)水平的影响Tab.1 Effect of estrogen pretreatment on alanine aminotransferase(ALT)levels in rats with hepatic ischemia/reperfusion(I/R)injury

表2 雌激素预处理对肝I/R损伤大鼠血清肿瘤坏死因子(TNF-α)水平的影响Tab.2 Effect of estrogen pretreatment on TNF-α levels in rats with hepatic I/R injury

图1 雌激素预处理对肝I/R损伤大鼠肝组织形态变化(HE×400).A:假手术组再灌注6 h;B:I/R组再灌注6 h肝组织;C:雌二醇+I/R组再灌注6 h肝组织.Fig.1 Effect of estrogen pretreatment on the change of tissue in rats with hepatic I/R injury(HE ×400).
2.3 雌激素预处理对肝缺血再灌注损伤大鼠肝组织NF-κB表达的影响
表3及图2结果显示,在各组肝组织中均可见NF-κB不同程度的表达。假手术组各时间点NF-κB表达无显著性差异。在I/R组和雌二醇+I/R组随着再灌注时间的延长NF-κB表达程度越高,再灌注6 h最高,到再灌注24 h时已显著下降;与假手术组相比,再灌注6 h时I/R组和雌二醇+I/R组NF-κB表达分别升高了8.6倍和4.8倍(P<0.01);再灌注后同时间点比较,I/R组NF-κB的表达明显高于EI/R组(P<0.05),两组的表达水平明显高于假手术组(P <0.01)。
2.4 雌激素预处理后肝缺血再灌注损伤大鼠肝组织ERα表达的影响
显微镜下可见,各组肝细胞膜、细胞浆和细胞核均可见ERα不同程度的表达。假手术组各时间点肝组织ERα表达水平无显著性差异。I/R组和雌二醇+I/R组,随再灌注时间的延长肝组织ERα表达程度明显增强,至再灌注6 h时表达水平达高峰,至再灌注24 h时表达水平有所降低(P<0.01);再灌注6 h时I/R组和雌二醇+I/R组ERα表达水平分别升高了4.2倍和7.4倍;但组间各时间点比较,雌二醇+I/R组的ERα表达水平明显高于I/R组(P <0.05)(表4,图3)。

表3 雌激素预处理对I/R大鼠肝组织NF-κB p65表达的影响Tab.3 Effect of estrogen pretreatment on NF-κB p65 levels in rats with hepatic I/R injury
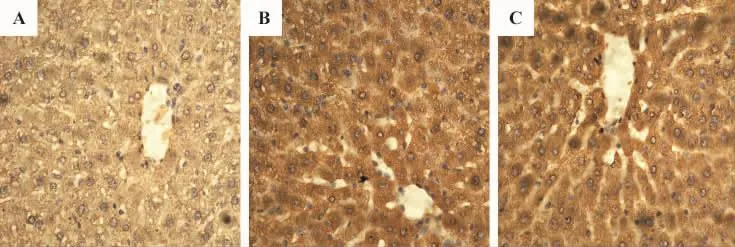
图2 雌激素预处理对肝I/R损伤大鼠肝组织NF-κB p65表达的影响(ABC×400).分组处理见表1.A:假手术组再灌注6 h;B:I/R组再灌注6 h;C:雌二醇+I/R组再灌注6 h.图中棕色颗粒为NF-κB p65表达.Fig.2 Effect of estrogen pretreatment on NF-κB p65 in rats with hepatic I/R injury(ABC ×400).

表4 雌激素预处理对肝I/R损伤大鼠肝组织雌激素受体α(ERα)表达的影响Tab.4 Effect of estrogen pretreatment on estrogen receptorα(ERα)levels in rats with hepatic I/R injury

图3 雌激素预处理对肝I/R损伤大鼠肝组织雌激素受体α(ERα)表达的影响 (ABC×400).A:假手术组再灌注6 h肝组织ERα表达;B:I/R组再灌注6 h肝组织ERα表达;C:雌二醇+I/R组再灌注6 h.图中棕色颗粒为ERα阳性表达.Fig.3 Effect of estrogen pretreatment on nuclear estrogen receptor α(ERα)levels in rats with hepatic I/R injury(ABC ×400).
3 讨论
肝I/R损伤在临床上比较常见,如肝肿瘤切除、肝移植、休克等等,是导致肝功能衰竭的重要原因,也是目前研究的热点问题。研究认为,肝I/R损伤的发生机制可能与肝无氧代谢,Ca2+超载,氧自由基损伤,线粒体受损,微循环功能障碍,各种细胞因子作用,Kupffer细胞和中性粒细胞活化、NF-κB的激活以及细胞凋亡等有关。
有研究报道,雌激素对脑、心等脏器I/R损伤具有保护作用[1-2]。Harada 等[3]研究发现,肝 I/R 损伤后雌鼠的存活率明显高于雄鼠,而且用雌二醇治疗的雄鼠肝细胞损害程度显著轻于对照组,提示雌激素对肝I/R损伤有保护作用。本研究结果显示,用雌激素预处理后,血清AST水平明显下降,肝细胞损伤程度明显减轻,这与已有的研究结论基本一致[4-5]。
ER是核受体超家族成员之一,主要位于胞浆和胞核内,具有转录因子的作用[7-10]。研究发现,细胞膜上也存在ER,介导非基因组信号途径[11-13]。ER主要分为ERα和ERβ两种亚型,肝细胞上存在ER,分布于细胞膜、细胞浆和细胞核,且主要以α亚型为主[14-15]。雌激素与ER结合后通过基因组和非基因效应发挥作用。故本实验通过研究α亚型来反映ER的表达情况。结果显示,肝细胞膜、细胞浆和细胞核上存在ER。肝I/R后肝组织ER表达升高,而雌激素预处理组ER的表达显著高于I/R组,肝损伤程度也明显减轻,说明雌激素预处理后刺激ER的高表达,能够减轻肝I/R损伤。
促炎症细胞因子TNF-α在肝ER损伤过程中起到重要作用如触发细胞凋亡,直接导致肝窦内皮细胞肿胀,导致肝微循环障碍;激活中性粒细胞释放氧自由基;刺激单核巨噬细胞和其他细胞分泌白细胞介素1(interleukin-1,IL-1),IL-6 等炎性因子。在本研究中,I/R组血浆TNF-α水平明显升高,而雌二醇+I/R组TNF-α活性明显低于I/R组。由此说明雌激素预处理后ER的高表达可以显著降低肝I/R导致的TNF-α升高。
肝I/R可引起缺血缺氧、氧化应激、Ca2+超载,中性粒细胞释放多种蛋白酶以及活性氧,Kupffer细胞活化等多种途径激活 NF-κB,NF-κB 激活后通过调节一系列基因的表达,如释放前炎症细胞因子TNF-α、IL-1、IL-6、细胞黏附分子-1、选择素等直接或间接地参与肝I/R损伤[16-17]。本研究结果显示,肝I/R后,肝组织NF-κB表达明显升高,雌激素预处理组明显低于I/R组,肝损伤也明显减轻,ER表达增加,说明ER的高表达与抑制NF-κB的表达和其下游的炎症细胞因子有关,进而减轻肝I/R损伤。
综上所述,雌激素预处理能刺激并增强ER的表达,进而减轻肝I/R损伤,其机制可能与抑制了NF-κB的表达和降低血清TNF-α水平有关。
[1] 孙 静,秦 勤,崔让庄,毛用敏,赵鸿铭,李国庆,等.雌激素对大鼠心肌缺血-再灌注及同型半胱氨酸损伤的保护作用[J].中国分子心脏病学杂志,2005,5(4):592-596.
[2] 李 军,娄季宇,张 磊.雌激素对大鼠脑缺血再灌注损伤脑组织NF-κB表达和细胞凋亡的影响[J].中国实用神经疾病杂志,2007,10(3):100-102.
[3] Harada H,Pavlick KP,Hines IN,Hoffman JM,Bharwani S,Gray L,et al.Selected contribution:effects of gender on reduced-size liver ischemia and reperfusion injury[J].J Appl Physiol,2001,91(6):2816-2822.
[4] 陶 平,卞建民,时开网,曹红勇,蔡永东,张 磊.17-β-雌二醇对大鼠肝脏缺血再灌注损伤的保护作用及其机制[J].中华肝胆外科杂志,2004,10(9):610-612.
[5] 朱少泽,鲍民生,赵 瑛.雌二醇对大鼠肝缺血再灌注损伤NOS表达的影响[J].山西医科大学学报,2006,37(10):998-1002.
[6] 严律男.现代肝移植学[M].北京:人民军医出版社,2004:1-8.
[7] Björnström L,Sjöberg M.Mechanisms of estrogen receptor signaling:convergence of genomic and nongenomic actions on target genes[J].Mol Endocrinol,2005,19(4):833-842.
[8] Razandi M,Alton G,Pedram A,Ghonshani S,Webb P,Levin ER.Identification of a structural determinant necessary for the localization and function of estrogen receptor alpha at the plasma membrane[J].Mol Cell Biol,2003,23(5):1633-1646.
[9] Pick H,Jankevics H,Vogel H.Distribution plasticity of the human estrogen receptor alpha in live cells:distinct imaging of consecutively expressed receptors[J].J Mol Biol,2007,374(5):1213-1223.
[10] Ahlbory-Dieker DL,Stride BD,Leder G,Schkoldow J,Trölenberg S,Seidel H,et al.DNA binding by estrogen receptor-alpha is essential for the transcriptional response to estrogen in the liver and the uterus[J].Mol Endocrinol,2009,23(10):1544-1555.
[11] Xu Y,Traystman RJ,Hurn PD,Wang MM.Membrane restraint of estrogen receptor alpha enhances estrogendependent nuclear localization and genomic function[J].Mol Endocrinol,2004,18(1):86-96.
[12] Razandi M,Pedram A,Merchenthaler I,Greene GL,Levin ER.Plasma membrane estrogen receptors exist and functions as dimers[J].Mol Endocrinol,2004,18(12):2854-2865.
[13] Savatier J,Jalaguier S,Ferguson ML,Cavaillès V,Royer CA.Estrogen receptor interactions and dynamics monitored in live cells by fluorescence cross-correlation spectroscopy[J]. Biochemistry, 2010, 49(4):772-781.
[14] Gao H,Fält S,Sandelin A,Gustafsson JA,Dahlman-Wright K.Genome-wide identification of estrogen receptor alpha-binding sites in mouse liver[J].Mol Endocrinol,2008,22(1):10-22.
[15] Wang HH,Afdhal NH,Wang DQ.Overexpression of estrogen receptor alpha increases hepatic cholesterogenesis,leading to biliary hypersecretion in mice[J].J Lipid Res,2006,47(4):778-786.
[16] Jaeschke H.Reperfusion injury after warm ischemia or cold storage of the liver:role of apoptotic cell death[J].Transplant Proc,2002,34(7):2656-2658.
[17] Kuboki S,Schuster R,Blanchard J,Pritts TA,Wong HR,Lentsch AB.Role of heat shock protein 70 in hepatic ischemia-reperfusion injury in mice[J].Am J Physiol Gastrointest Liver Physiol,2007,292(4):G1141-G1149.
