人类胎盘药物透过性实验的研究进展
2011-05-14孙谷韵
孙谷韵,吴 晖,张 峻
(昆明医学院第一附属医院临床药学中心,云南昆明 650032)
随着医疗技术的发展,影响胎儿在母体内生长发育的因素越来越受到关注。妊娠期间母体所接触到的很多物质都会对胎儿产生不利影响,比如受污染的空气、水、烟雾、乙醇(酒精)和药物等。母体和胎儿有着各自不相通的血液循环,两者之间通过胎盘完成营养物质、气体和代谢废物的交换,胎盘是外界物质进入胎儿体内的必经之路,有害物质能否透过胎盘或是如何透过胎盘影响到胎儿的生长发育的毒理学研究内容,本文综述了药物和环境污染物透过人类胎盘的进展。
1 人类胎盘透过性的相关影响因素
在胎儿发育期内,胎盘在物质交换和对妊娠的调节等方面发挥了重要作用。胎儿发育所需的各种物质包括氧气、水、电解质、葡萄糖、激素和抗体都必须通过胎盘进行转运,而胎儿的代谢废物如二氧化碳和尿素等也是通过胎盘清除回母体。
影响物质胎盘透过性的因素有很多,包括物质的分子量大小、离子化程度、脂溶性和蛋白结合率;胎盘本身的功能、对物质的代谢能力;胎盘-胎儿循环和母体-胎儿循环的血流速度;代谢酶的生物转化以及母体和胎儿肝对物质的代谢等。如相对分子质量<600、非离子、脂溶性的大分子物质可以很容易透过胎盘屏障,其转运机制仅与母体及胎儿循环的血流速度相关。以前认为胎盘屏障是天然的屏障,可以抵挡一切有害物质侵袭胎儿,但随着研究的深入,逐渐认识到一些物质可以透过人类胎盘屏障并可能影响到胎儿的生长发育,包括用于临床治疗的药物,如地高辛和长春新碱等可以透过胎盘屏障并对胎儿有致畸作用[1]。胎儿暴露在孕妇所接触的各种因素中,那么这些能够对胎儿的生长发育产生影响的物质的胎盘透过性便成为研究的重点。
2 人类胎盘透过性的相关实验研究方法
2.1 体内胎盘透过性研究
体内胎盘透过性研究只能用于因怀孕前已患有某种疾病、医师必须权衡孕期用药治疗原发疾病的利弊,例如糖尿病和癫痫等。在获得患者知情同意后,临床医师选用能将药物对胎儿的影响降至最低的治疗计划,密切监测孕期内孕妇的各项生理变化并根据情况随时调整治疗方案,在分娩后对新生儿进行健康评估,总结和评价已用药物对胎儿的影响[2-3]。从理论上讲,这种研究方法可以得到关于药物胎盘透过性或药物致畸作用的准确数据,但这违背了医学伦理道德,在科研工作中是较难完成的。
2.2 体外胎盘灌注实验
2.2.1 体外胎盘灌注实验的方法和原理[4-6]
选取刚娩出的、完整的健康人胎盘,用灌流液将单个小叶中的血液冲洗干净后,模拟人体子宫内各种条件建立母体和胎儿的双侧闭合循环或是单侧开放循环。此灌注模型利用蠕动泵作为循环动力,通过不同比例的氧气和二氧化碳饱和灌流液、调节其酸碱度,保证灌流后胎盘组织的成活力和功能性。在该模型的建立过程中,确保胎盘的生物活性是进行药物透过性研究的关键,通过监测葡萄糖的消耗量和乳酸的生成量来判断胎盘是否具有生物活性,成功建立循环的标准需通过观察有无漏液、测定药物的透过率进行评价。灌注模型构建成功后,在母体侧灌流液中加入一定浓度的待测药物、化学物或是可以在体外合成的药物代谢产物,平衡一段时间后,从胎儿侧灌流液中抽取样本,根据所测物质的特性选择合适的方法进行检测,通过测出的物质浓度确定其胎盘透过性。
2.2.2 体外胎盘灌注实验的起源与发展
20世纪60年代Krantz首次研制了人胎盘体外灌注模型进行胎盘透过性研究,70年代Schneider等[7]在技术上进行了探索,只将某一独立胎盘小叶进行灌注并将胎盘托盘由筛形改为环形,这些改进不仅节省了实验材料,而且提高了研究结果的精密度,这次技术上的改进显示,灌注单个胎盘小叶得出的实验结果可以代表整个胎盘的渗透性。1983年,Brandes等[8]再次改进装置,将胎盘托盘的边缘加宽以使胎盘更易固定,减少了边缘组织发生撕裂的概率,并且没有将胎盘的胎儿面浸在灌流液中、以便观察在灌流时有无渗漏情况,这样又提高了模型正常运转的成功率,通过对葡萄糖、菊糖及安替比林胎盘透过性的研究总结了该模型用于药物胎盘透过性研究的可行性。通过这两次改进,人胎盘体外灌注模型的构建技术已较成熟,此后研究者们又进一步考察了灌流液成分和灌流液供氧情况可能对胎盘透过率的影响。Mathiesen等[9]通过研究指出,在利用体外胎盘循环进行脂溶性物质透过性实验时,应考虑到灌流液中的蛋白含量对透过率的影响。Bachmaier等[10]于2007年利用体外胎盘灌注模型首次从超微结构水平对胎盘组织灌注前后的形态学改变的观察结果显示,在胎盘灌注过程中,降低供氧量可引起胎盘绒毛结构的改变,从而导致安替比林的胎盘透过率显著降低。近年来,利用该模型对各类药物进行了胎盘透过性研究,发现还是有些药物能通过胎盘,对胎儿发育有一定的影响,如美沙酮,阿米替林和部分喹诺酮类药物(表1)。目前,人胎盘体外灌注模型不仅用于研究治疗药物对胎儿的暴露,还用于研究孕妇生活的环境因素对胎儿的影响,苯并芘是普遍存在于香烟、被污染的空气和一些食物中的高度致癌物,研究表明苯并芘具有胎盘透过性[12]。除了利用该模型进行物质透过性研究外,对胎盘组织本身变化的研究也是近几年医药相关学科的新进展,2009年,苏黎世大学医院与剑桥大学等多家机构联合再次利用纳米级聚乙烯珠对该模型在灌流不同时间后的胎盘组织改变进行了对比,结果显示,直径为240 nm的聚乙烯珠可被胎盘吸收且可透过胎盘屏障,但胎盘组织的生物活性和功能在灌流后没有改变,该模型可用于毒理学和药理学研究[21]。在国内,关于体外胎盘灌注模型的研究仍处在起步阶段,与发达国家之间存在一些差距,有很大的发展空间。
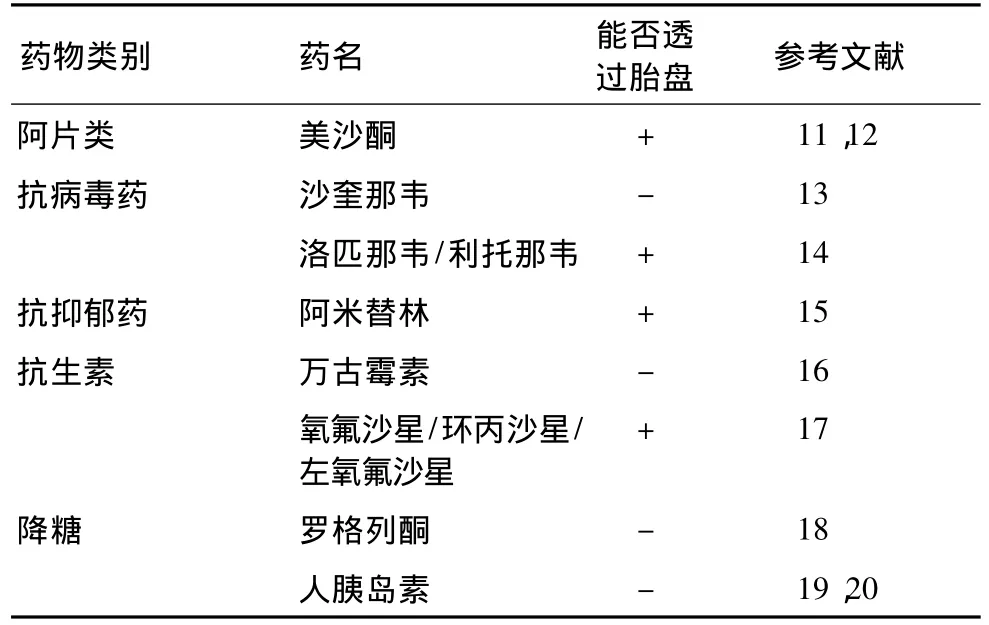
表1 利用人胎盘体外灌注模型研究药物胎盘透过性
2.2.3 体外胎盘灌注实验的优势与不足
人胎盘绒毛小叶体外灌注模型在发达国家已成为妊娠期物质胎盘透过性研究的重要方法,为一些孕妇在妊娠期内可能接触到的物质能否透过人体胎盘屏障、对胎儿有无致畸作用提供了最直接的证据。但其也存在一些不足与局限,如对妊娠早期用药的研究,因妊娠前3个月内胎盘未发育健全,无法通过该模型对妊娠早期的药物胎盘透过性进行评价,而且该实验方法只选用了健康人的妊娠晚期胎盘,没有对病理性胎盘的透过功能进行研究,在今后的研究中还要考虑这些相关因素,对物质的胎盘透过性及胎盘的代谢功能方面进行更深入的探索。
3 展望
胎儿在母体内会接触到各种外界物质并受之影响,这些因素对胎儿产生的影响是否有害则需要通过研究进行风险评估。体内和体外实验均可以帮助了解物质通过胎盘的转运和代谢机制,选用人体胎盘组织进行研究是很好的创新与发展。体外胎盘灌注模型发展至今已成为国际上公认的研究物质胎盘透过性的经典方法[22],其研究结果可以为胎儿所接触的物质风险评估提供重要信息,随着医药学、环境卫生学的不断发展,人胎盘体外灌注模型的应用将更加广泛。
[1] Garcia-Bournissen F,Feig DS,Koren G.Maternal-fetal transport of hypoglycaemic drugs[J].Clin Pharmacokinet,2003,42(4):303-313.
[2] Langer O,Conway DL,Berkus MD,Xenakis EM,Gonzales O.A comparison of glyburide and insulin in women with gestational diabetes mellitus[J].N Engl J Med,2000,343(16):1134-1138.
[3] Eadie MJ.Antiepileptic drugs as human teratogens[J].Expert Opin Drug Saf,2008,7(2):195-209.
[4] Nanovskaya TN,Patrikeeva S,Hemauer S,Fokina V,Mattison D,Hankins GD,et al.Effect of albumin on transplacental transfer and distribution of rosiglitazone and glyburide[J].J Matern Fetal Neonatal Med,2008,21(3):197-207.
[5] Kraemer J,Klein J,Lubetsky A,Koren G.Perfusion studies of glyburide transfer across the human placenta:implications for fetal safety[J].Am J Obstet Gynecol,2006,195(1):270-274.
[6] Johnson RF,Herman N,Arney TL,Gonzalez H,Johnson HV,Downing JW.Bupivacaine transfer across the human term placenta.A study using the dual perfused human placental model[J].Anesthesiology,1995,82(2):459-468.
[7] Schneider H,Panigel M,Dancis J.Transfer across the perfused human placenta of antipyrine,sodium and leucine[J].Am J Obstet Gynecol,1972,114(6):822-828.
[8] Brandes JM,Tavoloni N,Potter BJ,Sarkozi L,Shepard MD,Berk PD.A new recycling technique for human placental cotyledon perfusion:application to studies of the fetomaternal transfer of glucose,inulin,and antipyrine[J].Am J Obstet Gynecol,1983,146(7):800-806.
[9] Mathiesen L, Rytting E, Mose T, Knudsen LE.Transport of benzo[alpha]pyrene in the dually perfused human placenta perfusion model:effect of albumin in the perfusion medium[J].Basic Clin Pharmacol Toxicol,2009,105(3):181-187.
[10] Bachmaier N,Linnemann K,May K,Warzok R,Kuno S,Niemeyer M,et al.Ultrastructure of human placental tissue after 6 h of normoxic and hypoxic dual in vitro placental perfusion[J].Placenta,2007,28(8-9):861-867.
[11] Nekhayeva IA,Nanovskaya TN,Deshmukh SV,Zharikova OL,Hankins GD,Ahmed MS.Bidirectional transfer of methadone across human placenta[J].Biochem Pharmacol,2005,69(1):187-197.
[12] Malek A,Obrist C,Wenzinger S,von Mandach U.The impact of cocaine and heroin on the placental transfer of methadone[J].Reprod Biol Endocrinol,2009,7:61.
[13] Forestier F, de Renty P, Peytavin G, Dohin E,Farinotti R,Mandelbrot L.Maternal-fetal transfer of saquinavir studied in the ex vivo placental perfusion model[J].Am J Obstet Gynecol,2001,185(1):178-181.
[14] Gavard L,Gil S,Peytavin G,Ceccaldi PF,Ferreira C,Farinotti R,et al.Placental transfer of lopinavir/ritonavir in the ex vivo human cotyledon perfusion model[J].Am J Obstet Gynecol,2006,195(1):296-301.
[15] Heikkinen T,Ekblad U,Laine K.Transplacental transfer of amitriptyline and nortriptyline in isolated perfused human placenta[J].Psychopharmacology(Berl),2001,153(4):450-454.
[16] Hnat MD,Gainer J,Bawdon RE,Wendel GD Jr.Transplacental passage of vancomycin in the ex vivo human perfusion model[J].Infect Dis Obstet Gynecol,2004,12(2):57-61.
[17] Polachek H,Holcberg G,Sapir G,Tsadkin-Tamir M,Polachek J,Katz M,et al.Transfer of ciprofloxacin,ofloxacin and levofloxacin across the perfused human placenta in vitro[J].Eur J Obstet Gynecol Reprod Biol,2005,122(1):61-65.
[18] Holmes HJ,Casey BM,Bawdon RE.Placental transfer of rosiglitazone in the ex vivo human perfusion model[J].Am J Obstet Gynecol,2006,195(6):1715-1719.
[19] Boskovic R,Feig DS,Derewlany L,Knie B,Portnoi G,Koren G.Transfer of insulin lispro across the human placenta:in vitro perfusion studies[J].Diabetes Care,2003,26(5):1390-1394.
[20] Holcberg G,Tsadkin-Tamir M,Sapir O,Wiznizer A,Segal D,Polachek H,et al.Transfer of insulin lispro across the human placenta[J].Eur J Obstet Gynecol Reprod Biol,2004,115(1):117-118.
[21] Wick P,Malek A,Manser P,Meili D,Maeder-Althaus X,Diener L,et al.Barrier capacity of human placenta for nanosized materials[J].Environ Health Perspect,2010,118(3):432-436.
[22] Mose T,Kjaerstad MB,Mathiesen L,Nielsen JB,Edelfors S,Knudsen LE.Placental passage of benzoic acid,caffeine,and glyphosate in an ex vivo human perfusion system[J].J Toxicol Environ Health A,2008,71(15):984-991.
