卡络磺钠片的处方工艺研究
2011-04-09聂延君罗永煌田朋鑫刘艳玲
聂延君,罗永煌,田朋鑫,刘艳玲
(西南大学药学院,重庆 400715)
卡络磺钠(carbazochrome sodium sulfonate)是卡巴克洛的衍生物,最早由日本田边制药株式会社研制成功[1],水溶性较卡巴克洛强,具有良好的止血效果,是新一代的全身性止血药物。该药用于消化道、呼吸道、泌尿系统、妇产科等疾病的出血,还可用于外伤和手术出血的预防与治疗[2]。目前,日本该药的片剂、散剂和颗粒剂上市,其原料药收载于日本药局方ⅩⅤ版;在我国有片剂[3]和注射剂[4]上市,2005年版及2010年版《中国药典》均未收载其原料及制剂。卡络磺钠为橙黄色结晶性粉末,含水量高达13%~16%,粉碎、过筛均困难,与辅料难以混合均匀,混合粉末颜色不一致,药片易产生花斑。因此,卡络磺钠片的处方、工艺均有待进一步探索和优化,但迄今尚未见相关研究报道。笔者以单因素试验筛选辅料,正交试验优化处方,淀粉经干燥失水后与卡络磺钠混合粉碎,湿法制粒制备出卡络磺钠片,并对其外观性状、崩解时限、脆碎度、含量均匀度和溶出度等质量指标进行了检查,报道如下。
1 仪器与试药
旋转式压片机(黎明制药机械有限公司);CJY-300B型片剂脆碎度测试仪(上海黄海药检仪器厂);YPD-200C型片剂硬度仪,LB-812A型六管崩解仪,RCZ-6B2型药物溶出仪(上海黄海药检仪器有限公司);U-1800型紫外分光光度计(日立高科技贸易有限公司)。卡络磺钠(福建省闽东力捷迅药业有限公司,批号为081209);淀粉(曲阜市药用辅料有限公司,批号为090120);乳糖(常州市郎生生物工程有限公司,批号为090203);微晶纤维素(MCC,安徽山河药用辅料有限公司,批号为0906033);低取代-羟丙基纤维素(L-HPC,西安惠安纤维素化工有限公司,批号为0803004);羟丙甲基纤维素(HPMC,营口奥达制药有限公司,批号为0811018);交联聚维酮(PVPP,安徽山河药用辅料有限公司,批号为03800216259);交联羧甲基纤维素钠(CCNa,德国瑞登梅尔父子公司,批号为3201081044);硬脂酸镁(营口奥达制药有限公司,批号为20090503)。
2 方法与结果
2.1 单因素试验
填充剂筛选:参考日本东和制药株式会社生产的卡络磺钠片规格,设计片重120 mg,其中含卡络磺钠10 mg、乳糖20 mg、MCC 64mg、HPMC 5mg、硬脂酸镁1mg、淀粉或干淀粉20mg。以片剂的外观和硬度为指标,重点考察含水量为10%~15%的淀粉和经100℃干燥成含水量5%~8%的干淀粉。结果淀粉与卡络磺钠难以混匀,过筛困难,制得的片剂表面有花斑且硬度过大;干淀粉能与卡络磺钠混匀,粉碎后粉体干爽,容易过筛,片剂色泽均匀、一致,硬度合适。因此,选用干淀粉作填充剂。
粘合剂筛选:在上述处方基础上,以可压性、光洁度、脆碎度为评价指标,筛选10%淀粉浆和10%糊精浆的混合浆、L-HPC和HPMC,用量均为5mg/片。结果10%淀粉浆和10%糊精浆的混合浆在此用量下,难以将卡络磺钠与辅料黏合在一起,必须加大用量。粗略计算,1 kg的原辅料大约需用混合浆0.58 kg,用量大、制浆强度大,不适合工业生产,故不采用混合浆;以L-HPC作黏合剂时制得湿颗粒的成型性较好,但干燥后成碎粉状,不能进行压片;HPMC制得的颗粒具有良好的可压性,片剂表面光洁,脆碎度合格,故选择HPMC作黏合剂。
崩解剂筛选:在上述处方基础上,以崩解时限为评价指标筛选了PVPP,CCNa,L-HPC 3种崩解剂,用量为6mg/片。结果PVPP的崩解效果最好,5min之内即可崩解完全。结果见表1。
表1 卡络磺钠片崩解剂筛选结果(±s,n=6)

表1 卡络磺钠片崩解剂筛选结果(±s,n=6)
崩解剂PVPP CCNa L-HPC崩解时限(min)5.0±2.47 15.8±1.84 17.4±1.68崩解现象崩解良好,5min内崩解完全,无残留颗粒崩解较慢,超过15min崩解缓慢,且有小颗粒
2.2 正交试验
经单因素试验,初步确定本品处方由卡络磺钠、干淀粉、HPMC,PVPP,MCC等组成。以溶出度为评价指标进行正交试验,优化HPMC,PVPP,MCC的用量和乙醇体积分数。结果各因素对崩解时限影响的主次关系为HPMC>PVPP>MCC>乙醇体积分数;最优组合为:每片含MCC 60mg,PVPP 4mg,HPMC 5mg,乙醇体积分数为60%,见表2。卡络磺钠片最优的完整处方为:每片含卡络磺钠10 mg、淀粉20 mg、乳糖20 mg、MCC 60 mg、HPMC 5 mg、PVPP 4 mg、硬脂酸镁1mg。
表2 卡络磺钠片处方正交试验结果(±s,n=6)
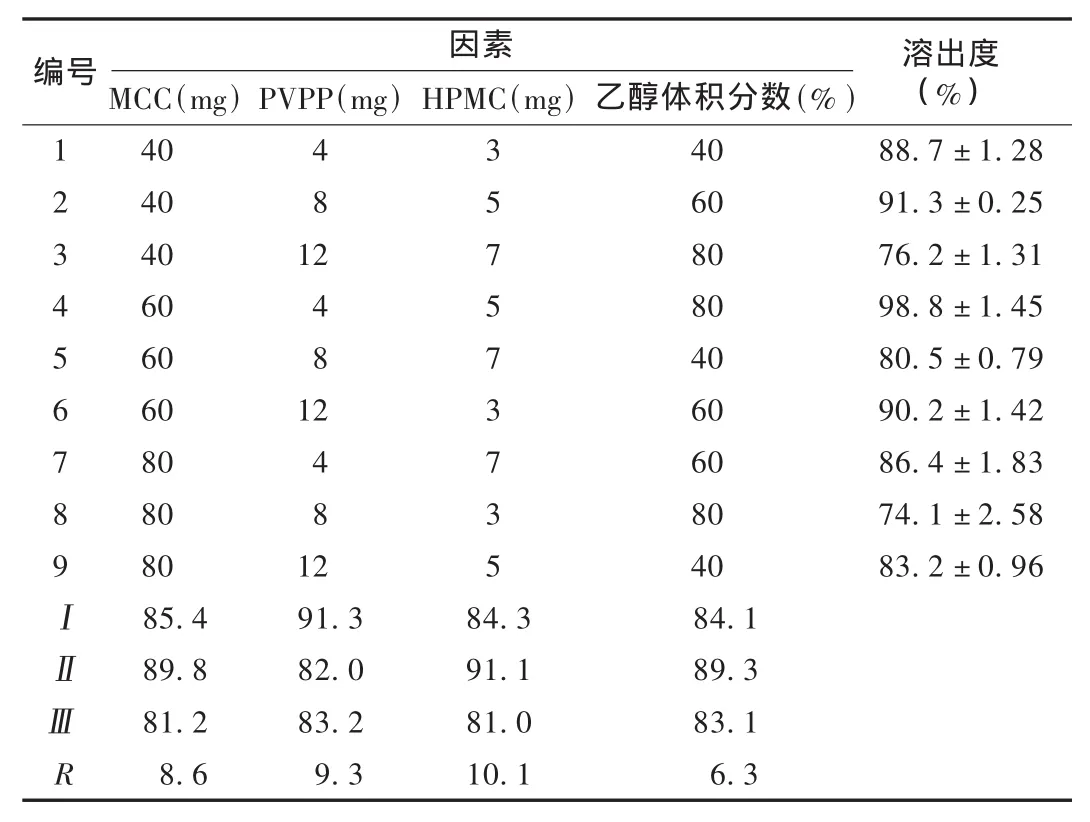
表2 卡络磺钠片处方正交试验结果(±s,n=6)
123456789ⅠⅡⅢR MCC(mg)40 40 40 60 60 60 80 80 80 85.4 89.8 81.2 8.6 PVPP(mg)481 2481 2481 2 91.3 82.0 83.2 9.3hPMC(mg)357573735 84.3 91.1 81.0 10.1乙醇体积分数(%)40 60 80 80 40 60 60 80 40 84.1 89.3 83.1 6.3 88.7±1.28 91.3±0.25 76.2±1.31 98.8±1.45 80.5±0.79 90.2±1.42 86.4±1.83 74.1±2.58 83.2±0.96编号 因素 溶出度(%)
2.3 制备工艺
将淀粉于100℃干燥成含水量5%~8%的干淀粉,再与卡络磺钠等量递加快速混匀,粉碎,过80目筛;混合粉与乳糖、MCC、HPMC、内加PVPP混合,过60目筛三次,混合10min;加入60%乙醇适量于上述混合粉中,混合20min,用16目筛二次制粒;将制得的湿颗粒于60℃左右干燥,水份控制小于3%,14目筛整粒;将外加PVPP和硬脂酸镁加入干颗粒中,混合10min,压片,片重120mg。照此制备工艺,制备3批卡络磺钠片。
2.4 质量检查
对制备的3批卡络磺钠片,按2010年版《中国药典(二部)》片剂检查方法进行质量检查。结果卡络磺钠片外观光洁,脆碎度、崩解时限和含量均匀度均符合片剂相关要求(见表3)。
表3 卡络磺钠片质量检查结果(±s,n=6)

表3 卡络磺钠片质量检查结果(±s,n=6)
批号091101 091107 091110外观光洁光洁光洁脆碎度(%)0.93 0.84 0.96崩解时限(min)8.35±0.79 10.19±0.66 7.14±1.03含量均匀度符合要求符合要求符合要求
2.5 溶出度测定
照[2010年版《中国药典(二部)》附录ⅩC]第二法[7],测定自制的卡络磺钠片和市售卡络磺钠片的溶出度。溶出介质为水900mL,转速为50 r/min,温度为(37±0.5)℃,分别在5,10,15,20,25,30min时取样,照分光光度法[2010年版《中国药典(二部)》ⅣA][5]在363 nm波长处测定吸收度,按卡络磺钠的吸收系数为862计算,即得溶出量。结果自制的卡络磺钠片10min溶出量达到90%以上,15min完全溶出;市售卡络磺钠片需25min溶出量才达到90%以上,需30min才能完全溶出。见图1。
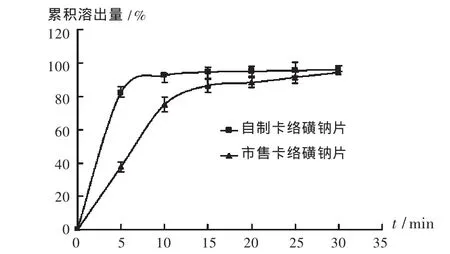
图1 卡络磺钠片的累积溶出曲线
3 讨论
淀粉虽是片剂常用的填充剂,但含水量较高,一般为10%~15%,卡络磺钠本身含水量高达13%~16%,因此两者的混合粉体较湿,过筛与混匀均困难,片剂表面颜色不一致,容易出现花斑。本试验将淀粉于100℃干燥成含水量为5%~8%的干淀粉,不仅能很好稀释卡络磺钠,使主药分散均匀,还能克服卡络磺钠在粉碎过程中易粘连机器的缺点。干淀粉与之混合后,粉体干爽,粉碎、过筛容易,粉体流动性较好。此外,干淀粉吸水性强,膨胀性好,能够瓦解片剂的结合力,使片剂从一个整体的片状物裂碎成许多细小的颗粒,实现片剂的崩解,有利于片剂中卡络磺钠的溶出和吸收。
选用HPMC作黏合剂,将HPMC的干燥粉末直接与原辅料混合,加入乙醇润湿即可呈现良好的黏合作用,用量少,操作方便。HPMC还具有表面活性作用,可提高药物的溶出度[6-7]。通过与市售的卡络磺钠片溶出度比较,自制卡络磺钠片溶出度较市售卡络磺钠片高,除干淀粉加速崩解过程外,也可能与HPMC的表面活性作用有关。
[1]廖正清.止血药新安络血及其应用[J].中国新药杂志,1993,2(6):24-25.
[2]刘 放.卡络磺钠及其制剂的研究进展[J].浙江省医学科学院学报,2009(76):42-46.
[3]WS-10001-(HD-0218)-2002,国家药品监督管理局国家药品标准·化学药品地方标准上升国家标准(第三册)[S].
[4]WS-10001-(HD-0219)-2002,国家药品监督管理局国家药品标准·化学药品地方标准上升国家标准(第三册)[S]
[5]国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2010:附录23,附录86.
[6]单玉华.羟丙基甲基纤维素(HPMC)在片剂生产中的应用[J].齐鲁药事,2004,23(2):56-57.
[7]秦冬梅,王 恒,李海瑛.羟丙甲基纤维素在药剂学中的应用[J].安徽医药,2000,8(3):173-174.
