残耳软骨细胞与脂肪干细胞共培养体内构建软骨的实验研究
2011-03-27张洁蒋海越何乐仁赵延勇杨庆华韩娟宋宇鹏
张洁 蒋海越 何乐仁 赵延勇 杨庆华 韩娟 宋宇鹏
残耳软骨细胞与脂肪干细胞共培养体内构建软骨的实验研究
张洁 蒋海越 何乐仁 赵延勇 杨庆华 韩娟 宋宇鹏
目的验证残耳软骨细胞与脂肪来源的间充质干细胞(Adipose derived stem cells,ADSCs)共培养,体内构建软骨的可行性。方法分离培养同一先天性小耳畸形患者来源的残耳细胞及脂肪干细胞。24只裸鼠随机分为4组:①实验组,接种残耳细胞及脂肪干细胞,两种细胞以1∶1比例混合,细胞浓度为5.0×107cells/mL;②对照组1,接种单纯残耳软骨细胞,细胞浓度为5.0×107cells/mL;③对照组2,接种单纯ADSCs,细胞浓度为5.0×107cells/mL;④对照组3,接种单纯残耳软骨细胞,细胞浓度为2.5×107cells/mL。每组接种6只裸鼠,每只接种0.2 mL。体内培养10周后取材。通过对新生组织的大体观察、测量湿重、糖胺多糖含量测定、组织学及免疫组化染色等方法对各组新生软骨进行比较。结果实验组、对照组1与对照组3新生为不同组织量的软骨样组织,对照组2形成纤维样组织;实验组平均湿重及糖胺多糖含量达到对照组1的88%以上,对照组3平均湿重低于对照组1的40%;HE染色示实验组、对照组1与对照组3的标本均有软骨陷窝形成,对照组2未见软骨陷窝形成;Ⅱ型胶原免疫组化染色示实验组、对照组1与对照组3均可见Ⅱ型胶原表达;对照组2未见Ⅱ型胶原表达。结论体内共培养条件下,残耳软骨微环境可有效促进脂肪干细胞向软骨方向分化,残耳软骨细胞与脂肪干细胞共培养体内构建软骨具备可行性。
共培养脂肪干细胞残耳软骨细胞体内
小耳畸形是整形外科常见的先天体表畸形,严重影响患者的容貌和身心健康,耳廓再造术是目前最有效的治疗手段,而耳廓再造术的关键之一是耳廓软骨支架的制备。目前常用的耳廓支架制备材料为自体软骨组织制备的软骨耳廓支架,与人工高分子成品耳廓支架相比,具有组织相容性好,无排异反应等优点,临床效果良好。组织工程的发展为耳廓再造提供了新的途径。BMSCs已被证实具有向软骨方向分化的能力[1-2],随后也发现ADSCs也具有向软骨分化并形成软骨样组织的能力[3]。ADSCs是一类增殖能力强、具有多向分化潜能的成体干细胞,研究证实该细胞体外大规模扩增后仍保留向软骨方向分化的能力[4-5]。ADSCs与BMSCs相比,具有来源广,易获得,创伤小,纯化率高,体外增殖速度快等优点,是构建软骨组织理想的种子细胞。相关研究表明,BMSCs在软骨细胞提供的软骨微环境中能有效地被诱导向软骨方向分化并形成软骨[6-7]。本研究试图探索残耳软骨细胞微环境能否诱导ADSCs向软骨细胞分化,以及残耳软骨细胞与脂肪干细胞共培养体内构建软骨的可行性。
1 材料和方法
1.1 材料
实验标本为中国医学科学院整形外科医院外耳整形再造中心外耳再造术中废弃的残耳软骨组织及脂肪组织,与患者家属签订知情同意书,患者年龄为5~20岁。
1.2 实验方法
1.2.1 脂肪干细胞的分离与培养
取术中废弃的皮下脂肪组织,剥除肉眼可见的筋膜,小血管等脂肪周围组织后,剪成1mm3大小组织块,加入终浓度为0.075%的Ⅰ型胶原酶(Invitrogen公司,美国),37℃摇床内消化40 min,120 r/min;10%FBS(Gibco公司,美国)的低糖DMEM培养基终止消化,200目滤网过滤,1 500 r/min离心5 min,去上清后加入完全培养基重悬,计数后以细胞浓度为5×104cell/cm2接种培养皿内,37℃、5%CO2、饱和湿度的培养箱(Thermo公司,美国)内培养,每2~3天更换一次培养液。待细胞融合达85%后传代。收集第3代细胞备用。
1.2.2 残耳软骨细胞的分离与培养
取术中废弃的残耳软骨组织,去除软骨组织膜及周围组织后剪成2 mm×2 mm×2 mm的组织块,加入4倍体积量的2%胶原酶(Invitrogen公司,美国),37℃摇床内消化10~12 h,200目滤网过滤,2 000 r/min离心8 min,去上清后加入完全培养基重悬,计数后以细胞浓度为1×104cells/cm2接种培养皿中,37℃、5%CO2、饱和湿度的培养箱内培养,每2~3天更换一次培养液。待细胞融合达85%后传代。收集第2代细胞备用。
1.2.3 可降解支架材料准备
电子天平称取3 g固体粉末Pluronic F-127(Sigma公司,美国),加入10 mL无血清高糖DMEM培养基(Hyclone公司,美国),充分搅拌、溶解,126℃高温高压下消毒处理,4℃存放备用。
1.2.4 实验分组
实验分为4组,每组接种6只裸鼠(6周,雌性)(北京维通利华公司),每只接种0.2 mL,共接种24只。实验组:残耳软骨细胞与ADSCs以1∶1的比例混合,细胞接种终浓度为5.0×107cells/mL;对照组1:单纯软骨细胞,细胞接种终浓度5.0×107cells/mL;对照组2:单纯ADSCs,细胞接种终浓度5.0×107cells/mL;对照组3:单纯软骨细胞,细胞接种终浓度2.5×107cells/mL。
1.2.5 细胞接种
按以上实验分组中的细胞种类、细胞比例以及终浓度将细胞与0.2 mL 30%的Pluronic F-127冰上混匀,用20 mL注射器注射到裸鼠皮下。10周后取材。
1.2.6 新生组织相关评价指标的检测
形态学观察新生组织的形态、大小和色泽,用镊子钳夹判断新生组织的弹性;称重,比较各组湿重平均值的差异;阿利辛蓝比色法检测各组糖胺多糖(GAG)含量平均值(组织糖胺多糖总含量阿尔新蓝比色法定量检测试剂盒,上海杰美公司);将组织块以4%中性福尔马林固定、石蜡包埋、切片,HE染色,观察细胞基本形态和组织结构;甲苯胺蓝染色及Safranin O染色观察软骨组织的异染程度及基质中GAG的分泌情况;Ⅱ型胶原免疫组化染色观察各组标本Ⅱ型胶原表达情况。
1.2.7 统计学处理
数据均用x±s表示,应用SPASS 17.0软件对数据进行t检验,P<0.05表示差异有显著性。
2 结果
2.1 大体观察
实验组、对照组1、对照组3注射部位均有乳白色软骨样组织形成;实验组与对照组1新生组织的大小相仿,外观和弹性类似于正常软骨;对照组3新生组织量明显低于实验组和对照组1,组织弹性也较差。对照组2未生成软骨样组织,而是形成淡黄色,质软的纤维样组织(图1)。
2.2 新生组织平均湿重比较
实验组:177±14.4 mg;对照组1:200.67±13.42 mg;对照组2:73.3±8.6 mg;对照组3:78±8 mg。实验组与对照组3具有相同的初始残耳软骨细胞接种量,实验组平均湿重达到对照组1的88.5%,而对照组3平均湿重仅为对照组1的38.87%(P<0.05)。证明相同的初始残耳软骨细胞量,在共培养实验组生成的软骨组织量要比单独培养组高(图2)。
2.3 新生组织平均GAG含量比较
实验组中单位重量新生组织中糖胺多糖含量的平均值达到对照组1的91.2%,对照组3仅达到对照组1的66.4%(图3)。
2.4 组织学染色
HE染色示除对照组2形成纤维样组织,未发现软骨陷窝外,实验组、对照组1与对照组3的标本均有软骨陷窝形成,实验组与对照组1形成的软骨陷窝形状大小与正常软骨组织相类似,分布较均匀。对照组3软骨陷窝明显变大,且形状、大小差异较大,陷窝间距增宽,且分布不均(图4);Safranin O、甲苯胺蓝染色显示,实验组、对照组1与对照组3均为阳性,实验组与对照组1着色深度较一致,对照组3着色较浅(图5)。Ⅱ型胶原免疫组化染色证实3组样本均有Ⅱ型胶原表达,对照组3着色较浅(图6)。

图1 各组标本大体观察Fig.1Gross view of the specimens in all groups

图2 各组标本湿重Fig.2Wet weight in all groups

图3 各组标本GAG含量Fig.3GAG content in all groups
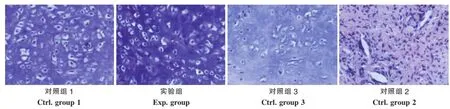
图4 各组HE染色(400×)Fig.4 HE staining for of the specimens in all groups(400×)

图5 各组Safranin O染色及甲苯胺蓝染色(200×)Fig.5Safranin O and Toluidine Blue staining for the specimens in all groups(200×)

图6 各组Ⅱ型胶原免疫组化染色(200×)Fig.6Collagen typeⅡimmunohistochemistry staining for the specimens in all groups(200×)
3 讨论
构建组织工程软骨耳廓最主要的问题是种子细胞的来源问题,小耳畸形患者的残耳软骨组织往往较小,不足以提供足量的残耳软骨细胞,而过度体外扩增,软骨细胞将逐渐失去表型及分泌软骨基质的能力,转化为成纤维细胞,失去成软骨的能力[7-8]。因此,具有强大增殖和多向分化能力的干细胞,尤其是来源广,易获得,纯化率高,体外增殖速度快的脂肪干细胞有望成为构建软骨组织的理想种子细胞。脂肪干细胞向软骨细胞诱导的实验研究较多,但传统的诱导方法需要大量的生长因子,诱导方案较昂贵,从实验研究到临床运用的转化较难。
研究发现,软骨细胞微环境能有效促进多分化潜能的干细胞向软骨方向分化,形成软骨样组织并修复缺损[9-10]。微环境作用的机制可能为:软骨细胞分泌TGF-β、IGF等生长因子,诱导干细胞向软骨方向分化[7];相邻细胞间的相互作用[8];分泌软骨微环境特异性细胞外基质,作用于细胞的增殖、分化、黏附及细胞间信号传导等。另有文献报道,与软骨细胞共培养的BMSCs能向软骨方向分化,在体外形成软骨样组织[9]。因此,我们将残耳软骨细胞与ADSCs体内共培养,探索残耳软骨细胞微环境能否诱导ADSCs向软骨细胞分化,以及残耳软骨细胞与ADSCs共培养体内构建软骨的可行性。
实验结果表明,除对照组2外,其余各组均能形成软骨组织。实验组与对照组1所形成组织的组织量相近,组织学染色结果类似,色泽弹性与正常耳廓软骨无明显区别。而对照组3形成的软骨样组织量明显少于实验组和对照组1,且弹性较差。对照组2未形成软骨样组织。实验组与对照组3含有相同的起始残耳软骨细胞数,然而前者形成组织的平均湿重及GAG含量分别达到对照组1的88.5%与91.2%;后者平均值明显小于对照组1平均值。由此可推断,残耳软骨细胞微环境对脂肪干细胞的软骨方向分化具有确切的促进作用,共培养组中的脂肪干细胞能替代一定量的残耳软骨细胞形成软骨样组织,残耳软骨细胞与脂肪干细胞共培养体内构建软骨是可行的。
[1]Johnstone B,Hering TM,Caplan AI,et al.In vitro chondrogenesis of bone marrow-derived mesenchymal progenitor cells[J].Exp Cell Res,1998,238(1):265-272.
[2]Mackay AM,Beck SC,Murphy JM,ea al.Chondrogenic differentiation of cultured human mesenchymal stem cells from marrow[J].Tissue Eng,1998,4(4):415-428.
[3]Zuk PA,Zhu M,Mizuno H,et al.Multilineage cells from human adipose tissue:Implications for cell-based therapies[J].Tissue Eng,2001,7(2):211-216.
[4]Estes BT,Wu AW,Storms RW,et al.Extended passing,but not aldehyde dehydrogenase activity,increases the chondrogenic potential of human adipose-derive adult stem cells[J].J Cell Physiol,2006,209(3):987-995.
[5]Huang JI,Beanes SR,Zhu M,et al.Rat extramedullary adipose tissue as a source of osteochondrogenic progenitor cells[J].Plast Reconstr Surg,2002,109(3):1033-1041.
[6]Im Gl,Kim DY,Shin JH,et al.Repair of cartilage defect in the rabbit with culture mesenchymal cell transplantation to cartilage defect[J].J Bone Joint Surg Br,2001,83(2):289-294.
[7]Langer R,Vacanti JP.Tissue engineering[J].Science,1993,260 (5110):920-926.
[8]Dinser R,Kreppel F,Zaucke F,et al.Comparison of long-term transgene expressiong after non-viral and adenoviral gene transfer into primary articular chondrocytes[J].Histochem Cell Biol,2001, 116(1):69-77.
[9]Xia Liu,Hengyun Sun,Dan yan,et al.In vivo ectopic chondrogenesis of BMSCs directed by mature chondrocyetes[J].Biomaterials,2010, 31(36):9406-9414.
[10]周广东,王晓云,苗春雷,等.骨髓基质细胞修复猪膝关节非负重区软骨与骨复合缺损的实验研究[J].中国医学杂志,2004,84(11): 925-931.
[11]Hwang NS,Varghese S,Puleo C,et al.Morphogenetic signals from chondrocytes promotes chondrogenic and osteogenic differentiation of mesenchymal stem cells[J].J Cell Physiol,2007,212(2):281-284.
[12]Grassel S,Ahmed N.Influence of cellular microenvironment and paracrine signals on chondrogenic differentiation[J].Front Biosci, 2007,12:4946-4956.
[13]周广东,苗春雷,王晓云,等.软骨细胞与骨髓基质细胞共培养体外软骨形成的实验研究[J].中国医学杂志,2004,84(20):1716-1719.
本刊对来稿中图、表的要求
图和表的共同要求:每幅图或表均应冠有中文和英文图题或表题,图和表以及图注中的文字用中英文叙述;图或表的数量要精选;每幅图或表要单占1页,分别按其在正文中出现的先后次序连续编码,全文只有1幅图时图序为图1,只有1个表时表序为表1,不可写附图或附表;每幅图或表在正文中均应有标示;图或表注应置于图或表下方,图注和表注的次序编号采用阿拉伯数字;图或表注中表明使用的全部非共知公认的缩写;图和表中如有引自他刊者,应注明出处。
表的具体要求:一律采用三横线表,表内不能出现竖线或斜线;表内每一栏均应有表头;如遇有合计或统计学处理内容(如t值、P值等),则在此行上面加一条分界横线;表内共同的计量单位符号和数值表述方式应加括号置于表题后,并以逗号隔开,如:(mol·L-1,x±s);表内数字以个位数、小数点或±为中心上下对齐;表内同一指标数据有效位数应一致,一般按标准差(s)的1/3确定有效位数。
图的具体要求:线条图应尽可能在计算机上绘制;照片宜用数码相机拍摄(分辨率不低于300 dpi)并有良好的清晰度和对比度;胶片冲洗的黑白图和彩色图最好扫描(分辨率不低于300 dpi),以计算机网络方式传送,请不要提供计算机打印的图片,图片大小为7.5 cm×4.5 cm,图中需标注的符号、图号、上下方向应以不妨碍阅图,同时兼顾美感为准;图片若刊用人像,应提供征得本人同意的书面材料,或遮盖其能被辨认出系何人的部分;大体标本照片在图内应有刻度尺标记;病理照片要求注明染色方法和放大倍数。
The Experimental Studies of the Tissue Engineering Cartilage by Co-Culturing Microtia Chondrocytes and Adipose Tissue-Derived Stem Cells in Vivo
ZANG Jie,JIANG Haiyue,HE Leren,ZHAO Yanyong,YANG Qinhua,HAN Juan,SONG Yupeng.Plastic Surgery Hospital,Chinese Academy of Medical Science,Beijing 100144,China.Corresponding author:JIANG Haiyue(E-mail:jianghaiyue@sohu.com).
ObjectiveTo explore the feasibility of the chondrogenesis by co-culturing microtia chondrocytes and human adipose tissue-derived stem cells in vivo.MethodshADSCs and microtia chondrocytes were isolated in vitro.24 nude mice were randomly divided into 4 groups:①Exp group,injected with microtia chondrocytes and hADSCs by a mixing ratio of 1∶1 and the cell concentration was 5.0×107cells/mL;②Ctrl 1 group,injected with only microtia chondrocytes and the cell concentration was 5.0×107cells/mL;③Ctrl 2 group,injected with only hADSCs and the cell concentration was 5.0×107cells/ mL;④Ctrl 3 group,injected with only microtia chondrocytes and the cell concentration was 2.5×107cells/ml.6 nude mice were injected each group at a dose of 0.2 mL.All samples were harvested 10 weeks after culturing in vivo.Gross observation, average wet weights,glycosaminoglycan(GAG)quantification,histology and immunohistochemisty were used to evaluate the chondrogenesis of all groups.ResultsIn Exp,Ctrl 1,and Ctrl 3 group,all the specimens formed homogeneous cartilagelike tissue with typical histological structure at different extent.In Ctrl 2 group,the specimens formed fiber-like tissue. Average wet weight and GAG content of specimens in Exp group were more than 88%of Ctrl 1 group while they were less than 40%in Ctrl 3 group.Cartilage lacuna was detected by HE staining in Exp,Ctrl 1 and Ctrl 3 group at different extent, but not in Ctrl 2 group.Collagen type II was detected by immunohistochemistry in Exp,Ctrl 1 and Ctrl 3 group at different extent,but not in Ctrl 2 group.ConclusionMicrotia chondrocytes could promote chondrogenesis of ADSCs in vivo under the co-culturing system.Tissue engineering cartilage by co-culturing microtia chondrocytes and ADSCs in vivo is feasible.
Co-culture;ADSCs;Microtia chondrocytes;In vivo
Q813.1+2
A
1673-0364(2011)02-0075-05
2011年2月26日;
2011年3月12日)
10.3969/j.issn.1673-0364.2011.02.004
100144北京市中国医学科学院整形外科医院。
蒋海越(E-mail:jianghaiyue@sohu.com)
