不同体外诱导时间对BMSCs成软骨分化的组织学特性影响的研究
2011-06-14周栩周广东张路刘豫朱吉曹谊林
周栩 周广东 张路 刘豫 朱吉 曹谊林
随着定向诱导分化技术的逐步成熟,骨髓间充质干细胞(BMSCs)逐渐成为组织工程种子细胞的最佳来源之一,目前已经被大量用于促进软骨缺损修复的实验研究,良好而有效的诱导方法是将BMSCs成功用于软骨修复的关键[1]。地塞米松与TGF-β1、IGF-I联合应用,可有效地促进BMSCs表达软骨的特征性细胞外基质[2-4]。虽然以BMSCs为种子细胞在体外已经可以成功构建出组织学结构、生物化学组成与正常软骨类似的组织工程化软骨,但是体外不同诱导时间所构建的软骨的组织学特性,及相互之间的关系,仍缺乏深入研究。明确经不同时间诱导的软骨样组织的组织学特性,对于把握组织工程组织回植体内的最佳时机至关重要。本实验以猪的BMSCs为种子细胞,在体外分别进行成软骨诱导1周和4周,并以未经诱导的BMSCs和软骨细胞为对照,分析和比较不同体外诱导时间对BMSCs体外成软骨分化的影响。
1 材料与方法
1.1 材料
长枫杂交猪(n=10),1~2 月龄,6~8 Kg,雌雄不限;DMEM 培养液(Gibco 公司);10%胎牛血清(Hyclone公司);0.25%胰蛋白酶 (Sigma公司);TGF-β1(Intergen 公司,每支 5 μg);IGF(Intergen 公司,每支50 μg);地塞米松(Sigma 公司,2 mg/mL);鼠抗人Ⅱ型胶原单克隆抗体(Dako公司);辣根过氧化物酶标记的羊抗鼠二抗(Dako公司);阿利新蓝8-GX(Sigma公司);硫酸软骨素标准品(Sigma公司);100 mm培养皿,0.22 μm针孔过滤器,50 mL离心管(Falcon公司);编织聚羟基乙酸,聚乳酸,三氯甲烷(Sigma公司); 倒置相差显微镜 (Nikon公司,Eclipse TS100);精密电子天平 (Mettler Toledo公司);DU-640紫外分光光度计(Beckman Coulter公司);激光共聚焦显微镜(Leica公司,SP5)。
1.2 实验方法
1.2.1 猪骨髓间充质干细胞的分离、培养和扩增
实验动物两侧股骨共抽取骨髓15~20 mL,分别置于两支50 mL肝素化的无菌离心管中,加入无血清低糖DMEM培养液40 mL,混匀制成细胞悬液,1 500 r/min离心10 min,吸除脂肪及大部分上清液,重新振荡混匀,以上述方法反复洗涤2次。离心后弃上清,加入10 mL含10%血清的低糖DMEM培养液,混匀制成细胞悬液;按6×105cells/cm2细胞密度接种于培养皿内。置于37℃、5%CO2、100%饱和湿度的培养箱内培养5~6 d,进行首次换液,3~4 d后细胞达到接近融合状态时传代培养。
1.2.2 PGA支架材料的制备
非编织聚羟基乙酸/聚乳酸(PGA/PLA)60 mg,放入注射器模具中,加入少许95%乙醇,制成直径12 mm,厚度3 mm的圆柱体。滴加0.15%的PLA-二氯甲烷溶液0.3 mL,充分晾干后放入培养皿中,75%乙醇浸泡1 h,紫外线照射30 min消毒,重新置入培养皿中,75%乙醇浸泡3次,最后1次浸泡过夜。次日用PBS洗涤2~3次后,加入含10%血清的DMEM培养液预培养过夜,次日吸干DMEM培养液后准备接种细胞。
1.2.3 细胞-材料复合物的制备
将第 2代 BMSCs按 5×107cells/cm3接种到材料上,每块材料接种1.2 mL细胞悬液,使之均匀分布于支架材料上,转移至培养皿中,置于37℃、5%CO2、100%饱和湿度的培养箱中培养4~5 h后首次加培养液,共制作复合物10块,随机分组。
1.2.4 TGF-β1及 IGF-I的稀释与保存
将TGF-β1与 IGF-I用生长因子稀释液 (含有0.1%BSA,4 mM HCl,PBS 为溶剂)稀释,分装后使得每个 Eppendorf管内含 1 μg 的 TGF-β1 或 5 μg的IGF-I,生长因子分装后保存于-20℃条件下,诱导液在换液前临时配制。
1.2.5 实验分组
以含10%FBS的高糖DMEM培养液+0.3 g/L L-谷氨酰胺+0.05 g/L抗坏血酸+3.7g/L碳酸氢钠+10万U/L青霉素钾+0.1g/L硫酸链霉素为培养液。A组以BMSCs为种子细胞:A1组用培养液培养1周(n=1);A2 组培养液培养 4 周 (n=1);A3 组用培养液+TGF-β1 10 ng/mL+IGF-I 50 ng/mL+地塞米松40 ng/mL, 体外诱导1周 (n=3);A4组用培养液+TGF-β1 10 ng/mL+IGF-I 50 ng/mL+地塞米松 40 ng/mL,体外诱导4周(n=3)。B组以软骨细胞为种子细胞:B1组用培养液培养1周 (n=1);B2组用培养液培养 4 周(n=1)。
1.3 相关检测方法
1.3.1 细胞生长情况
倒置显微镜下连续观察细胞在培养皿中的黏附和增殖。
1.3.2 细胞-材料复合物形态学观察
倒置相差显微镜及扫描电镜下连续观察细胞贴壁、伸展及生长状况,比较接种后细胞与材料的黏附情况,以及细胞外基质的分泌状况。
1.3.3 组织学和免疫组化检测
通过HE染色、Safranin O染色和Ⅱ型胶原免疫组化,对各组细胞-材料复合物的组织学特征和GAG含量进行比较。
2 结果
2.1 细胞生长情况
BMSC原代细胞呈集落样生长,集落中央可呈复层生长,细胞为纺锤形、梭形、圆形、三角形、不规则形等,核仁1~2个。传代后可形成单层,细胞体积增大,外形似成纤维细胞,增殖迅速,有一定的方向性,细胞接近融合后呈“旋涡”样生长(图1)。
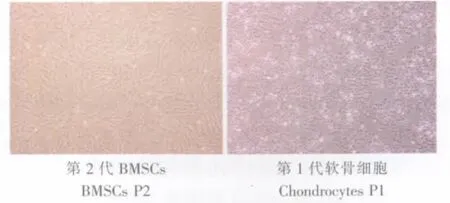
图1 倒置相差显微镜观察BMSCs和软骨细胞形态(40×)Fig.1 Morphology of BMSCs and chondrocytes observed by invert phase contrast microscope (40×)
2.2 细胞-材料复合物形态学观察
接种1周时,倒置相差显微镜下观察,BMSCs在PGA/PLA材料上生长良好,迅速增殖并分泌ECM,分泌的ECM连成一体,散布于材料纤维之间,或形成膜状覆盖在纤维上;扫描电镜观察发现,细胞与支架材料紧密黏附,形成大量的ECM。
接种4周时,镜下看见支架纤维间空隙被逐渐增多的细胞及ECM所填充,整个支架透光性差(图2)。 扫描电镜显示,A3、A4组较 A1、A2组具有更加丰富的基质分泌,并且从1周到4周,细胞和支架逐渐由致密的胶原纤维和粘多糖构成的基质所包绕,提示我们体外一定时间的诱导,对于减轻材料回植体内后引起的炎性反应有所帮助(图3)。
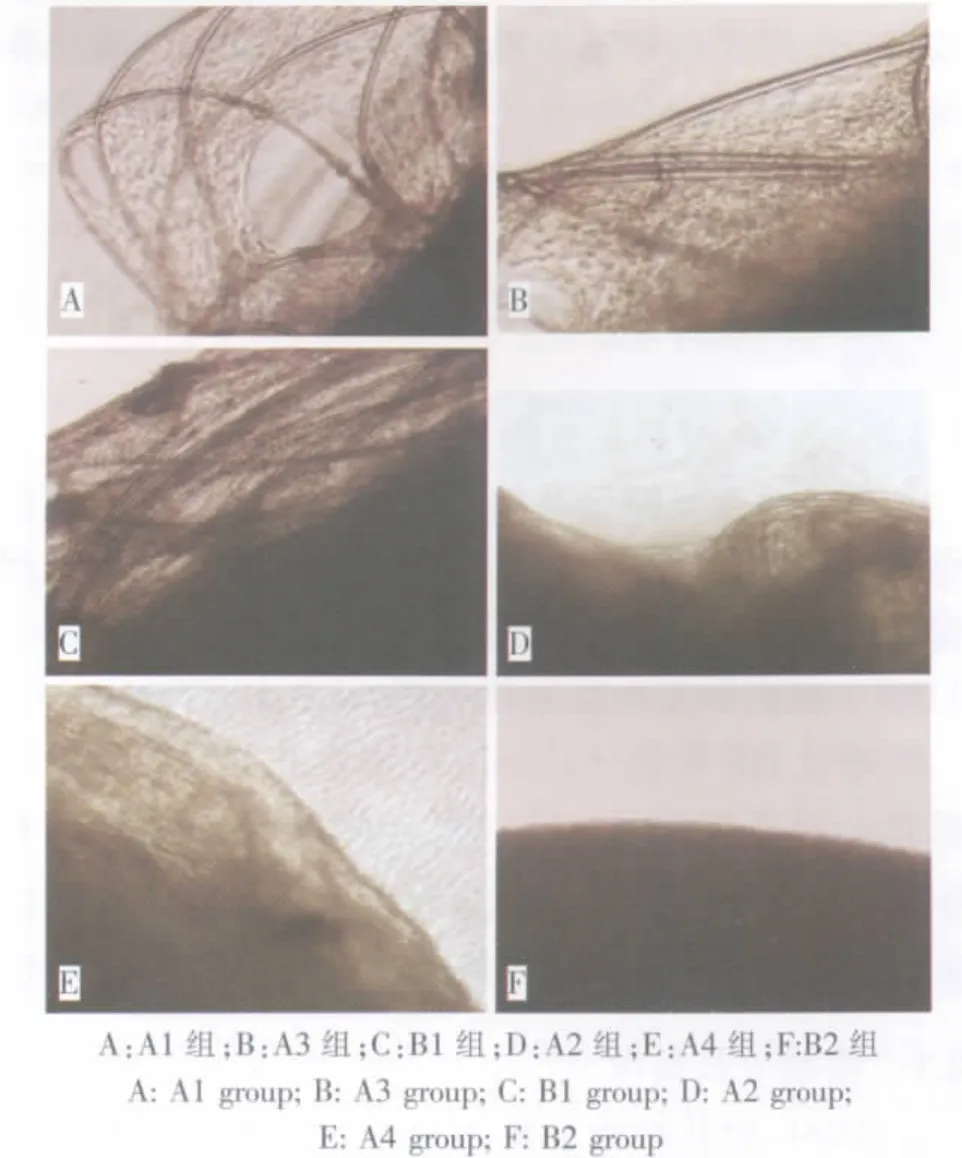
图2 倒置相差显微镜下观察细胞与材料的黏附情况(100×)Fig.2 Adhesion of cells with scaffold observed by invert phase contrast microscope(100×)
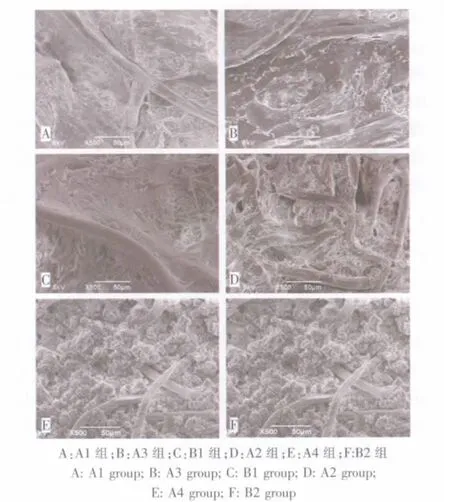
图3 扫描电镜观察细胞与材料黏附性(500×)Fig.3 Adhesion of cells with scaffold observed by scanning electric microscope(500×)
2.3 组织学检测
2.3.1 HE染色
A1、A2、A3组均未见软骨陷窝的形成。A4组和B1、B2组可见散在的不规则的软骨陷窝样结构,并且可以见到散在残留的未降解PGA纤维纵横排列在许多陷窝之间。A4、B2组之间组织学特征较为接近,而B组软骨陷窝比A组更肥大和明显,核大位于陷窝中央。与B2比较,A4组软骨陷窝主要存在于复合物的周边部位,中心区结构较松散(图4)。
2.3.2 Safranin O染色
A、B两组细胞-材料复合物均产生了富含GAG的ECM。B组复合物比A组复合物具有更强烈的GAG表达,在中心区域尤为明显,而且组织中GAG的分布明显不同。B组复合物中均含有较高水平的GAG,而A组复合物中GAG的表达主要在组织的外周区域,而且ECM表现出非均一性,细胞周围缺乏高密度的ECM(图5)。
2.3.3 Ⅱ型胶原免疫组化
各组复合物中Ⅱ型胶原的聚集和分布与aggrecan相似。A4组复合物在组织的外周区域Ⅱ型胶原高度表达,而B组复合物具有更加均质和强烈的表达。体外GAG检测显示,B组和A4组均产生了含Ⅱ型胶原和aggrecan的软骨细胞样的ECM。但是,B组复合物比A组复合物具有更多的ECM分泌和更加均一的分布(图6)。
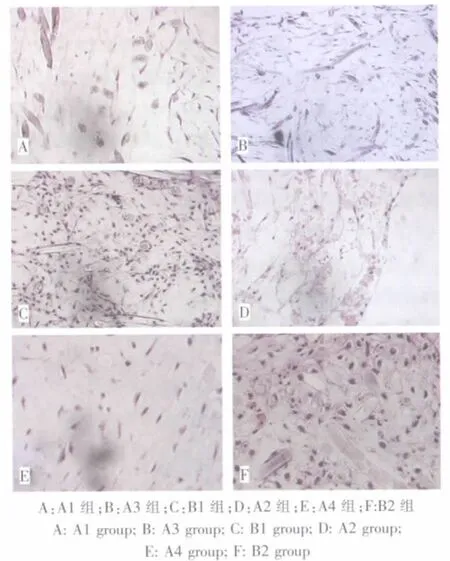
图4 各组标本HE染色(200×)Fig.4 Examination of specimens in all groups by HE staining(200×)
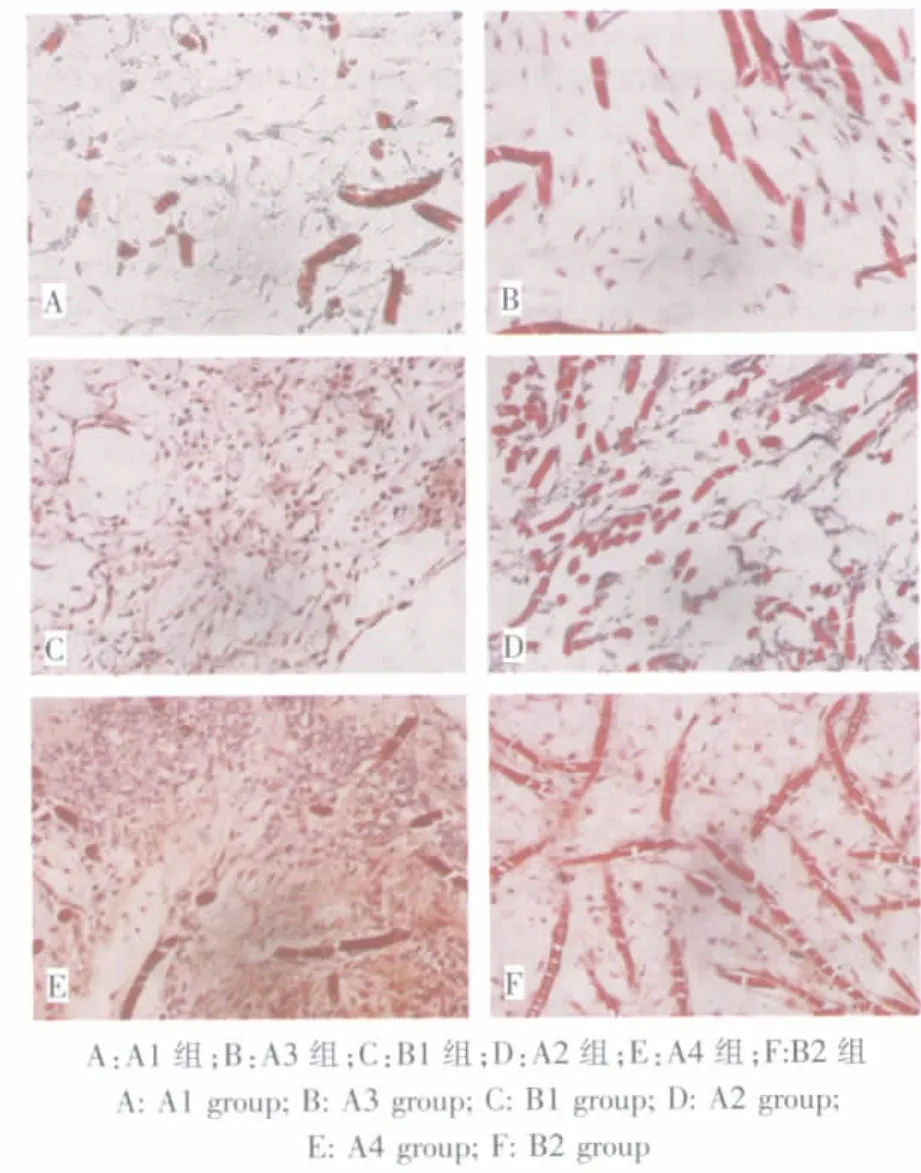
图5 各组标本Safranin O染色(200×)Fig.5 Detection of Safranin O expression by immunohistochemistry staining(200×)

图6 各组标本Ⅱ型胶原免疫组化染色(200×)Fig.6 Detection of ColⅡexpression by immunohistochemistry staining(200×)
2.4 各组细胞材料复合物中GAG含量的改变
随着时间延长,A3、A4组和B组中GAG含量逐渐增多,其中A3组处于最低水平,B2组含量最高(图7)。A4组中GAG含量高于A3组。方差分析显示,A3与A4、B1与B2组之间GAG含量差异有显著性意义(P<0.05)。
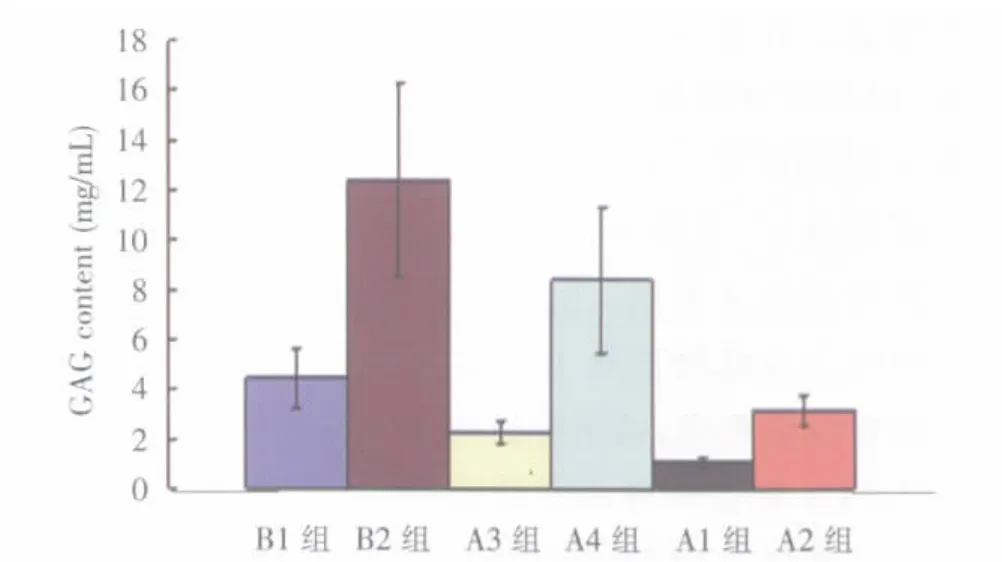
图7 各组标本GAG含量Fig.7 GAG content test of the specimens in all groups
3 讨论
如何既控制增殖又能在适当的时候启动BMSCs向所需方向分化有待进一步的研究。根据BMSCs构建软骨的不同培养环境,分为体内构建和体外构建两种方法。体外软骨构建大致过程是:将体外培养扩增的软骨细胞接种在可降解支架材料上,经体外长时间培养,生物材料逐渐降解,细胞不断分泌软骨特异性细胞外基质(ECM),最终在体外形成特定形状的软骨,再用于修复体内缺损。这种方法构建的软骨形成和成熟过程基本上在体外完成,便于观察和评价,而且可以分析和调控相关影响因素。更为重要的是,体外组织构建能很好地控制预塑的软骨形态,是未来组织工程化产品大规模临床应用的必然要求。体外构建的主要缺点是对体外培养环境和条件要求高。明确体外软骨构建过程中其自身的组织学特性的变化,无疑有利于完善构建手段,并且可以合理地决定构建组织的体内回植时机。
BMSCs定向分化为软骨细胞的必要条件是具备促分化的诱导因子。我们的结果证实了BMSCs在体外向软骨诱导1周和4周后,能够维持初始的大小与形状,4周的诱导即可以有软骨组织产生,有明显的软骨陷窝结构,软骨特异性的组织化学染色呈阳性,免疫组化染色均显示有Ⅱ型胶原的表达,说明4周的诱导时间即可以有部分细胞完成了分化的过程。体外诱导1周的BMSCs-材料复合物未见明显的软骨陷窝结构,软骨特异性的组织化学染色呈阴性。但是,体外诱导4周的BMSCs-材料复合物的GAG含量不及同等数量的单纯软骨细胞-材料复合物。两种细胞形成的复合物中,细胞外基质的结构和分布特点也不相同。这些结果提示,体外诱导时间是对BMSCs向软骨细胞分化以及分泌软骨细胞样的细胞外基质有着重要影响的因素之一。
通过体外诱导1周和4周,为细胞充分黏附于支架上,并且分泌细胞外基质提供了时间。我们发现,虽然有些细胞从材料上流失,但大多数细胞在材料上黏附良好,分泌基质旺盛,细胞-材料复合物形态维持良好。虽然BMSC-PGA/PLA复合物经过体外成软骨诱导4周后,分泌的软骨细胞特异性基质要明显优于在体外诱导1周组,但是还差于同等时间下的软骨细胞组,说明经过体外4周的诱导,BMSCs-PGA/PLA复合物尚未形成成熟的软骨组织。这为我们下一步将复合物回植动物体内提供了实验基础。
根据本实验结果,BMSCs在体外成软骨诱导4周后,能够维持初始的大小与形状,可以形成软骨陷窝样组织结构,与单纯软骨细胞构建的复合物较为接近,而且GAG含量明显高于体外诱导1周的细胞-材料复合物,达到了单纯软骨细胞构建软骨组织的60%以上。这些结果充分说明,体外成软骨诱导4周更有利于BMSCs向软骨分化,作为阴性对照的A1、A2组未形成软骨样组织,表明单纯BMSCs与PGA/PLA支架复合不能在体外非软骨环境中自发形成软骨组织。BMSCs-PGA/PLA的细胞材料复合物在体外经成软骨诱导4周后形成的细胞外基质,还是没有同期软骨细胞形成的细胞外基质成熟,提示我们尚有其他的生物化学及机械刺激的因素[6]也对BMSCs体外构建组织工程化软骨起着重要作用。我们相信,当阐明了体外组织工程化软骨在不同诱导时间段的组织学特性后,随着研究的深入和方法的进一步优化,最终可在体外构建出具有优良软骨性能的、能大规模生产的组织工程化软骨组织。
[1]Shao X,Goh JC,Hutmacher DW,et al.Repair of large articular osteochondral defects using hybrid scaffolds and bone marrowderived mesenchymal stem cells in a rabbit model[J].Tissue Eng,2006,12(6):1539-1551.
[2]Locklin RM,Oreffo RO,Triffitt JT,et al.Effects of TGF-b and bFGF on the differentiation of human bone marrow stromal fibroblasts[J].Cell Biol Int,1999,23(3):185-194.
[3]Dieudonne SC,Kerr JM,Xu T,et al.Differential display of human marrow stromal cells reveals unique mRNA expression patterns in response to dexamethasone[J].J Cell Biochem,1999,76(2):231-243.
[4]Locklin RM,Williamson MC,Beresford JN,et al.In vitro effects of growth factors and dexamethasone on rat marrow stromal cells[J].Clin Orthop,1995,313:27-35.
[5]Thomson BM,Bennett J,Dean V,et al.Preliminary characterization of porcinebone marrow stromal cells:skeletogenic potential,colonyforming activity,and response to dexamethasone,transforming growth factor beta,and basic fibroblast growth factor[J].J Bone Miner Res,1993,8(10):1173-1183.
[6]Indrawattana N,Chen G,Tadokoro M,et al.Growth factor combination for chondrogenic induction from human mesenchymal stem cell[J].Biochem Biophys Res Commun,2004,320(3):914-919.
