低氧训练对大鼠骨骼肌HIF-1 mRNA及铁转运蛋白表达的影响
2011-03-05李海洲刘玉倩王海涛程康康宋文靖
李海洲,刘玉倩,王海涛,程康康,孙 娟,吕 军,宋文靖,杨 杰
铁参与机体氧的转运、贮存与利用及ATP合成等许多生理过程。氧气是维持人体正常生命活动的关键因素,血红蛋白和肌红蛋白与氧气的运输和扩散有着密切的关系,因此,机体内氧的含量直接影响着铁蛋白的储存[25]。运动训练和低氧环境均可改变机体铁状态,其调节机制已经成为国际研究热点。低氧训练能发挥缺氧和运动双重刺激,促进机体红细胞生成,提高机体运载及利用氧的能力[1]。近年来的研究表明,高原低氧刺激引起机体需铁量增加,促使骨骼肌的铁动员发生明显变化[29]。因此,骨骼肌作为运动中利用氧和铁的重要组织[5],低氧刺激下可引起骨骼肌中铁代谢发生适应性变化,从而进一步影响机体运动的能力[4]。
低氧诱导因子1(hypoxia-inducible transcription factor-1,HIF-1)是机体低氧应答的关键因子,近年来发现它能在低氧下通过诱导多种与铁代谢相关蛋白,如一氧化氮合酶(nitric oxide synthase,iNOs)、血红素加氧酶1(hemeoxygenase-1,HO-1)、促红细胞生成素(erythropoietin,EPO)、DMT1、TfR1等的表达进而影响机体的造血、铁代谢等功能[8,27]。同时,有研究表明,低氧可能会引起骨骼肌的铁含量的变化,对运动成绩造成影响[13]。低氧训练下骨骼肌铁吸收蛋白转铁蛋白受体1(transferring receptor 1,TfR1)和二价金属离子转运体(divalent metal transporter1,DMT1),骨骼肌铁释放蛋白膜铁转运蛋白1(ferroportin1,FPN1)[30]受整个机体铁状态影响,进而使骨骼肌中铁含量发生变化。然而,单纯低氧和低氧结合运动对骨骼肌的铁代谢影响是否存在差异,低氧对骨骼肌铁代谢的具体调节机制尚需探索。本研究将通过检测低氧训练中骨骼肌HIF-1mRNA、铁转运蛋白的表达以及骨骼肌组织铁的变化,阐明低氧以及低氧训练对骨骼肌铁代谢的影响机制,为进一步研究低氧训练对骨骼肌铁代谢的影响提供理论依据。
1 材料与方法
1.1 实验动物
雄性SD大鼠32只(河北医科大学实验动物中心提供),体重250±10g,标准啮齿类动物,饲养笼分笼喂养,自由进食和饮水,湿度50%±5%,室温22℃~25℃,每日自然光照,所有动物实验前均无跑台运动史。
1.2 训练方案
大鼠随机分成4组:常氧安静组(normal control,NC)、常氧运动组(normal exercise,NE)、低氧安静组(hypoxia control,HC)、低氧运动组(hypoxia exercise,HE)。每组各8只。采用常压低氧仓(氧浓度13.6%,相当于3 500m海拔)[6],低氧安静组和低氧运动组每天在低氧舱安静呆8h,常氧运动的强度为从21m/min递增至25m/min,每周增1m/min,1h/天,6天/周。坡度为0°,运动5周。
1.3 取材
最后一次处理24h后安静常氧时取材,采用戊巴比妥钠(0.4%,1ml/100g)麻醉大鼠,用去离子水(Mill-Q,France)配制的4℃生理盐水升主动脉快速灌流,取腓肠肌外侧头,迅速投入液氮中保存以备进行测定。
1.4 原子吸收法测定大鼠骨骼肌总铁含量
取1.0~5.0g骨骼肌放于锥形瓶中,加入25ml混合酸(硝酸∶高氯酸=4∶1),应用电热消解仪(EHD36,LABTECH)进行消解,冷却后取上清备用。取Fe标准液及样品液,用原子吸收分光光度计(AA240FS,VARIAN)进行测定,原子吸收分析软件(spectrAA5.1,VARIAN)进行分析。
1.5 RT-PCR检测大鼠骨骼肌HIF-1mRNA的表达变化
采用RT-PCR检测大鼠骨骼肌细胞中HIF-1mRNA的表达:取100μg组织加1ml Trizol Reagent(Invitrogen,USA)匀浆器匀浆,提取总DNA。测浓度及纯度后用反转录试剂盒(PrimeScirptTM RT reagent Kit,TaKaRa)在PCR仪(Eppendorf AG 22331,Gene company Limited)中进行反转录(37℃15min,85℃5s),总体系为20μL,反转录产物在冰上配制PCR反应液。在RT-PCR管中加入2μL反转录后的cDNA,上下游引物(上海生工)各1μL,10%PCR Buffer 2μL ,10mM DNTP 2μL,Taq酶0.2μL(TaKaRa),DEPC水补至20μL。设定HIF-1mRNA扩增反应循环条件为:95℃4min;94℃45s,56℃45s,72℃1min(34个循环);72℃10min[3]。放置PCR仪中进行扩增。取5μL扩增产物用于1.2%琼脂糖凝胶电泳分析(溴化乙锭EB染色),同时以β-actin为内参,用凝胶成像系统(Fujifilm Las-4000)扫描图像,Multi Gauge V3.1分析软件进行分析,最终统计HIF-1与β-actin的亮度比值。引物设计序列[10]如表1所示。

表1 本研究RT-PCR引物序列一览表
1.6 Western Blot检测大鼠骨骼肌DMT1、FPN1、TfR1的表达
提取骨骼肌总蛋白,Bradford法测定总蛋白浓度,进行SDS-PAGE电泳:10%分离胶,4%浓缩胶,上样量为50μL,同时加入Marker,恒压电泳100 V,20min,再200V,45min;恒流转至NC膜300mA,45min。5%脱脂奶粉室温封闭2h,分别加入DMT1(IRE)(1∶5 000)、DMT1(non IRE)(1∶5 000)、TfR1(1∶1 000)、FPN1(1∶5 000)兔抗大鼠蛋白的(ADI,San Antonio,TX)一抗,4℃过夜;TBST(20Mm Tris-Cl,pH 7.6,137 mMNaCL,0.1%Tween-20)洗膜后加入1∶5 000辣根过氧化物酶(HRP)标记的二抗[山羊抗兔IgG(H+L)],室温摇动孵育1h:加入化学发光底物(Super signal west pico trial kit,PIERCE,USA)发光;用凝胶成像系统(Fujifilm Las-4000)扫描图像,Multi Gauge V3.1分析软件进行分析。TBST洗膜厚奶粉室温封闭,再加入β-actin抗体再进行发光。最终统计每一种目的蛋白与β-actin的OD比值。
1.7 统计学分析
所有数据采用SPSS 18.0进行组间比较,采用双因素方差分析(UNIANOVA)和单因素方差分析(One-Way ANOVA),实验结果以平均数±标准差(±SD)表示,显著性水平为P<0.05,非常显著性水平为P<0.01。
2 结果
2.1 低氧训练对大鼠腓肠肌总铁含量的影响
结果显示(表2),与常氧安静组相比,各组大鼠腓肠肌总铁含量明显升高(P<0.05,P<0.01);而低氧运动组大鼠腓肠肌总铁含量明显高于常氧运动组和低氧安静组(P<0.05)。

表2 本研究低氧训练对大鼠腓肠肌总铁含量的影响一览表(n=8)
2.2 低氧训练对大鼠腓肠肌HIF-1mRNA表达的影响

图1 本研究大鼠腓肠肌HIF-1mRNA表达的比较示意图(n=8)
低氧安静组和低氧运动组大鼠骨骼肌中HIF-1mRNA的表达显著高于常氧安静组和常氧运动组(P<0.01;NC:0.53±0.13;NE:0.50±0.13;HC:0.96±0.12;HE:0.98±0.16;图1)。
2.3 低氧训练对大鼠骨骼肌铁转运蛋白表达的影响
NC组:DMT1(IRE):0.55±0.03,DMT1(nonIRE):0.57±0.08,TfR1:0.65±0.04,FPN1:0.55±0.016;NE组:DMT1(IRE):0.73±0.02,DMT1(nonIRE):0.73±0.08,TfR1:0.82±0.05,FPN1:0.45±0.02;HC组:DMT1(IRE):0.72±0.04,DMT1(nonIRE):0.70±0.09,TfR1:0.81±0.07,FPN1:0.46±0.07;HE组:DMT1(IRE):0.95±0.11,DMT1(nonIRE):0.91±0.04,TfR1:0.97±0.09,FPN1:0.70±0.05(图2)。
结果显示,与常氧安静组相比,各组大鼠的铁吸收蛋白(DMT1、TfR1)均显著性升高(P<0.05,P<0.01),常氧运动组和低氧安静组的铁释放蛋白(FPN1)明显下降(P<0.05,P<0.01),低氧运动组明显升高(P<0.01)。低氧运动组铁吸收蛋白(DMT1、TfR1)和铁释放蛋白(FPN1)均非常显著高于常氧运动组和低氧安静组(P<0.01)。
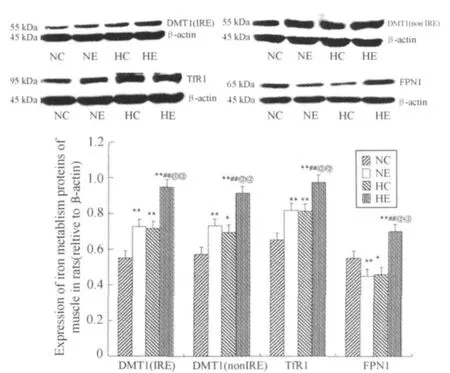
图2 大鼠骨骼肌铁转运蛋白表达的比较示意图(n=8)
3 讨论
3.1 低氧训练与骨骼肌铁代谢
本实验中不同组别大鼠承受的运动刺激不同,其生理机能会发生不同的适应性变化,骨骼肌是运动中利用铁的重要组织,骨骼肌的铁代谢也会因运动强度的不同随之改变[5]。骨骼肌细胞的铁代谢包括铁的摄取和铁的释放,骨骼肌主要通过转铁蛋白受体介导的内吞机制摄取铁,转铁蛋白(transferrin,Tf)首先与细胞膜上的转铁蛋白受体1(transferrin receptor 1,TfR1)结合,然后受体-转铁蛋白-铁复合物通过细胞的内吞作用进入肌细胞内。骨骼肌细胞膜上除TfR1外还有二价金属离子转运体1(divalent metal transporter l,DMT1)参与铁的摄取[21,16]。膜铁转运蛋白1(ferroportin 1,FPN1)有将铁从骨骼肌细胞从细胞内释放至细胞外的功能[11,18]。本实验结果显示,常氧运动组和低氧安静组大鼠铁吸收蛋白TfR1和DMT1的两种亚型均明显升高、铁释放蛋白FPN1明显下降。本实验组前期研究发现,适度运动有利于骨骼肌铁吸收[30],同时有研究证明,单纯的低氧刺激会增加细胞DMT1和TfR1蛋白的表达,这与DMT1和TfR1是低氧诱导产生的HIF-1的靶基因有关[2,23]。低氧运动组大鼠与各组比较TfR1和DMT1明显升高、FPN1明显升高,分析其原因是低氧训练加大了机体的负荷,为了促进红细胞的生成[27],机体铁的需要量增加,骨骼肌铁吸收能力提高的同时,铁释放能力也升高,释放更多的铁到机体中用于Hb的合成。
由于骨骼肌铁转运蛋白的明显变化,其总铁含量也发生相应变化,与常氧安静组对比,各组大鼠腓肠肌铁含量明显增加,低氧训练组与各组比较腓肠肌铁含量也显著增加。本实验组前期研究发现,不同强度的运动会造成机体铁分布的变化,适度的运动会增加骨骼肌中铁储存,有利于骨骼肌的铁利用[5]。低氧刺激能增加骨骼肌铁储存,可能与满足肌肉收缩有关[7,12],同时发现,HIF-1能刺激离体损坏的肌细胞(C2C12)再生[9],因此,低氧下骨骼肌用于细胞再生的铁增加也是组织铁增加主要的原因[17]。低氧运动组大鼠铁吸收与铁释放明显增加,同时骨骼肌铁储存也明显增加,这说明低氧训练不仅有利于骨骼肌功能的改善,并能促进骨骼肌的铁利用,在维持机体铁稳态中起到积极作用。
3.2 低氧训练对大鼠骨骼肌铁转运蛋白影响的可能机制
低氧训练影响机体铁代谢的途径较多,但目前尚缺乏直接证据证明低氧通过何种途径调节骨骼肌铁转运蛋白的表达。近年研究表明,HIF在低氧诱导的机体适应中发挥重要作用[31]。实验结果表明,低氧对照组和低氧运动组其HIF-1mRNA明显升高,这说明低氧可显著增加骨骼肌HIF1的表达。低氧训练能增加大鼠腓肠肌DMT1(IRE)的表达,这可能是低氧时机体可以通过HIF/HRE系统调节铁调节蛋白1(iron regulatory proteins 1,IRP1)的表达,IRP1作为HIFs的靶基因,HIFs能够上调IRP1,通过IRP1表达的变化进一步影响具有铁反应元件(iron response element,IRE)铁转运相关蛋白[22]。FPN1在适度的运动和低氧暴露下表达下降,而低氧训练使FPN1表达显著上升。FPN1主要受肝脏分泌的抗菌多肽hepcidin负调控,hepcidin对骨骼肌的铁代谢也起重要的调节作用,hepcidin可与骨骼肌或心肌细胞膜上的FPN1结合,降低铁的释放[14,20]。而hepcidin受到最新发现的铁调素调节子跨膜丝氨酸蛋白酶6(transmenbrance serine proteases 6,TMPRSS6)的抑制[15]。TMPRSS6受低氧下产生的关键信号因子HIF-1的调节[26,19]。
骨骼肌铁转运蛋白的变化直接影响骨骼肌中的总铁含量,然而,过度的低氧暴露或低氧训练并不利于骨骼肌的功能,骨骼肌中铁含量流失或超载都会引起骨骼肌功能的下降。长时间高原条件下人体骨骼肌FPN1mRNA表达增加,这会增加铁释放[24]。因此,长时间的低氧暴露会影响骨骼肌细胞的代谢和有氧氧化能力及肌肉体积,造成细胞损伤,影响了肌细胞的活性[28]。但也有研究发现,运动性低血色素的大鼠在低氧环境下(14.5%)恢复3周后,血清铁(serum iron,SI)、血清铁蛋白(serum ferritin,SF)、总铁结合力明显升高,血清转铁蛋白受体(serum transferring receptor,sTfR)下降也说明低氧暴露可以促进血清铁代谢,有利于运动性低血色素恢复,对机体起到良好的恢复作用[1]。本实验对低氧训练引起的骨骼肌铁转运蛋白的变化进行了初步研究,低氧训练的方式、强度还需进一步完善,而低氧训练对机体铁代谢以及骨骼肌铁代谢影响的具体机制还需深入探讨。
4 结论
大鼠适度运动和单纯的低氧暴露均能增加骨骼肌的铁贮存以满足运动中机体对铁的需求,有利于骨骼肌运动能力的改善。而低氧训练在促进骨骼肌铁吸收的同时,铁的释放也显著增加,这加强了骨骼肌循环利用铁的能力,从而进一步满足整个机体其他组织对铁的需要,维持机体铁稳态。同时发现DMT1和TfR1作为HIF-1的靶基因,低氧训练中HIF-1mRNA表达增加可能是影响骨骼肌铁转运蛋白表达的原因之一。
[1]林文弢,邱烈峰,翁锡全,等.低氧暴露对运动性低血红蛋白大鼠血清铁代谢的影响[J].中国运动医学杂志,2007,26(1):66-67.
[2]李海洲,刘玉倩,王海涛,等.低氧暴露对骨骼肌L6细胞铁代谢的影响[J].生理学报,2011,63(4):347-352.
[3]刘树欣,王海涛,刘玉倩,等.运动性低血色素形成过程中大鼠肝脏HJV mRNA表达及血清Hepcidin含量的变化[J].体育科学,2011,31(3):53-56.
[4]刘玉倩,常彦忠,钱忠明,等.不同强度游泳运动大鼠不同组织铁分布及血清铁状态的影响[J].解剖学报,2005,36(5):518-522.
[5]刘玉倩,常彦忠,王海涛,等.运动对大鼠腓肠肌一氧化氮含量和铁转运蛋白表达的影响[J].中国运动医学杂志,2007,26(2):112-115.
[6]赵华,曾凡星,张漓.4周低氧运动对骨骼肌mTOR/p70~(S6K)通路的时程影响[J].体育科学,2010,30(1):51-61.
[7]BISHOP G M,SMITH M A,LAMANNA J C,et al.Iron homeostasis is maintained in the brain,but not the liver,following mild hypoxia[J].Redox Rep,2007,12(6):257-266.
[8]CHAPMAN R F,STRAY-GUNDERSEN J,LEVINE B D.Epo production at altitude in elite endurance athletes is not associated with the sea level hypoxic ventilatory response[J].Sci Med Sport,2010,13(6):624-629.
[9]DEHNE N,KERKWEG U,FLOHE S B,et al.Activation of hy-poxia-inducible factor 1 in skeletal muscle cells after exposure to damaged muscle cell debris[J].Shock,2011,35(6):632-638.
[10]DIDIER F,PISANI1,CLAUDE A,et al.Skeletal muscle HIF-1 expression is dependent on muscle fiber type[J].J Gen Physiol,2005,126(2):173-178.
[11]DONOVAN A,BROWNLIE A,ZHUO Y,et al.Positional cloning of Zebrafish ferroportin 1 identifies a conserved vertebrate iron exporter[J].Nature,2001,403(6771):776-781.
[12]FRASER J,DE MELLO L V,WARD D,et al.Hypoxia-inducible myoglobin expression in nonmuscle tissues[J].Proc Natl Acad Sci USA,2006,103(8):2977-2981.
[13]FRESE F,FRIEDMANN-BETTE B.Effects of repetitive training at low altitude on erythropoiesis in 400 and 800 m runners[J].Int J Sports Med,2010,31(6):382-388.
[14]GE X H,WANG Q,QIAN Z M,et al.The iron regulatory hormone hepcidin reduces ferroportin 1 content and iron release in H9C2 cardiomyocytes[J].J Nutr Biochem,2009,20(11):860-865.
[15]GUILLEM F,LAWSON S,KANNENGIESSER C,et al.Two nonsense mutations in the TMPRSS6 gene in a patient with microcytic anemia and iron deficiency[J].Blood,2008,112(5):2089-2091.
[16]GUNSHIN H,BRYAN M,URS V,et al.Cloning and characterization of a mammalian proton-coupledmetal-ion transporter[J].Nature,1997,388(6641):482-488.
[17]KESWANI S C,BOSCH-MARCE M,REED N,et al.Nitric oxide prevents axonal degeneration by inducing HIF-1-dependent expression of erythropoietin[J].Proc Natl Acad Sci USA,2011,108(12):4986-4990.
[18]KIE A T,DALNA B,GLADYS O,et al.Aniron-regulated ferric reductase associated with the ab-sorption of dietary iron[J].Sci,2001,291(5509):1755-1759.
[19]LAKHAL S,SCHODEL J,TOWNSEND A R,et al.Regulation of type II transmembrane serine proteinase TMPRSS6 by hypoxia-inducible factors:new link between hypoxia signaling and iron homeostasis[J].J Biol Chem,2011,286(6):4090-4097.
[20]LIU Y Q,CHANG Y Z,ZHAO B,et al.Does hepatic hepcidin play an important role in exercise-associated anemia in rats?[J].Int J Sport Nutr Exe Metab,2011,21(1):19-26.
[21]LIU Y Q,DUAN X L,CHANG Y Z,et al.Molecular analysis of increased iron status in moderately exercised rats[J].Mol Cell Biochem,2006,282(1-2):117-123.
[22]LUO Q Q,WANG D,YU M Y,et al.Effect of hypoxia on the expression of iron regulatory proteins 1 and the mechanisms involved[J].IUBMB Life,2011,63(2):120-128.
[23]QIAN Z M,MEI W X,MING F,et al.Divalent metal transporter 1 is a hypoxia-inducible gene[J].J Cell Physiol,2011,226(6):1596-1603.
[24]ROBACH P,CAIRO G,GELFI C,et al.Strong iron demand during hypoxia-induced erythropoiesis is associated with downregulation of iron-related proteins and myoglobin in human skeletal muscle[J].Blood,2007,109(11):4724-4731F.
[25]SALAHUDEEN A A,BRUICK R K.Mammalian iron and oxygen homeostasis:sensors,regulation,and cross-talk[J].Ann N Y Acad Sci,2009,1177(10):30-38.
[26]SILVESTRI L,PAGANI A,NAI A,et al.The serine protease matriptase-2(TMPRSS6)inhibits hepcidin activation by cleaving membrane hemojuvelin[J].Cell Metab,2008,8(6):502-511.
[27]TEKIN D,DURSUN A D,XI L.Hypoxia inducible factor 1(HIF-1)and cardioprotection[J].Acta Pharmacol Sin,2010,31(9):1085-1094.
[28]VOGT M,HOPPELER H.Is hypoxia training good for muscles and exercise performance?[J].Prog Cardiovasc Dis,2010,52(6):525-533.
[29]VIGANO A,RIPAMONTI M,DE PALMA S,et al.Proteins modulation in human skeletal muscle in the early phase of adaptation to hypobaric hypoxia[J].Proteomics,2008,8(22):4668-4679.
[30]WANG H T,DUAN X L,LIU J,et al.Nitric oxide contributes to the regulation of iron metabolism in skeletal muscle in vivo and in vitro[J].Mol Cell Biochem,2010,342(1-2):87-94.
[31]YUAN G,KHAN S A,LUO W,et al.Hypoxia-inducible factor 1 mediates increased expression of NADPH oxidase-2 in response to intermittent hypoxia[J].J Cell Physiol,2011,Feb 1:Epub ahead of print.
