GW501516对低氧条件下肺动脉平滑肌细胞增殖的作用及其机制*
2022-08-29陈昌贵贺立群田立群易春峰
陈昌贵, 贺立群, 田立群, 易春峰
(武汉市第一医院心血管内科, 湖北 武汉 430022)
持续性低氧可导致非肌型肺小动脉肌化、血管壁的内膜增厚、管腔狭窄甚至闭塞从而使肺动脉压力增加。长期过高的肺动脉压力会导致右心功能衰竭而死亡。肺血管重构是低氧肺动脉高压(hypoxic pulmonary hypertension, HPH)持续发展的病理生理基础,低氧诱导肺动脉平滑肌细胞(pulmonary artery smooth muscle cells, PASMCs)异常增殖在低氧肺血管中起着至关重要的作用[1, 2]。过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPARs)是核激素受体家族中的配体激活受体,包含3种亚型:PPARα,PPARγ和PPAR δ(也称PPAR β/δ)。PPAR的活化能够调节多种生物学过程,包括能量稳态,细胞增殖和分化,葡萄糖代谢,脂肪酸合成及分解代谢。既往研究发现,PPAR δ具有改善胰岛素抵抗、抑制炎症反应、抗氧化应激、抗动脉粥样硬化等作用[3, 4]。GW501516也称为GW-1516,Cardarine或Endurobol,是葛兰素史克研制的一种PPARδ特异性激动剂,其可促进脂肪代谢,增加骨骼肌对葡萄糖的利用,提高运动耐力,动物实验表明其具有减肥作用,国外黑市上有部分人购买GW501516用于减肥增肌,但是其长期口服安全性有待进一步研究[5,6]。在氧化型低密度脂蛋白(oxidized low-density lipoprotein, ox-LDL)诱导血管平滑肌细胞(vascular smooth muscle cells, VSMCs)增殖模型中发现,GW501516能够阻滞VSMCs于G0/G1期,抑制其增殖[7]。另有研究表明,GW501516能够通过抑制蛋白激酶B(protein kinase B, AKT)活化抑制血管紧张素II诱导的VSMCs肥大[8],而AKT信号通路能够促进低氧PASMCs增殖[9]。因此本研究观察PPARδ激动剂GW501516对低氧条件下PASMCs增殖的影响,并探讨其可能机制,为低氧肺血管重构的防治寻找新靶点。
1 材料与方法
1.1 实验动物
体重170~190 g SPF级别雄性SD大鼠购自北京维通利华动物科技有限公司,动物生产许可证号:SCXK(京)2016-0006。
1.2 试剂
I型胶原酶、GW501516、SC79、DMSO、RNase(RNA酶)、Triton X-100、 溴化乙锭(PI)等购自Sigma公司; CCK-8试剂盒购自日本同仁化学研究所;BrdU试剂盒购Roche公司;DMEM/F12培养基、青霉素/链霉素双抗溶液、胎牛血清、胰酶等购自Hyclone公司;细胞裂解液、BCA蛋白浓度测定试剂盒购自碧云天生物科技有限公司,TRIzol购自Invitrogene公司;PPARδ抗体、T-AKT与P-AKT抗体、T-GSK3β与P-GSK3β抗体、GAPDH抗体购自Sigma公司。
1.3 仪器
细胞培养箱 ( Thermo,3131 ),多功能酶标仪( Bio-tek公司,Synergy HT),荧光定量PCR仪(Roche公司,LightCycler 480),双色红外荧光扫描仪(Odyssey公司, LI-COR)。
1.4 SD大鼠PASMCs原代培养
采用浓度为0.2% I型胶原酶消化分离PASMCs[10],使用含20%胎牛血清DMEM/F12培养基培养PASMCs,传至第3代时,性状稳定,通过显微镜观察PASMCs进行形态学鉴别,免疫组织化学检测SM-α-actin进行PASMCs鉴定(本研究细胞纯度>95%),本研究所用PASMCs为4~10代细胞。
1.5 实验分组
本研究选用GW501516浓度为10~100 nmol/L,SC79浓度为10 μmol/L[11]。筛选GW501516抑制低氧PASMCs增殖最适浓度实验分为5组,每组设6个复孔:对照组:0.1%DMSO;低氧组:0.1%DMSO+低氧;GW501516低、中、高剂量低氧组:不同浓度的GW501516 (10、30、100 nmol/L)+低氧。低氧及GW501516对PPARδ的表达的影响分为3组,每组设6个复孔:对照组:0.1%DMSO;GW501516组:100 nmol/L GW501516;低氧组:0.1%DMSO+低氧。GW501516抑制低氧PASMCs增殖机制相关实验分为4组,每组设6个复孔:对照组:0.1%DMSO;低氧组:0.1%DMSO+低氧;GW501516低氧组:100 nmol/LGW501516+低氧;GW501516+SC79低氧组:100 nmol/LGW501516+10 μmol/L SC79+低氧。GW501516与SC79均溶解于DMSO储存于-20℃,进一步使用时采用DMSO稀释。对照组采用含21%氧气,5%二氧化碳,74%氮气培养,低氧组采用含 3%氧气 、5%二氧化碳和92%氮气培养[12],当细胞融合度达到70%左右时,采用不含血清的培养基培养细胞24 h后分别进行常氧或低氧培养处理,GW501516低氧组与GW501516+SC79低氧组在低氧培养前给予GW501516或(和)SC79预处理2 h后进行干预。
1.6 CCK-8检测细胞增殖
PASMCs以5×103cells/well均匀接种于96孔板中,每孔含培养基100 μl,各组细胞干预后,按照CCK-8试剂盒使用说明在96孔板每孔加入10 μl CCK-8溶液,继续在培养箱中孵育3 h,采用酶标仪测定450 nm吸光度,计算细胞的相对增殖。
1.7 BrdU试剂盒检测DNA的合成
PASMCs以5×103cells/well均匀接种于96孔板中,各组细胞干预后,每孔加入10 μl BrdU标记液,孵育2 h后移去标记液,按照试剂盒操作步骤依次加入FixDenat solution,anti-BrdU-POD工作液,Substrate solution后酶标仪测定450 nm吸光度,计算DNA的相对含量。
1.8 流式细胞仪检测细胞周期
PASMCs以 1.5×105cells/well均匀接种于6孔板中,各组细胞干预后,采用胰酶消化收集细胞,PBS洗涤后加入70%乙醇(无水乙醇+PBS溶液)固定过夜,离心后加入485 μl PBS重悬细胞、Triton X-100 1 μl、1 mg/ml RNA酶 5 μl、 1 mg/ml PI 10 μl,4℃避光孵育30 min后,通过流式细胞仪检测细胞周期,modifit软件分析数据。
1.9 RT-PCR检测mRNA的表达
PASMCs以 1.5×105cells/well均匀接种于6孔板中,各组细胞干预后,使用TRIzol试剂提取总RNA,1.5%的琼脂糖凝胶电泳检测RNA完整性,分光光度计测量RNA的质量和浓度。按照反转录试剂盒操作步骤将mRNA逆转录为cDNA,再经PCR技术扩增,以GAPDH作为内参标准化RNA的含量。所用引物序列为: CyclinD1: 上游 5'-GAGACCATCCCCCTGACGGC-3',下游 5'-TCTTCCTCCTCCTCGGCGGC-3';P27:上游 5'-TGCAACCGACGATTCTTCTACTCAA-3',下游5'-CAAGCAGTGATGTATCTGATAAACAAGGA-3';GAPDH:上游 5'-GACATGCCGCCTGGAGAAAC-3',下游 5'-AGCCCAGGATGCCCTTTAGT-3'
1.10 Western blot检测蛋白的表达
PASMCs以 1.5×105cells/well均匀接种于6孔板中,各组细胞干预后,通过细胞裂解液提取细胞总蛋白,通过BCA法测量样本总蛋白浓度,变性后每个样本取15 μg总蛋白进行凝胶电泳,转膜后依次进行封闭、漂洗、一抗孵育、二抗孵育,再次漂洗后Odyssey系统读取蛋白的灰度值并进行结果统计。
1.11 统计学处理
2 结果
2.1 GW501516对低氧诱导的PASMCs增殖与DNA合成的影响
与对照组相比,低氧刺激PASMCs 12、24、48 h后,其增殖与DNA合成显著增强(P<0.01),不同浓度的GW501516(10、30、100 nmol/L)干预12、24、48 h后均能够抑制PASMCs增殖与DNA合成,且GW501516抑制增殖与DNA合成具有浓度依赖性(P<0.05或P<0.01,表1, 表2)

Tab. 1 Effects of GW501516 on the proliferation of hypoxia exposed PASMCs n=6)

Tab. 2 Effects of GW501516 on the DNA synthesis of hypoxia exposed PASMCs n=6)
2.2 低氧及GW501516对PASMCs内PPARδ的表达的影响
与对照组相比,GW501516(100 nmol/L)干预PASMCs 24 h能够显著上调PPARδ的表达[(1.00±0.15)比(2.48±0.21)](P<0.01),而低氧可显著下调PPARδ的表达[(1.00±0.15)比(0.28±0.04)](P<0.01,图1 )。

Fig. 1 Effects of GW501516 and hypoxia on the expression of PPARδin PASMCs (n=6)
2.3 SC79逆转GW501516对低氧诱导PASMCs增殖与DAN合成的影响
与对照组相比,低氧刺激24 h能够明显促进PASMCs增殖与DNA合成(P<0.01),GW501516(100 nmol/L)干预能够显著抑制低氧诱导的PASMCs增殖与DNA合成(P<0.01),SC79可逆转GW501516对低氧诱导PASMCs增殖与DAN合成的抑制作用(P<0.01,表 3)。
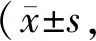
Tab. 3 SC79 reversed the inhibition of cell proliferation and DNA synthesis by GW501516 in hypoxia stimulated PASMCs n=6)
2.4 SC79逆转GW501516对PASMCs细胞周期阻滞的影响
与对照组相比,低氧处理PASMCs 24 h后其分裂增强,处于G0/G1期的PASMCs比例明显减少(P<0.01),而处于S期和G2/M期的PASMCs比例明显增多(P<0.01),与低氧组相比,GW501516(100 nmol/L)干预后PASMCs分裂减弱,处于G0/G1期的PASMCs比例增加(P<0.05),而处于S期和G2/M期的PASMCs比例显著减少(P<0.01),而与GW501516低氧组相比,SC79能够逆转GW501516 阻滞细胞周期的作用(P<0.05或P<0.01,图 2,表4)。

Fig. 2 SC79 reversed the effect of GW501516 on cell cycle progression in hypoxia exposed PASMCs (n=6)

Tab. 4 Quantification of cell percentage in different phases (%, n=6 )
2.5 SC79逆转GW501516对Cyclin D1 mRNA的表达及p27 mRNA表达的影响作用
与对照组相比,低氧处理24 h后PASMCs内Cyclin D1 mRNA的表达明显增加,同时p27 mRNA的表达明显下降(P<0.01);GW501516 (100 nmol/L)干预可显著抑制Cyclin D1的mRNA表达,同时促进p27 mRNA的表达(P<0.01),而SC79能够逆转GW501516 上述作用(P<0.01,表 5)。
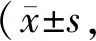
Tab. 5 SC79 reversed the effect of GW501516 on the mRNA expressions of cyclin D1 and p27,and the protein expressions of phosphorylated forms AKT and GSK3β in hypoxia stimulated PASMCs n=6)
2.6 SC79逆转GW501516对AKT/GSK3β信号通路的抑制作用
与对照组相比,低氧处理可显著促进PASMCs内磷酸化的AKT与GSK3β表达(P<0.01),与低氧组相比,GW501516(100 nmol/L)可显著抑制酸化的AKT与GSK3β表达(P<0.01),而SC79可逆转GW501516抑制酸化的AKT与GSK3β表达的作用(P<0.01,图 3 ,表5)。

Fig. 3 SC79 reversed the inactivating of AKT/GSK3β signaling pathway induced by GW501516 in hypoxia exposed PASMCs (n=6)
3 讨论
本研究发现,低氧能够下调PPARδ表达,PPARδ激动剂GW501516能够通过抑制cyclin D1表达以及促进p27的表达阻滞细胞周期于G0/G1期,抑制低氧PASMCs增殖,同时GW501516能够抑制AKT/GSK3β信号通路,而SC79能够逆转GW501516 上述作用。
前列环素(prostacyclin, PGI2)是一种内生PPARδ激动剂,PGI2及其类似物在肺动脉高压治疗中已经取得显著进展[13]。然而有关PPARδ对低氧肺血管重构的作用及机制尚不十分清楚。PASMCs异常增殖在低氧肺血管重构中发挥关键作用,抑制低氧PASMCs增殖能够抑制低氧肺血管重构缓解HPH[14]。体外培养PASMCs,建立低氧PASMCs增殖的细胞模型,是探索HPH和肺血管重构发病机制的基础[15,16]。本研究通过体外建立低氧PASMCs增殖的细胞模型发现,低氧能够下调PASMCs中PPARδ表达,PPARδ激动剂GW501516能够上调PPARδ表达,并且GW501516抑制低氧诱导的PASMCs增殖具有浓度依赖性。DNA的合成量能够反映细胞增殖水平,本研究中BrdU试剂盒检测DNA合成的结果表明,GW501516抑制低氧PASMCs内DNA合成具有浓度依赖性。因此我们推测,低氧可通过抑制PPARδ表达促进PASMCs增殖细胞。在ox-LDL诱导VSMCs增殖实验中发现GW501516能够抑制VSMCs增殖,而通过RNA干扰或PPARδ抑制剂GSK0660抑制PPARδ的表达能够逆转GW501516抑制VSMCs增殖作用[7]。通过DL-炔丙基甘氨酸(DL-propargylglycine, PAG)抑制内源性硫化氢诱导小鼠主动脉血管重构与VSMCs增殖模型中发现,PAG能够通过抑制PPARδ表达促进主动脉血管重构与VSMCs增殖,而GW501516能够抑制血管重构以及VSMCs增殖[17]。PPARδ激动剂GW0742药物涂层支架能够抑制血管内膜增生、支架术后再狭窄以及VSMCs增殖[18]。增殖受细胞周期调控,因此本研究检测GW501516对PASMCs细胞周期的影响。流式细胞仪的结果表明,GW501516可以阻滞G0/G1期细胞向S期过渡,从而抑制细胞周期进程。细胞周期蛋白依赖性激酶(CDK)2和CDK4/6与Cyclin E和Cyclin D1形成复合物后促进G0/G1期向S期转化,而细胞周期蛋白激酶抑制蛋白p27能够抑制该复合物活性抑制细胞周期进程[19,20]。本研究发现GW501516干预可抑制Cyclin D1的mRNA表达,同时促进p27 mRNA的表达。在PDGF诱导人PASMCs增殖细胞模型中,GW501516能够拮抗PDGF-BB促进Cyclin D1,抑制P27表达的作用[21]。
AKT又名PKB,主要介导细胞分化、增殖、凋亡、肥大、增生等多种生理及病理过程,AKT抑制剂AZD5363可抑制VSMCs的增殖[22]。GSK3β是AKT重要下游蛋白,其通过磷酸化失活,抑制AKT/GSK3β信号通路从而抑制PASMCs 增殖[23,24]。研究表明GSK3β调控cyclin D1从细胞核转运到细胞质,从而被蛋白酶水解,在白三烯 B4 (LTB4)诱导PASMCs增殖模型中发现通过siRNA抑制GSK3β表达可上调cyclin D1[23]。低氧能够通过活化AKT下调p27表达,诱导PASMCs增殖,而抑制AKT活化可上调p27的表达抑制低氧PASMCs增殖[25]。此外,抑制GSK3β活化可下调p27蛋白的表达[26]。本研究发现,GW501516可抑制低氧诱导AKT/GSK3β信号通路的活化。在VSMCs中过表达PPARδ能够抑制AKT磷酸化,PPARδ激动剂GW501516或GW0742能够抑制AKT磷酸化[6,27]。另外本研究还发现,AKT激动剂SC79可逆转GW501516抑制细胞增殖与DNA合成、阻滞细胞周期、调控Cyclin D1及p27的表达、抑制AKT/GSK3β信号通路活化等作用。因此推测GW501516通过抑制AKT/GSK3β信号通路抑制PASMCs的增殖。
综上所述,PPARδ激动剂GW501516能够通过抑制AKT/GSK3β信号通路抑制低氧诱导PASMCs增殖。GW501516有可能成为治疗和预防低氧肺血管重构相关疾病的新药物。本研究仅在细胞模型上研究GW501516对低氧PASMCs增殖的影响及机制,尚未在动物模型中验证GW501516对低氧肺血管重构的影响。因此后一步本研究组将在低氧诱导肺动脉高压大鼠模型上探讨GW501516对肺血管重构的影响。
