高糖培养人肾小球系膜细胞对JAK2/STAT1信号蛋白活化的影响
2011-02-27陈红敏
陈红敏 李 竞 高 凌 洪 练
高糖培养人肾小球系膜细胞对JAK2/STAT1信号蛋白活化的影响
陈红敏 李 竞 高 凌 洪 练
本文2011—02—14收到,2011—03—02修回,2011—03—04接受
糖尿病肾病(Diabetic Nephropathy,DN)是糖尿病常见微血管病变,已成为导致慢性肾衰的主要原因,其发生发展机制尚未完全明确。近年来有研究提示,Janus激酶/信号转导子与转录激活子(Janus Activated Kinase-Signal Transducer and Activator of Trancriptions,JAK/STAT)信号通路与系膜细胞的增殖、肥大及细胞外基质(Extra-cellular Matrix,ECM)分泌有关,但具体机制尚未十分清楚。本研究通过观察高糖培养人肾小球系膜细胞(HMCs)对JAK2、STATl的激活,以及对转化生 长 因 子 β1(Transforming Growth Factorβ1,TGF-β1)和纤维连接蛋白(Fibronectin,FN)mRNA表达和蛋白分泌的影响,探讨高糖如何通过HMCs的JAK2/STAT 1信号途径促进TGF-β1和FN的合成,从而加速肾脏纤维化。
1 材料与方法
1.1 主要试剂
兔抗人p-JAK2和p-STAT1单克隆抗体(购于美国 Cell Signaling Technology公司)、β-actin兔抗人多克隆抗体由美国Santa Cruz提供;辣根过氧化物酶(HRP)标记羊抗兔二抗,NC膜、RIPA裂解液、PMSF、凝胶试剂盒、BCA蛋白定量试剂盒、封闭液、一抗和二抗稀释液、ECL Plus化学发光试剂盒均购于碧云天公司;TGF-β1、FN、GAPDH 引物由上海生工合成。TGF-β1、FN ELISA试剂盒购于博士德公司。
1.2 HMCs培养和分组
HMCs购于中南大学湘雅医学院细胞库,保存于液氮中。复苏HMCs,于15%胎牛血清、1%双抗(青霉素和链霉素)DMEM培养基中培养,在5%CO2、37℃恒温培养箱内孵育,待细胞生长至亚融合状态时,更换为无血清DMEM 低糖培养基(5.6mmol/L)使细胞同步化24 h,设为低糖对照组。然后换用30mmol/L的葡萄糖培养细胞,分别于6h、12h、24h、48h(分别为高糖培养6h组、12h组、24h组和48h组)提取蛋白、RNA和收集上清液,保存于—70℃。每次检测重复3次。
1.3 RT-PCR检测 TGF—β1、FN mRNA表达
用RNA提取试剂(Trizo1)提取 HMCs总RNA,用紫外可见分光光度仪测定其纯度和含量;于反转录酶(AMV)催化下合成c DNA后进行PCR扩增;TGF-β1上下游引物分别为:5’-GGT GGA AAC CCA CAAC GAA-3’和 3’-CTA AGG CGA AAG CCC TCA AT-5’,扩增片段为321 bp;FN上下游引物分别为:5’-TAG CCC TGT CCA GGA GTT CA-3’和 3’-CTG CAA GCC TTC AAT AGT CA-5’,扩增片段为346 bp;三磷酸甘油醛脱氢酶(GAPDH)上下游引物分别为:5’-ACC ACA GTC CAT GCC ATC AC-3’和3’-TCC ACC ACC CTG TTG CTG TA-5’,扩增片段为452 bp。TGF-β1扩增条件为:94℃30 s,58℃30 s,72℃50 s,循环35次;FN 扩增条件为:94℃ 30 s,60℃ 30 s,72℃50 s循环40次。PCR产物于1.5%琼脂糖凝胶电泳,紫外灯下凝胶成像系统成像,用UVI图像分析处理系统进行吸光度扫描,以目的基因片段/GAP-DH片段的条带灰度值比值来表示其相对含量。
1.4 ELISA 检测上清液中 TGF—βl、FN 蛋白含量
取HMCs培养的上清液,按照ELISA试剂盒说明书进行TGF—βl、FN浓度测定。
1.5 Western blotting检测p-JAK2、p-STAT1蛋白的表达
(1)RIPA裂解液冰上裂解细胞,取上清;(2)BCA法测定上清蛋白浓度;(3)取细胞裂解蛋白50 μɡ,经8%十二烷基硫酸钠—聚丙烯酰胺凝胶电泳(SDS-PAGE)后电转移至硝酸纤维素膜(NC膜),封闭液封膜2h,加兔抗人 p-JAK2、p-STAT1抗体(1∶800稀释),4℃过夜,TBST洗膜后加 HRP标记的羊抗兔抗体(1∶5000稀释)孵育1h、TBST洗膜后加ECL试剂,将NC膜压片、显影、定影。用美国UVP公司abworks 4.5分析系统软件对电泳条带进行定量分析,测定杂交条带的吸光度(A)值。
1.6 统计学处理
2 结 果
2.1 高糖培养HMCs不同时间对TGF-β1 mRNA表达的影响(图1、表1)
与低糖对照组比较,高糖各组TGF-β1 mRNA表达上调,除6h外,12h、24h、48h差异均有显著性意义(P<0.01);并随作用时间延长,其表达逐渐增加。
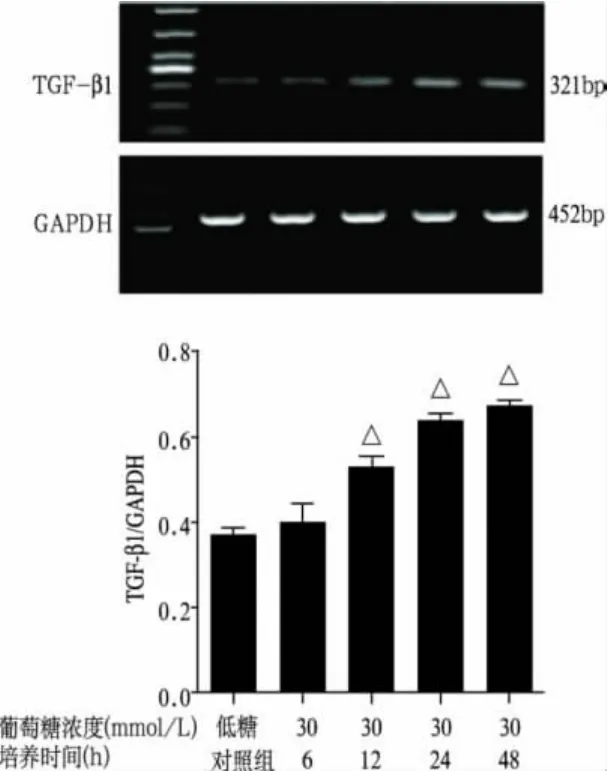
注:与低糖对照组比较,△P<0.01图1 高糖培养HMCs不同时间对TGF-β1 mRNA的影响
2.2 高糖培养HMCs不同时间对FN mRNA表达的影响(表1、图2)
与低糖对照组比较,高糖各组FN m RNA表达上调,除6h和12h外,24h和48 h与其差异均有显著性意义(P<0.01)。
表1 高糖培养HMCs不同时间对TGF—β1、FN mRNA的影响(灰度比值,±s,n=3)

表1 高糖培养HMCs不同时间对TGF—β1、FN mRNA的影响(灰度比值,±s,n=3)
注:与低糖对照组比较,1)P<0.01
组 别 T G F-β 1 0.3 7±0.0 1 0.4 0±0.0 6培养6 h组 0.4 0±0.0 4 0.4 9±0.0 4培养1 2 h组 0.5 3±0.0 2 1) 0.5 1±0.0 3培养2 4 h组 0.6 4±0.0 2 1) 0.7 6±0.1 2 1)培养4 8 h组 0.6 7±0.0 1 1) 0.8 2±0.1 5 1)低糖对照组F N
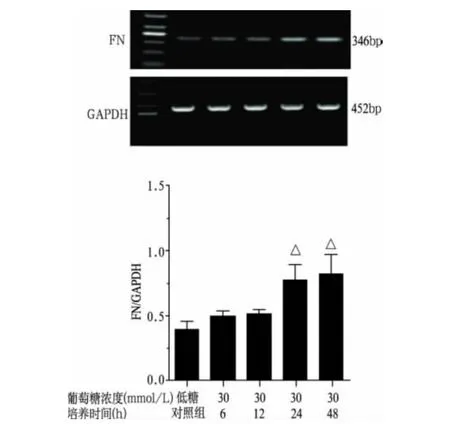
图2 高糖培养HMCs不同时间对FN mRNA的影响
2.3 高糖培养HMCs不同时间对上清液中TGF-β1、FN蛋白含量的影响(表2)
与低糖对照组比较,高糖各组上清液中TGF-β1、FN含量增高,除6h和12h外,其余各组差异均具有显著性统计学意义(P<0.01),随时间延长,其表达逐渐增加,48h达到高峰。其中,TGF-β1在24h和48h之间无显著性差异,而FN在24h和48h之间差异具有统计学意义(P<0.01)。
表2 高糖培养HMCs不同时间对TGF—β1、FN蛋白含量的影响(±s,n=3)

表2 高糖培养HMCs不同时间对TGF—β1、FN蛋白含量的影响(±s,n=3)
组 别 TGF-β1(pg/ml) FN(ng/ml)274.48±10.28 44.13±2.29培养6h组 284.07±13.06 47.98±4.81培养12h组 294.65±13.11 58.31±6.40培养24h组 316.07±27.201) 95.57±10.911)培养48h组 324.40±16.691) 166.74±16.351)2)低糖对照组
注:与低糖对照组比较,1)P<0.01;与培养24h组相比,2)P<0.01
2.4 高糖培养HMCs不同时间对p-JAK2蛋白表达的影响(图3)
与低糖对照组比较,高糖各组p-JAK2表达增高,24h时达到高峰,48h有所回落。
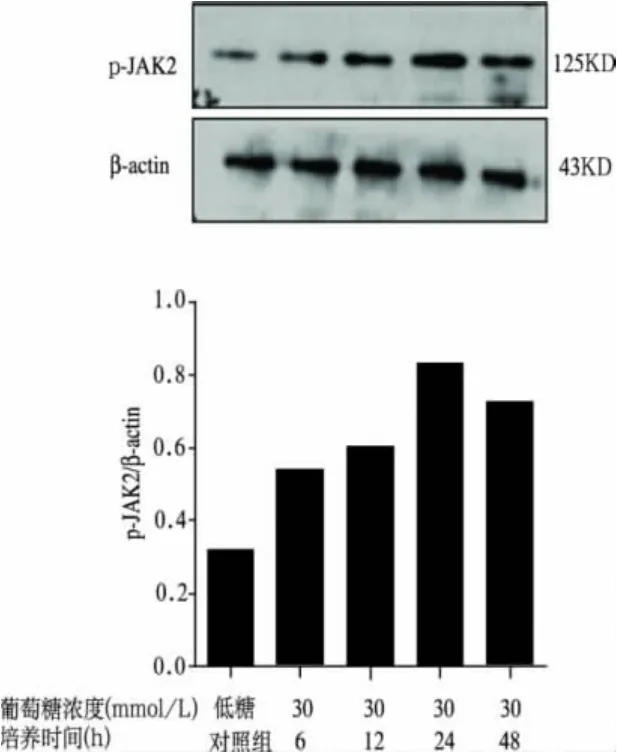
图3 高糖培养HMCs不同时间对p-JAK2蛋白的影响
2.5 高糖培养HMCs不同时间对p-STAT1蛋白表达的影响(图4)
与低糖对照组比较,高糖各组p-STAT1表达增高,并随着时间延长,其表达水平逐渐增加,48h达到高峰。
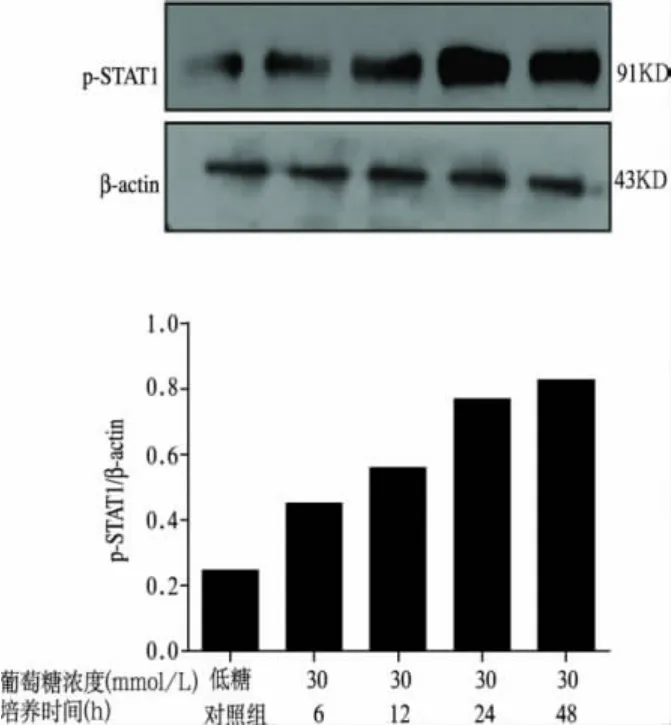
图4 高糖培养HMCs不同时间对p-STAT1蛋白的影响
3 讨 论
DN是糖尿病常见微血管病变,是导致慢性肾衰的主要病因之一。DN的发病机制尚不十分清楚,ECM的累积和肾脏纤维化是其主要病理改变[1],而 细 胞 因 子 TGF-β1、结 缔 组 织 生 长 因 子(Connective Tissue Growth Factor,CTGF)等在ECM累积和肾脏纤维化过程中发挥着不可忽视的作用[2]。
TGF-β1是调节系膜细胞ECM积聚的重要细胞因子。一方面,TGF-β1可以刺激ECM蛋白成分(FN、胶原蛋白)的产生;另一方面,它能抑制蛋白酶的分泌,减少ECM蛋白的降解。在糖尿病患者和动物模型中,肾小球中TGF—β1 mRNA水平和基质成分较正常者显著增高,如肾小球基底膜增厚和系膜外基质的扩增[3],高糖体外培养 HMCs,TGF-β1和FN表达显著增加[4]等。本实验结果显示:与低糖对照组比较,高糖培养人肾小球系膜细胞,TGF-β1、FN mRNA和蛋白水平显著增高,在培养48h左右达到高峰。高糖环境中系膜细胞TGF-β1和FN的合成增多,可能与高糖活化蛋白激酶C(Protein Kinase C,PKC)的一个或多个亚型有关[5]。
JAK/STAT途径是近年来新发现的一条信号转导途径,可以发挥信号转导和基因转录活化子蛋白的双重作用,介导多种细胞因子和生长因子细胞内信号转导过程,并活化相应靶基因,从而发挥生物学效应。近年来研究发现JAK/STAT信号通路的激活可以刺激肾小球系膜细胞过度增殖和增生,导致DN[6]。在 DN 患者肾小球和肾小管中,JAK/STAT通路显著上调,其中JAK1、JAK2、JAK3、STAT1、STAT3的表达较正常患者明显增高[7]。在NRK-49F细胞中,糖基化终末产物可以促进JAK2的磷酸化,进而激活STAT1、STAT3;加入JAK2特异抑制剂AG-490,STAT1和STAT3的活性减低,胶原蛋白的合成减少,从而减少ECM累积[8]。Wang等[9]研究表明:高糖可激活肾小球系膜细胞JAK2、STAT1、STAT3、STAT5活性,但其可能是通过激活JAK2/STAT1信号蛋白刺激TGF-β1和FN合成,导致ECM的累积和肾脏纤维化,而非JAK2/STAT3、STAT5信号通路。本实验观察JAK2/STAT1信号蛋白途径在ECM聚集的作用,结果表明:高糖培养时,HMCs的JAK2、STAT1磷酸化蛋白水平较低糖对照组显著增加,并分别在高糖作用24h和48h达到较高水平。对JAK2的这种活化效果,有研究认为其可能与高糖促进活性氧(Reactive Oxygen Species,ROS)的产生有关[10,11]。
JAK2/STAT1通路影响 TGF-β1合成的机制尚不十分清楚。有文献提示,JAK2/STAT1信号通路活化后可能通过促进核因子(c-jun、c-fos)基因的表达来增加TGF-β1和FN的合成[6]。jun、fos基因分别编码的Jun和Fos蛋白嵌合成二聚体复合物活化蛋白1(Activator Protein-1,AP-1),而 TGF-β受体的基因启动子含有AP-1的结合位点[12]。由此推测,HMCs经高糖促进ROS的合成而激活JAK2/STAT1通路,进而促进相关核转录因子(如AP-1)活化、TGF-β1基因转录等一系列变化,最终引起ECM的大量聚集,加速肾脏纤维化。
综上,高糖作用下 HMCs中 TGF-β1、FN mR-NA和蛋白水平的升高与JAK2/STAT1磷酸化密切相关。更进一步说明JAK/STAT信号途径可能在DN发病过程中发挥重要作用,进而为DN的预防和治疗提供又一个靶点。
本文第一作者简介:
陈红敏(1985~),女,汉族,硕士研究生,研究方向:糖尿病肾病的发病机制
1 Raptis AE,Viberti G.Pathogenesis of diabetic nephropathy.Exp Clin Endocrinol Diabetes,2001,109(2):S424~S437.
2 Flyvbjerg A.Putative pathophysiological role of growth factors and cytokines in experimental diabetic kidney disease.Diabetolo-gia,2000,43(10):1 205~1 223.
3 Chen S,Jim B,Ziyadeh FN.Diabetic nephropathy and transfor-ming growth factor-beta:transforming our view of glomerulo-sclerosis and fibrosis build-up.Semin Nephrol,2003,23(6):532~543.
4 Lin CL,Wang JY,Ko JY,et al.Dickkopf-1 promotes hypergly—cemia-induced accumulation of mesangial matrix and renal dys-function.J Am Soc Nephrol,2010,21(1):124~135.
5 Kapor-Drezgic J,Zhou X,Babazono T,et al.Effects of high glu-cose on mesangial cell protein kinase C-delta and-epsilon is polyol pathway-dependent.J Am Soc Nephrol,1999,10(6):1 193~1 203.
6 Marrero MB,Banes Berceli AK,Stem DM,et al.Role of the JAK/STAT signaling pathway in diabetic nephropathy.Am J Fhysiol Renal Physiol,2006,290(4):F762~F768.
7 Berthier CC,Zhang H,Schin M,et al.Enhanced expression of Ja-nus kinase-signal transducer and activator of transcription path-way members in human diabetic nephropathy.Diabetes,2009,58(2):469~477.
8 Huang JS,Guh JY,Chen HC,et al.Role of receptor for advance glycation end-products(RAGE)and the JAK/STAT-signaling pathway in AGE-induced collagen production in NRK-49F cells.J Cell Biochem,2001,81(1):102~113.
9 Wang X,Shaw S,Amiri F,et al.Inhibition of the JAK/STAT signaling pathway prevents the high glucose-induced increase in tgf-beta and fibronectin synthesis in mesangial cells.Diabetes,2002,51(12):3 505~3 509.
10 Ha H,Lee HB.Reactive oxygen species as glucose signaling mole-cules in mesangial cells cultured under high glucose.Kidney Int,2000,58(77):S19~S25.
11 Schieffer B,Luchtefeld M,Braun S,et al.Role of NAD(P)H oxidase in angiotensin II-induced JAK/STAT signaling and cy—tokine induction.Circ Res,2000,87(12):1 195~1 201.
12 Chuang LY,Guh JY,liu SF,et al.Regulation of typeⅡtransfor-ming growth factor-bete receptors by protein kinase C iota.Bio-chem J,2003,375(2):385~393.
高糖培养人肾小球系膜细胞对JAK2/STAT1信号蛋白活化的影响
陈红敏,李 竞,高 凌,等/武汉大学人民医院内分泌科,武汉430060
目的:观察高糖对人肾小球系膜细胞(HMCs)Janus酪氨酸激酶2(JAK2)、信号转导和转录活化因子1(STAT1)以及转化生长因子—β1(TGF-β1)和纤维连接蛋白(FN)表达的影响。方法:将HMCs于高糖(30mmol/L)环境下培养不同时间后,Western blotting检测磷酸化JAK2、STAT1(p-JAK2、p-STAT1)水平;RT-PCR 检测TGF-β1和FN mRNA的表达;ELISA测定上清液中 TGF-β1和FN的含量,同时以低糖组作为对照。结果:与低糖对照组比较,高糖培养 H MCs p-JAK2、p—STAT1蛋白明显上调,TGF-β1和FN mRNA表达和蛋白水平显著增加(P<0.01)。结论:高糖能通过激活HMCs中JAK2/STAT1信号途径,促进TGF—β1和细胞外基质分泌。
糖尿病肾病 细胞外基质 Janus酪氨酸激酶/信号转导和转录活化因子
人肾小球系膜细胞 高糖
Effect of High Concentration of Glucose on the Activation of Janus Kinase 2/Signal Transducers and Activators of Transcription 1(JAK2/STAT1)in Human Glomerular Me-sangial Cells
Chen Hongmin,Li Jing,Gao Ling,et al/Department of Endocrinology,Renmin Hospital of Wu-han Universty,Wuhan 430060
Objective:To investigate the effect of high concentration of glucose on the activation of janus kinase 2(JAK2)signal transducers and activa-tors of transcription 1(STAT1)and on the expression of transforming growth factor-β1(TGF-β1)and fibronectin (FN)in human glomerular mesangial cells(H MCs).Method:HMCs were treated with high glucose(30mmol/L glucose)for different time respectively.Tyrosine phosphoryl-ation of JAK2(p-JAK2)and STAT1(p-ATAT1)protein were detected by Western blotting.TGF-β1and FN mRNA was assessed by semi-quantita-tive reverse transcription and polymerase chain reaction(RT-PCR).The protein synthesis of TGF-β1 and FN in the supernatants were determined by enzyme-linked immunoadsorbent assay(ELISA)low glucose as control group.Results:Compared with control group,the expression of p-JAK2,p-STAT1,TGF-β1mRNA,FN mRNA and the protein level of TGF-β1,FN were significantly incresed in HMCs under high concentration of glu-cose.Conclusion:Under high concentration of glucose,the overproduction of TGF-β1and FN in HMCs partly be attributable to the phosphorylation of JAK2/STAT1.
Diabetic nephropathy;Extracellular matrix;Janus ki-nase/signal transducers and activators of transcrip—tion;Human glomerular mesangial cell;High glucose
R587.2
A
1005—1740(2011)02—0023—04
武汉大学人民医院内分泌科,邮政编码 武汉430060; 通讯作者:李 竞,E-mail:lijing7823@hotmail.com
·医研动态·
