高糖培养人肾小球系膜细胞对TGF-β1、FN、Smad7表达的影响
2011-02-27陈红敏
洪 练 李 竞 高 凌 陈红敏
高糖培养人肾小球系膜细胞对TGF-β1、FN、Smad7表达的影响
洪 练 李 竞 高 凌 陈红敏
本文2010—12—14收到,2011—03—02修回,2010—03—04接受
糖尿病肾病(Diabetic Nephropathy,DN)是糖尿病最常见的微血管并发症,是导致终末期肾病和糖尿病患者死亡的主要原因[1],虽然糖尿病患者的高血糖、高血脂、高血压有很多好的治疗控制方法,但DN的发病率仍然居高不下。因此,研究DN的发生机制和治疗方案是临床亟待解决的问题。Smad蛋白是目前唯一所知的转化生长因子—β1(TGF-β1)的 胞 内 信 号 转 导 因 子[2],Smad7 是TGF-β1/Smad信号转导途径的负反馈调节因子,在DN的发病过程中,Smad7的表达失衡可能是致病环节之一。本文通过体外实验,观察高糖状态下TGF-β1、纤维连接蛋白(FN)增多的同时,Smad7表达的变化,探讨Smad7在细胞外基质(Extracellular Matrix,ECM)沉积中的作用。
1 材料与方法
1.1 主要试剂及仪器
FN、TGF-β1 ELISA试剂盒购自中国博士德公司;逆转录试剂盒、PCR试剂盒由立陶宛Fer-mentas公司提供;Smad7多克隆抗体、β-actin兔抗人多克隆抗体由美国Santa Cruz公司出品;辣根过氧化物酶(HRP)标记抗羊抗兔二抗,NC膜、RIPA裂解液、PMSF、凝胶试剂盒、BCA蛋白定量试剂盒、封闭液、一抗二抗稀释液、ECL Plus化学发光试剂盒均为碧云天公司产品;TGF-β1、FN、GAPDH 引物由上海生工合成;T Personal型PCR仪由德国Biometra公司生产;Gel Doc2000凝胶成像扫描分析系统由美国Biorad公司出品。
1.2 细胞培养和分组
人肾小球系膜细胞(HMCs)购自中南大学湘雅医学院,以含15%的胎牛血清及含青霉素和链霉素(100μg/L)的DMEM 低糖(5.6mmol/L)培养基,置37℃孵箱(5%CO2)培养,2~3天换液1次。按0.3×106/孔密度将上述细胞均匀接种于6孔培养板中,80%融合后换无血清DMEM低糖培养基继续培养24h以同步化细胞,作为低糖培养对照组;随后换30mmol/L高糖培养基继续培养24h、48h、72h,分别为高糖培养24h组、48h组和72h组,后分别收集上清液并提取蛋白、RNA;—70℃保存备用。
1.3 RT-PCR检测 TGF—β1、FN、Smad7mRNA表达
Trizol试剂盒一步法提取各组细胞总RNA,取2μg,用逆转录试剂盒合成cDNA,取1μl逆转录产物,应用特异性 TGF-β1、FN、Smad7及 GAPDH 引物行PCR扩增。TGF-β1引物:上游引物5’-GGT GGA AAC CCA CAA CGA A-3’,下游引物5’-CTA AGG CGA AAG CCC TCA AT-3’,终产物为321bp。Smad7引物:上游引物5’-AGC AGG CCA CAC ACT TCA AACT -3’,下游引物 5’-CAC GTT GTC TCC CCA TCT G-3’,终产物为375bp。FN引物:上游引物5’-TAG CCC TGT CCA GGA GTT CA-3’,下游引物5’-CTG CAA GCC TTC AAT AGT CA -3’,终产物为346bp。GAPDH引物:上游引物5’-ACC ACA GTC CAT GCC ATC AC-3’,下游引物5’-TCC ACC ACC CTG TTG CTG TA-3’,终产物为452bp。TGF-β1反应条件:94℃预变性5 min,然后94℃30s、58℃30s、72℃50s循环35次,最后72℃延伸10 min;Smad7反应条件:94℃预变性5 min,然后94℃40 s、56℃30s、72℃50s循环35次,最后72℃延伸10 min;FN反应条件:94℃预变性5 min,然后94℃30s、60℃30s、72℃50s循环40次,最后72℃延伸10 min。PCR产物以2.0%琼脂糖凝胶电泳,应用凝胶电泳图像扫描分析系统进行分析,以目的基因片段与GAPDH片段的条带灰度比值表示相对含量。
1.4 ELISA检测 TGF—β1、FN蛋白表达
收集培养不同时间的HMCs上清液,依照试剂盒说明的方法测定其TGF—β1、FN浓度。每份标本均设3个复孔,以其均值代表实验数值。
1.5 Western blotting检测Smad7蛋白表达
用BCA蛋白质分析试剂盒测定总蛋白浓度。取总蛋白75μg经12%十二烷基硫酸钠—聚丙烯酰胺凝胶电泳后转移至硝酸纤维素膜,用丽春红染色观察转移效果并标示相对分子量标准。然后用含5%脱脂奶粉的TBST室温封闭1h。洗膜后加入Smad7抗体(1∶800稀释),4℃过夜。再用辣根过氧化酶标记的羊抗兔多抗(1∶5000稀释)杂交1h;洗膜后加ECL(增强化学发光),最后将硝酸纤维膜放入X线片暗盒,压片、显影、定影。用分析系统软件对条带进行定量分析,测定杂交条带的吸光度。
1.6 统计学处理
2 结 果
2.1 高糖培养 HMCs不同时间对 TGF-β1、FN、Smad7 m RNA表达的影响
本试验中所提取RNA经琼脂糖凝胶电泳鉴定,28S、18S、5S清晰可见,A260/A280在1.8~2.0,提示所提RNA结构完整,纯度较高。各组TGF-β1、FN mRNA表达结果见表1、图1和图2。统计学分析表明,高糖培养各组TGF—β1、FN mRNA表达均较低糖对照组显著升高(P<0.01);TGF-β1 mRNA表达在培养48h达到高峰;FN mRNA表达随着高糖培养时间的延长而逐渐升高。Smad7 mR-NA表达结果见表1和图3。随着高糖培养时间的延长,Smad7 mRNA表达较低糖对照组下降,从48h开始两者差异有统计学意义(P<0.05)。
表1 高糖培养HMCs不同时间后TGF—β1、FN、Smad7 mRNA的表达结果(灰度比值,±s,n均=3)

表1 高糖培养HMCs不同时间后TGF—β1、FN、Smad7 mRNA的表达结果(灰度比值,±s,n均=3)
注:与低糖对照组比较,1)P<0.05,2)P<0.01
组 别 TGF-β1 0.37±0.01 0.40±0.06 0.78±0.12培养24h组 0.64±0.022) 0.78±0.172) 0.64±0.10培养48h组 0.67±0.012) 0.82±0.142) 0.60±0.141)培养72h组 0.64±0.012) 0.91±0.172) 0.59±0.131)FN Smad7低糖对照组
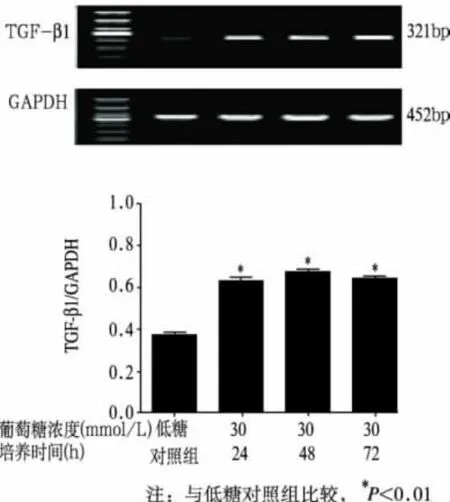
图1 高糖培养HMCs不同时间对TGF—β1 mRNA表达的影响
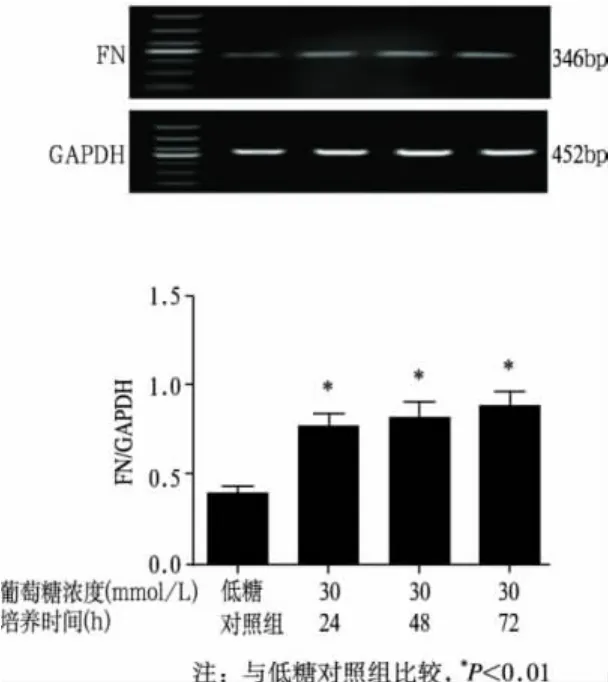
图2 高糖培养HMCs不同时间对FN mRNA表达的影响

图3 高糖培养HMCs不同时间对Smad7 mRNA表达的影响
2.2 高糖培养 HMCs不同时间对TGF—β1、FN蛋白浓度的影响
与低糖对照组相比,高糖各组TGF-β1、FN蛋白浓度均明显升高(P<0.05,P<0.01);TGF-β1在48h到达高峰,FN浓度随培养时间延长而升高。见表2。
表2 高糖培养HMCs不同时间后TGF—β1和FN蛋白浓度变化(±s,n均=3)

表2 高糖培养HMCs不同时间后TGF—β1和FN蛋白浓度变化(±s,n均=3)
注:与低糖对照组比较,1)P<0.05,2)P<0.01
组 别 TGF-β1(pg/ml) FN(ng/ml)低糖对照组274.48±10.28 44.13±2.29培养24h组 316.07±27.202) 95.57±10.912)培养48h组 324.40±16.892) 166.74±16.342)培养72h组 314.23±19.771) 236.94±13.202)
2.3 高糖培养HMCs不同时间对Smad7蛋白表达的影响
与低糖对照组比较,高糖培养各组Smad7蛋白表达均下降,差异具有统计学意义(P<0.05,P<0.01)见图4。
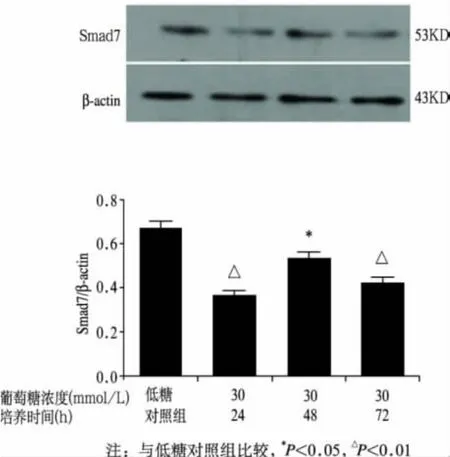
图4 高糖培养HMCs不同时间对Smad7蛋白表达的影响
3 讨 论
DN是糖尿病微血管并发症之一,也是尿毒症的主要病因之一。肾小球ECM累积所致的肾小球硬化对DN患者肾功能衰竭的进展有着非常重要的意义。FN是ECM的主要组成成分,在正常肾组织中主要分布于肾小球系膜区,对维持肾小球正常结构起重要作用。Van Det等[3]研究发现葡萄糖浓度升高可刺激HMCs的FN m RNA表达及FN蛋白合成,这种作用通过TGF介导,在很大程度上依赖于内源性 TGF—β1活性的增高,而抗 TGF—β1中和抗体可在蛋白质或mRNA水平逆转这种效应[4]。研究发现TGF—β1是致肾纤维化的核心因子,参与肾小球硬化的各个环节。活化的TGF-β1可能增加基质蛋白的合成(如胶原蛋白、FN、糖蛋白)和分泌,加强细胞黏附蛋白受体的转录、翻译和处理,减少基质降解蛋白酶的合成,增加这些蛋白酶特异抑制物的合成,从而对组织细胞的形态、增殖和分化过程起到重要作用[5,6]。郭鹏等[7]在糖尿病大鼠模型的 肾小球及肾小管中发现TGF—β1表达较正常组增加;Yamamoto等[8]测定53例不同肾病组织中 TGF—β1 mRNA水平时发现,微小病变肾组织的TGF-β1 m RNA表达与正常组织没有明显差异,而以ECM积聚为特征的DN、局灶节段增生性肾小球硬化、新月体性肾小球肾炎等的肾小球TGF—β1 m RNA水平显著增高。
本实验通过高糖培养HMCs,发现TGF—β1和FN的mRNA和蛋白表达较低糖对照组显著增加,这与以上的研究相一致。但Smad7的表达量却较低糖对照组减少。Smad蛋白是目前唯一所知的TGF-β胞 内 信 号 转 导 因 子,Smad7 在 TGF—β1/Smad信号转导通路中起主要的负反馈作用,是细胞中TGF-βⅠ型受体(TβRⅠ)丝氨酸/苏氨酸激酶的拮抗蛋白,能牢固地与TβRⅠ结合,使之无法将Smad 2/3磷酸化而阻断信号转导过程;另一方面,Smad7可阻止TGF-β依赖的Smad 2/4复合体的形成,从而抑制Smad2向细胞核转运,以减少Smad2介导启动的FN基因的表达;此外,Smad7还可募集Smad-泛素化调节因子(Smurf l和 Smurf 2)至TGF-β受体,促进TGF-β受体发生蛋白酶降解,从而发挥负调控作用[9]。Hong等[10]在研究db/db小鼠的TGF-β1/Smad信号转导通路时发现,与对照组相比,TGF-β1及TβRⅡ除在肾小球、肾小管表达增多外,smad2/3蛋白在其细胞浆及细胞核表达也增多,但Smad7表达却减少。本实验中HMCs在高糖刺激下,TGF-β1和FN表达增加,而Smad7表达减少,在同样以纤维化病变为特征的皮肤、肝脏、肺脏疾病中也发现Smad7表达的减少,结合前述的研究成果,笔者认为Smad7表达的减少在一定程度上导致了FN表达的增加,参与了DN的发生。对Smad7在DN中的表达变化进行深入研究,将进一步有助于阐明DN的发生机制,并在此基础上探寻新的防治DN的措施。
本文第一作者简介:
洪 练(1985~),女,汉族,硕士研究生,研究方向:糖尿病肾病的发病机制
1 Chan JC,Malik V,Jia W,et al.Diabetes in Asia:epidemiology,risk factors,and pathophysiology.JAMA,2009,301(20):2 129~2 140.
2 Massague J,Chen YE.Controlling TGF-βsignaling.Genes De-velopment,2000,14(6):627~644.
3 Van Det NF,Verhagen NA,Tamsma JT,et a1.Regulation of glomerular epithelial cell production of fibronectin and transfor-ming growth factor-βby high glucose,not by angiotensinⅡ.Dia-betes,1997,46(5):834~840.
4 Sharma K,Jin Y,Guo J,et a1.Neutralization of TGF-βby anti-TGF-βantibody attenuates kidney hypetrophy and the enhanced extracellular matrix gene expression in STZ-induced diabetic mice.Diabetes,1996,45(4):522~530.
5 尹永红,赵久阳,吕 申.糖尿病肾病中TGF-β的作用.国外医学泌尿系统分册,2005,25(5):704~707.
6 Border WA,Noble NA.Transforming growth factor beta in tissue fibrosis.New England Journal Med,1994,331(19):1 286~1 292.
7 郭 鹏,欧阳静萍,毛先晴.黄芪多糖对链唑脲霉素诱导的2型糖尿病大鼠肾脏 TGF-β1表达的影响.微循环学杂志,2007,17(2):8~10.
8 Yamamoto T,Noble NA,Cohen AH,et al.Expression of transfor-ming growth factor beta isoforms in human glomerular diseases.Kid-ney International,1996,49(2):461~469.
9 Inoue Y,Imamura T.Regulation of TGF-βfamily signaling by E3 ubiquitin ligases.Cancer Science,2008,99(11):2 107~2 112.
10 Hong SW,Isono M,Chen S,et al.Increased glomerular and tu-bular expression of transforming growth factor-beta,its type l receptor,and activation of the Smad signaling pathway in the db/db mouse.Am J Pathol,200l,158(5):1 653~1 663.
高糖培养人肾小球系膜细胞对TGF—β1、FN、Smad7表达的影响
洪 练,李 竞,高 凌,等/武汉大学人民医院内分泌科,武汉430060
目的:通过观察高糖对人肾小球系膜细胞(H MCs)转化生长因子—β1(TGF-β1)、纤维连接蛋白(FN)、Smad7表达的影响,探讨糖尿病肾病(DN)的发病机制。方法:将HMCs于高糖(30mmol/L)环境培养不同时间后,采用 RT-PCR方法检测TGF-β1、FN、Smad7 mRNA 表达,Western blotting检测Smad7蛋白的表达,采用ELISA检测TGF—β1、FN蛋白水平,同时以低糖培养作为对照组。结果:高糖培养24h、48h、72h后,TGF-β1mRNA及蛋白的表达均较低糖培养对照组增加,在48h时达到高峰;FN m RNA及蛋白的表达亦较对照组增加,且呈时间依赖性;而Smad7 mRNA及蛋白表达下降。结论:TGF-β1/Smad信号转导途径负反馈调节Smad7蛋白的表达减少,可能是DN发病过程中的重要环节之一。
Effect of High Glucose on Transforming Growth Factor-β1,Fibronectin and Smad7 Expression in Human Glomer-ulus Mesangial Cells
Hong Lian,Li Jing,Gao Ling,et al/Department of Endocrinology,Renmin Hospital of Wuhan University,Wuhan 430060
Diabetic nephropathy; TGF-β1; Fibronectin;Smad7;Human glomerulus mesangial cell
R587.2 R692.6
A
1005—1740(2011)02—0013—04
武汉大学人民医院内分泌科,邮政编码 武汉430060; 通讯作者:李 竞,E-mail:lijing7823@hotmail.com
book=2011,ebook=19
Objective:To explore the effect of high glucose on transforming growth factor-β1(TGF-β1),fibronectin(FN)and Smad7 expression in hu-man glomerulus mesangial cells(H MCs).Method:HMCs were grown in DMEM medium containing 30mmol/L high glucose for some time(24h,48h,72h).The expression of TGF-β1,FN,Smad7 mRNA were detected by RT-PCR and western blotting were used to detect the expression of Smad7 while the supernatant level of TGF-β1 and FN were detected by ELISA.Results:In HMCs induced by high glucose,the mRNA and pro-tein expression of TGF-β1 were improved and come to the most after 48h,the mRNA and protein expression of FN were up-regulated in a time-dependent manner,however Smad7 was down-regulated.Conclu-sion:High glucose can stimulate the expression of extracellular matrix excessively,to some degree,it may owe to the reduction of Smad7 which is a major I-Smad in TGF-β1/Smad signaling pathway.
糖尿病肾病 转化生长因子—β1 纤维连接蛋白 Smad7 人肾小球球系膜细胞/高糖培养
