烃基黄药捕收剂的生物降解性评价
2011-02-06陈绍华龚文琪梅光军陈晓东鄢恒珍
陈绍华,龚文琪,梅光军,陈晓东,鄢恒珍
(武汉理工大学 资源与环境工程学院,湖北 武汉,430070)
烃基黄药捕收剂的生物降解性评价
陈绍华,龚文琪,梅光军,陈晓东,鄢恒珍
(武汉理工大学 资源与环境工程学院,湖北 武汉,430070)
借鉴表面活性剂等有机污染物的生物降解性评价体系,采用 BOD5/CODCr法、静置烧瓶试验法和OECD−301B(ISO 9439)标准对烃基黄药的生物降解性进行评价,考察分子结构对生物降解度的影响,探讨烃基黄药的生物降解机理。研究结果表明:乙基、正丁基、正戊基、异丙基、异丁基黄药的BOD5与CODCr质量浓度之比即ρ(BOD5)/ρ(CODCr)均小于0.25,第28 d生物降解度分别为39.54%,36.88%,34.09%,29.17%和26.79%,生物降解指数分别为101.020 0,99.019 9,88.717 5,79.125 6和71.897 5,上述几种黄药对微生物的抑制时间分别为12,13,15,17和18 d。这3种评价方法得出的结论是一致的,即上述几种黄药基本上是难生物降解的,其生物降解能力由大至小依次为:乙基黄药、正丁基黄药、正戊基黄药、异丙基黄药和异丁基黄药;相对于碳链长度,分支度对黄药的生物降解性的影响更加显著,CS2,ROCSSH和单硫代碳酸盐是黄药生物降解的主要产物,同时,有少量油状液滴双黄药生成。
烃基黄药;生物降解性;分子结构;机理
随着矿业的发展,浮选药剂用量越来越大。黄药是最常用的捕收剂,具有毒性和刺激性臭味,被黄药污染的水体呈现异嗅,并易造成硫污染;所以,应对选矿废水中的剩余黄药进行处理,使其达标排放,以保护矿山生态环境[1−2]。目前,国内外对浮选废水的污染治理主要采用物理、化学方法,然而,这些方法有明显的不足,如能耗和药剂消耗量大,易产生二次污染等[3−4]。针对这一现状,对黄药进行生物降解性评价,研究其生物降解规律,了解其生物降解难易程度,为研制高效、低毒、低污染的环境友好型选矿药剂提供一定的依据,对选矿废水的有效处理具有重要的意义。迄今为止,国内外基本上没有涉及黄药的生物降解性研究。国内外现有的研究仅集中在对黄药的光降解和对黄药所含有害物质的分析检测方面,而对其生物降解性和生态安全性研究少有报道。但国内外对润滑油[5]、表面活性剂[6]、农药[7]等有机污染物的生物降解性及生态安全性评价较多,并已建立相应生物降解性评价标准及环境安全性评价模式。有机物生物降解性评价方法有许多,其中:BOD5/CODCr法简单方便,是最常用的一种方法;静置烧瓶试验法完全模拟静止的自然水体,是最接近自然状态的一种降解方式;OECD−301B(ISO 9439)[8]标准是用二氧化碳生成量(PCD)作为有机物生物降解性测试指标,不受硝化作用、微生物细胞吸附作用和无机还原性物质对测试结果的影响[9],而且从对环境污染的角度看,有机物转化为CO2和H2O最彻底,因而也最有意义。在此,本文作者借鉴表面活性剂等有机污染物的生物降解度评价标准,采用 BOD5/CODCr法、静置烧瓶试验法和OECD−301B(ISO 9439)标准对烃基黄药的生物降解性进行评价。
1 实验
1.1 试剂与仪器
试剂为:乙基黄药、异丙基黄药、正丁基黄药、异丁基黄药、正戊基黄药(工业级,经提纯后使用),株洲选矿药剂厂生产;油酸钠及其他化学试剂(分析纯)。
仪器为:恒温水浴锅、磁力搅拌器、增氧泵、UV−3000型紫外分光光度计(扫描精确度为0.1 nm)、Sartorius BS210S型电子天平、LG10−2.4A型高速离心机。
1.2 实验方法
1.2.1 BOD5/CODCr法
BOD5采用国标法(GB/T 7488—1987)测定,CODCr质量浓度ρ(CODCr)采用快速消解分光光度法(HJ/T 399—2007)进行测定。
1.2.2 静置烧瓶筛选试验法
(1) 稀释水的制备。取一定量的蒸馏水,加入体积分数为10%的生活污水上清液,并加入适量的尿素和三磷酸五钠,使尿素和三磷酸五钠的质量浓度分别为5.0 mg/L和1.6 mg/L,搅匀后置于通风处3 d后使用。
(2) 实验方法。以10 mL经沉淀后生活污水的上清液作接种物,90 mL含有5 mg酵母膏和适量被测物的 BOD5稀释水为基质,使被测物的质量浓度为 10 mg/L。在室温下静置培养,1周后取该培养液10 mL作为下一周培养的接种物,并加入新鲜培养液进行再培养,如此重复,连续4周[10]。在每个培养期的开始及终了取样,高速离心后用紫外分光光度法测定被测物质在最大吸收波长处的吸光度,求其质量浓度,并由下式计算其生物降解度:式中:D为n天后黄药生物降解度,%;ρo和ρn分别为降解初始和降解n天后降解液中黄药的质量浓度,mg/L。

其最终的生物降解度以第4次再接种时的降解度表示,并做2次重复实验,其结果以平均值表示。
1.2.3 OECD−301B(ISO 9439)法(PCD 法)
(1) 试验装置。生物降解试验流程如图 1所示,实验装置分为以下几部分:① 除气装置A,去除进气中的CO2,采用NaOH溶液进行吸收;② CO2气体检测装置 B,检验进气中的 CO2是否去除完全,用Ba(OH)2溶液检验;③ 洗气装置W,用蒸馏水洗脱气体中的碱性成分;④ 缓冲装置E,保持气流稳定;⑤生物降解反应和磁力搅拌装置 ⑥ CO2气吸收装置D,用Ba(OH)2溶液吸收降解过程中产生的CO2。
(2) 营养液。营养液成分[8,11]包含下列4种溶液。

⑤ 营养液的含量:磷酸盐溶液含量为10 mL/L,氯化钙溶液、硫酸镁溶液、氯化铁溶液含量各为1 mL/L。
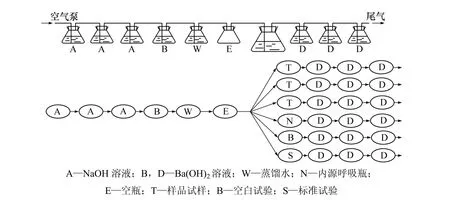
图1 生物降解性试验装置示意图Fig.1 Schematic diagram of equipment for evaluating biodegradation
(3) 接种物和参比基准物质。接种物即活性污泥取自武汉沙湖污水处理厂,使用之前曝气5 d以除去污水中的残留有机物从而降低空白CO2含量,污泥沉降指数为33 mL/g左右。用平板计数法测定接种物中生物活细菌数,使其基本保持在(4.0~8.5)×107个/mL。实验的参比基准物为生物降解性能优异的分析纯油酸钠[8,12](生物降解极限值可达到100%)。
(4) 试验条件及过程。试验中,并联的生物降解反应瓶有6只,其中:
① 生化反应瓶3只(加入营养盐、受试有机物黄药和接种物)。为了减小误差,其CO2含量用3次的平均值计算。
② 标准反应瓶1只(加营养盐、标准物质油酸钠和接种物),检验装置及活性污泥有效性。
③ 内源反应瓶1只(只加营养盐、接种物,不加受试物)。
④ 空白反应瓶1只(只加蒸馏水和营养盐)。
为了去除进气中的 CO2,在生物反应瓶前增设 4个串联的吸收瓶,其中前3个采用10 mol/L NaOH进行吸收,第4个采用0.05 mol/L Ba(OH)2溶液进行吸收,然后,经洗气瓶洗涤以防止微量的碱液进入反应瓶。在生物反应瓶中,按要求加入各营养液,反应温度为25 ℃,每个反应瓶的气体流量为1~2 个/s气泡,受试有机物初始质量浓度为20 mg/L(以DOC计),接种物在反应液中的MLSS质量浓度为150 mg/L[8],反应时间为 28 d,生化反应瓶中反应液的总体积为 2 L(包括受试物和接种物),其中反应瓶外包一层黑色塑料袋,以防止光合细菌吸收CO2。
生物降解产生的CO2由3个串连的、分别盛有100 mL 0.025 mol/L Ba(OH)2标准溶液的锥形瓶来吸收,产生的 CO2气体质量浓度用 0.05 mol/L盐酸溶液(用NaCO3溶液标定)滴定测得。滴定时,移出离试验瓶最近的吸收瓶,再将其他吸收瓶依次向前移动1个位置;同时,在吸收装置最末端再加 1个新的装有100 mL 0.025 mol/L Ba(OH)2标准溶液的吸收瓶。试验结束时,要对所有吸收瓶进行滴定。根据试验中所求得的CO2生成量,并扣除空白值,将每天的CO2生成量累加,绘制CO2质量浓度与时间的关系曲线。
2 结果与讨论
2.1 BOD5/CODCr法
2.1.1 CODCr标准工作曲线
用邻苯二甲酸氢钾作为标准物质,分别配制CODCr质量浓度为0,25,50,150,200和250 mg/L的标准溶液,作ρ(CODCr)与吸光度的标准工作曲线,见图 2。
2.1.2 BOD5/CODCr生物降解性评价结果
一般来说,废水的ρ(BOD5)/ρ(CODCr)越大,其生物降解性越好,其评价标准见表 1,评价结果见表2。
由表2可知:乙基黄药、异丙基黄药、正丁基黄药、异丁基黄药、正戊基黄药的ρ(BOD5)/ρ(CODCr)都小于0.25,可见它们都是难生物降解的。

表1 废水生物降解性评价参考指标Table 1 Biodegradability evaluation indexes of wastewater

表 2 烃基黄药的 ρ(BOD5), ρ(CODCr)和 ρ(BOD5)/ρ(CODCr)Table 2 ρ(BOD5), ρ(CODCr) and ρ(BOD5)/ρ(CODCr) of alkyl xanthates
2.2 静置烧瓶筛选试验法
2.2.1 烃基黄药的紫外扫描图谱及标准工作曲线
烃基黄药的紫外扫描图谱如图3所示。从图3可见:在197 nm出现1个吸收峰,是溶剂峰[13];烃基黄药在226 nm和301 nm处有2个吸收峰,其吸光度之比约为5:8,选最大吸收峰波长301 nm作为测定烃基黄药浓度的特征波长。

图2 ρ(CODCr)标准工作曲线Fig.2 Standard curve of ρ(CODCr)

图3 黄药的紫外吸收图谱Fig.3 UV absorption spectrum of xanthate
配制不同质量浓度的烃基黄药溶液,在301 nm处测其吸光度,作质量浓度与吸光度的标准工作曲线,其标准工作曲线方程见表 3。

表3 烃基黄药的标准工作曲线Table 3 Standard curve of alkyl xanthates
2.2.2 生物降解性评价
实验中黄药的生物降解难易程度以第4次的降解度为依据[10],其生物降解度评价标准见表 4,实验取2次平行实验的平均值,结果见表5。

表4 生物降解度评价标准Table 4 Evaluation standards for biodegradability

表5 烃基黄药的生物降解性试验结果Table 5 Test results of biodegradability of alkyl xanthates
由表 5可知:乙基黄药的生物降解度最大,为39.54%,其次依次为正丁基黄药、正戊基黄药、异丙基黄药,它们的生物降解度分别为36.88%,34.09%和29.17%,异丁基黄药生物降解度最小,仅为26.79%,它们的生物降解度均在20%~40%之间,可见它们的生物降解性能都比较差。
2.3 OECD−301B法(ISO 9439,PCD法)
一般来说,有机化合物生物降解生成的二氧化碳量与生物降解时间的关系,可用如图4所示的3种典型二氧化碳质量浓度曲线(PCD曲线)来描述。
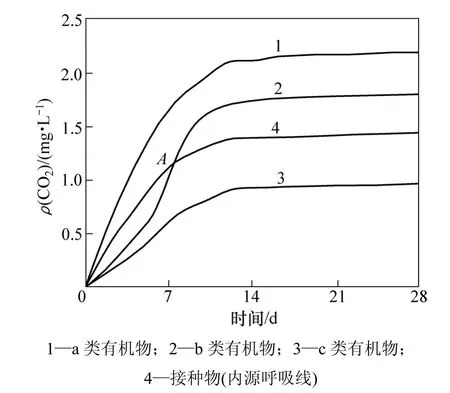
图4 有机物生物降解过程中几种典型的PCD曲线Fig.4 Typical PCD curves of biodegradation of organic compounds
如图4所示:不同受试物PCD曲线不同,a类有机物不需要驯化过程,生物降解速率和生物降解程度较大,PCD曲线与横坐标之间的面积也较大;b类有机物需要一个驯化过程,它的反应速率和生物降解程度较小,PCD曲线与横坐标之间的面积也较小;c类有机物不但不发生生物降解作用,反而对接种物具有毒性,其PCD曲线位于接种物(内源线)PCD曲线之下且PCD曲线与横坐标之间的面积最小,表明其难以生物降解[14]。由此可见,PCD曲线与横坐标之间的面积可以表征有机物生物降解性。因此,在二氧化碳测试法中,有机物的生物降解性能可采用生物降解性指数IB表示[15−16]:

式中:As为受试有机物生化PCD曲线与横坐标之间的面积;Ao为接种物内源 PCD曲线与横坐标之间的面积。根据受试有机物的生物降解性指数(IB)可把有机物的生物降解性划分如下:IB≥200表明易生物降解;100≤IB<200表明可生物降解;IB<100表明难生物降解。
并定义相对降解度(DRBD)为:

式中:IBt为受试物的生物降解指数,%;IBs为参比物油酸钠的生物降解指数,%;DRBD越大,说明受试物的生物降解能力越强,反之则越弱。DRBD作为生物降解性指标受试验条件影响小,因此,采用此指标使烃基黄药生物降解性能的评价更加全面和直观。
各种烃基黄药的PCD曲线(CO2浓度取3次的平均值)如图5所示。为更清楚地分析不同结构的烃基黄药在降解过程中产生CO2质量浓度以及与接种物内源所生成CO2质量浓度之间的关系,将图5进行局部放大,放大后的PCD曲线如图6所示。其积分面积和生物降解指数见表6。
由图5、图6和表6可知:标准物质油酸钠在开始就很快降解,其生物降解性指数为355.452 4,远大于200.000 0,验证了油酸钠是一种极易降解的物质,说明在试验过程中接种物活性污泥具有很好的活性,进而验证了实验的有效性。
5种烃基黄药的PCD曲线刚开始都位于内源呼吸线以下,表明黄药对微生物具有一定的毒性作用,抑制了微生物的活性。由图6可知:活性污泥经过一定时期的驯化后,CO2质量浓度逐渐超过内源反应的CO2质量浓度;不同结构的黄药对微生物的抑制时间也相差较大,其中乙基黄药时间最短,其次依次为正丁基黄药、正戊基黄药、异丙基黄药,而异丁基黄药的时间最长,其时间分别为12,13,15,17和18 d。由Origin7.5分别求其曲线积分,A0为13.923 3,乙基、正丁基、正戊基、异丙基、异丁基黄药的As分别为14.065 3,13.786 8,12.352 4,11.016 9 和 10.010 5,由此可得它们的生物降解指数分别为 101.020 0,99.019 9,88.717 5,79.125 6和71.897 5,其中乙基黄药生物降解指数101.020 0略大于100.000 0,根据受试物的生物、降解性评价指标可知是可生物降解的,而异丙基、正丁基、异丁基、正戊基黄药的生物降解指数都小于100.000 0,都属于难生物降解,它们第28 d的相对降解度(DRBD)分别为28.42%,27.86,24.96%,22.26%和20.23%。

图5 烃基黄药CO2质量浓度与时间的关系Fig.5 Relationship between mass concentration of CO2 produced of alkyl xanthates and time
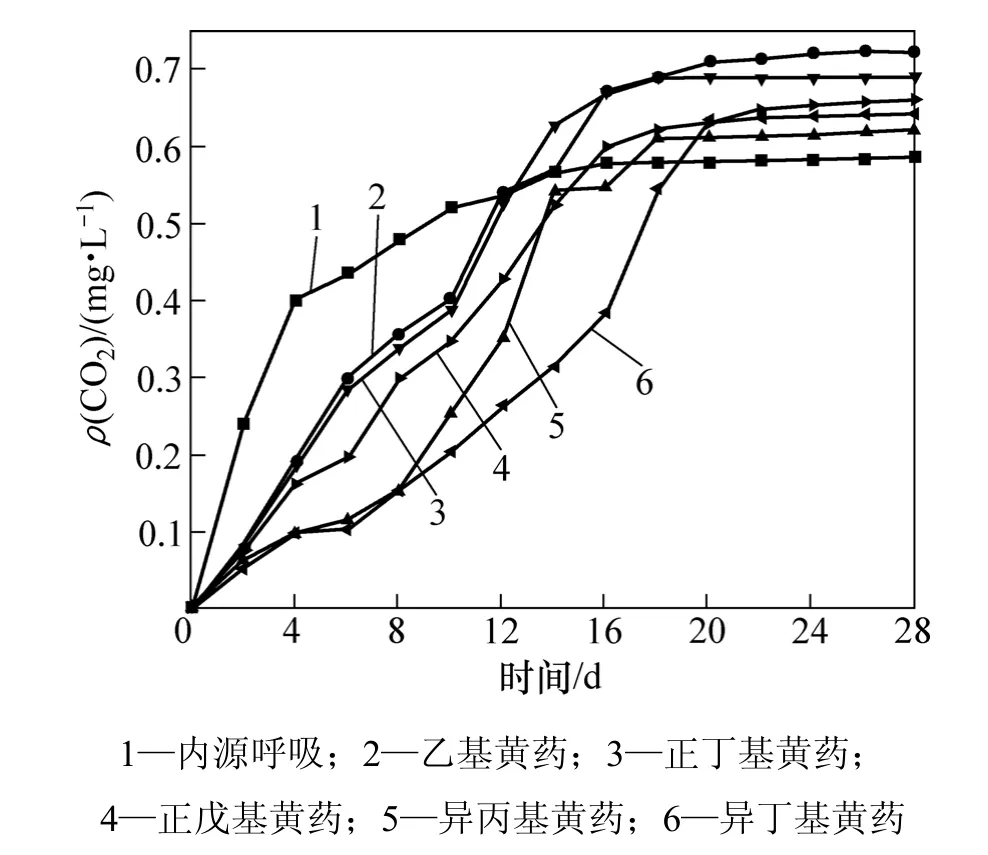
图6 图5的局部放大图形Fig.6 Enlarged part of Fig.5
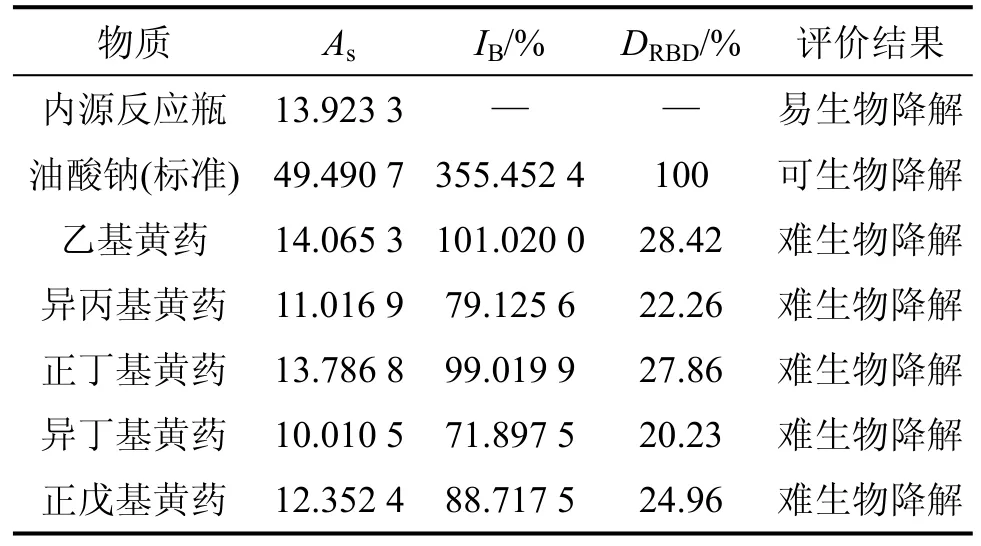
表6 烃基黄药的生物降解性能分类Table 6 Classification for biodegradability of alkyl xanthates
2.4 几种评价方法的分析和比较
由ρ(BOD5)/ρ(CODCr)可看出5种黄药都难生物降解;用静置烧瓶筛选试验法得出5种黄药降解性能都比较差;由OECD−301B法得出的结论除乙基黄药是可生物降解外,其他4种黄药也都是难生物降解。由此可见:3种评价方法得出的结论是一致的,基本上都是难于生物降解或生物降解性能很差。
利用ρ(BOD5)/ρ(CODCr)判断有机物的生物降解性能比较简单,但在ρ(COD)/ρ(BOD5)的差额中,包含了用于合成细胞的那部分有机物的需氧量(质量浓度),还有还原性无机物的需氧量以及ρ(BODu)与ρ(BOD5)的差额,此外,微生物在5 d内也可能发生硝化作用,因此,采用这种方法所得结果精度不高,仅粗略地反映有机物的降解性能。
用静置烧瓶试验法得出乙基、正丁基、正戊基、异丙基、异丁基黄药的生物降解度略大于 OECD−301B法测得的相对降解度,这主要是因为:静态烧瓶法是测定初级生物降解度,OECD−301B是测定最终生物降解度,是反映有机物完全降解为无机物小分子的程度,并且静态烧瓶法采用较低的黄药质量浓度,对微生物的毒性不会太强,并且在稀释水之外还加入了少量的酵母提取液,当微生物无法利用黄药做唯一碳源时,可利用酵母膏作为引导基质,有可能发生共代谢作用,以提高捕收剂的生物降解性。
2.5 烃基黄药结构对生物降解度的影响
为了便于比较黄药的不同结构对生物降解性能的影响,表7列出了5种烃基黄药的ρ(COD)/ρ(BOD5)、生物降解度D和生物降解性指数IB。由表 7可知:

表7 烃基黄药的ρ(BOD5)/ρ(CODCr)、生物降解度和生物降解指数Table 7 ρ(BOD5)/ρ(CODCr), biodegradability and IB of alkyl xanthates
(1) 不同结构黄药的生物降解度和降解指数差别较大,其生物降解能力由大至小的顺序为:乙基黄药、正丁基黄药、正戊基黄药、异丙基黄药和异丁基黄药;在相同的实验条件下,对于直链烃基黄药,从乙基、正丁基到正戊基黄药,碳链依次加长,其ρ(COD)/ρ(BOD5)、生物降解度、生物降解指数都依次减小。这是因为直链烷基碳链长度增大,分子体积相应增加,增大了分子对生物反应的位阻效应,妨碍了酶的反应活性中心与有机底物的结合,阻碍了微生物攻击碳核的能力,从而降低了黄药的生物降解活性[17]。
(2) 正丁基黄药的生物降解度和降解指数明显大于异丁基黄药的生物降解度和降解指数,可见在烷基链含碳数目相同的情况下,直链结构的黄药降解度明显大于含支链的黄药降解度。分支度对其生物降解度的影响较大,这是由于对于直链结构的捕收剂,微生物较易接近它们的碳核发生氧化降解反应,而支链捕收剂则由于位阻较大而微生物比较难于接近碳核发生反应,因而其生物降解性能比直链捕收剂的生物降解性能差。
(3) 一些碳链长的直链黄药比碳链短的支链黄药的生物降解性还好,如正丁基黄药的生物降解性比异丙基黄药的好,正戊基黄药的生物降解性比异丙基黄药及异丁基黄药的生物降解性能都好,说明相对于碳链长度来说,分支度对黄药生物降解性的影响更大。
3 黄药的生物降解机理
中间产物的形成,说明有机化合物的降解是一个非常复杂的过程。表8给出了黄药及其反应产物的紫外吸收峰波长[18−19]。
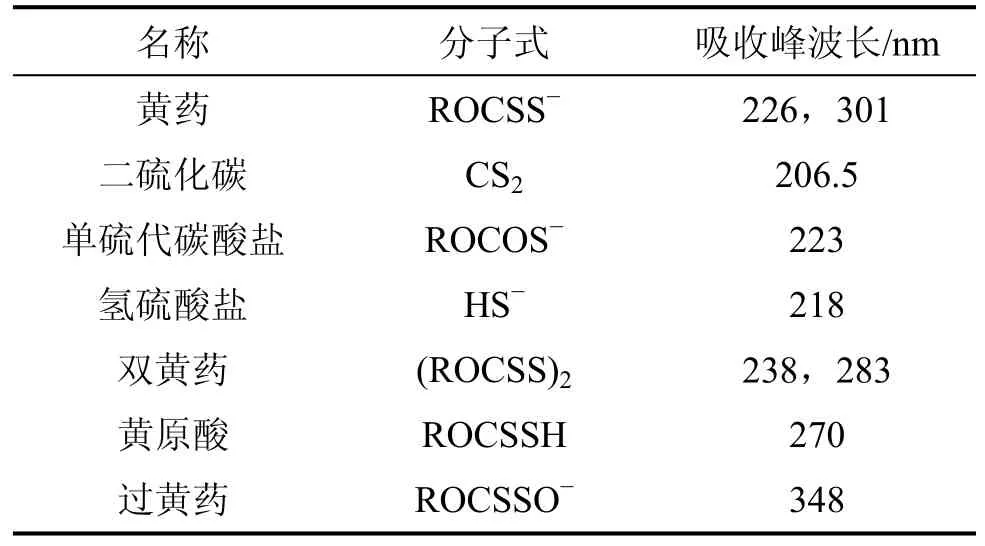
表8 黄药及其主要反应产物的紫外吸收峰波长Table 8 Absorption peak values of butyl xanthate and main reaction products
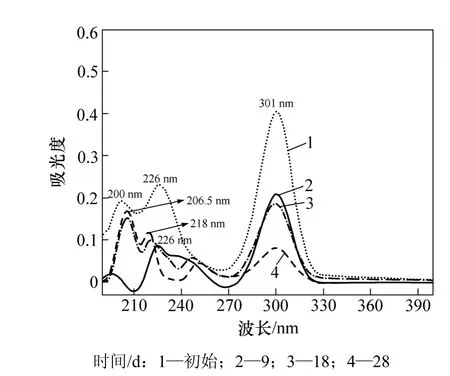
图7 经微生物降解不同时间后丁基黄药的紫外吸收图谱Fig.7 UV absorption spectra of butyl xanthate degradation by microorganisms at various reaction time
为了考察黄药(以丁基黄药为例)生物降解过程中产物的变化情况,对降解过程中降解不同时间的溶液进行紫外扫描,结果见图7。从图7可见:随着降解时间的增加,丁黄药的特征吸收峰(226 nm与301 nm)强度不断降低(在190~200 nm处的吸收峰是溶剂峰);在218 nm出现了微弱吸收峰,这可能是降解生成的C不稳定分解成 S2−,S2−进一步水解生成 HS−的吸收峰[20]的缘故;黄药经过微生物降解一定时间后,在206.5 nm处有强吸收峰,是CS2的特征吸收峰;随着时间的延长,黄药吸收峰强度不断下降,而CS2的吸收峰强度不断增加,表明黄药不断被降解成 CS2,说明CS2作为中间产物不能很好地被微生物进一步利用从而不断积累。
培养一段时间后,锥形瓶中出现了较少量的黄色油状液滴,用正己烷萃取后进行紫外扫描,其紫外吸收图谱如图8所示。对微生物降解后的黄药溶液用正已烷进行萃取分析(空白也加入相同量的正己烷萃取作为参照),萃取后有机相的紫外吸收图谱如图 9所示。
从图8可知:油状物在238 nm和283 nm处有明显吸收峰,这是双黄药的特征吸收峰。可见:微生物在降解黄药时,有部分黄药被微生物氧化成为双黄药。

图8 油状物用正己烷萃取后的紫外吸收图谱Fig.8 UV absorption spectrum of n-hexane

图9 最后的降解液用正己烷萃取后有机相的紫外吸收图谱Fig.9 UV absorption spectra of organic phase in final solution
由图9可知:微生物降解后的溶液用正己烷萃取在200,223和270 nm处出现了明显吸收峰;200 nm处的峰是正己烷中少量水的吸收峰;270 nm处的峰是黄原酸的特征吸收峰,这是未降解黄药水解的产物;而223 nm处的峰是单硫代碳酸盐的特征吸收峰,并且随着时间的延长,其吸收峰强度不断增加,表明单硫代碳酸盐作为黄药降解的中间产物不能很好地被微生物进一步降解,从而不断积累。由以上分析可推测黄药生物降解的可能途径如下:

可见:CS2,ROCSSH和单硫代碳酸盐是黄药生物降解后的主要产物,同时有少量油状液滴双黄药生成。
4 结论
(1) 烃基黄药(乙基、异丙基、正丁基、异丁基、正戊基黄药)的ρ(COD)/ρ(BOD5)均小于 0.25,都属于难生物降解有机物。
(2) 乙基黄药第 28 d的生物降解度最大,为39.54%,其次依次为正丁基、正戊基、异丙基黄药,它们的生物降解度分别为36.88%,34.09%和29.17%;异丁基黄药降解度最小,仅为26.79%。它们的生物降解度都在20%~40%之间,生物降解性能都较差。
(3) 黄药对微生物具有一定的抑制作用,乙基、正丁基、正戊基、异丙基黄药、异丁基黄药的抑制时间分别为12,13,15,17和18 d,第28 d生物降解指数分别为101.020 0,99.019 9,88.717 5,79.125 6和71.897 5。由生物降解性评价指标可知,乙基黄药是可生物降解,而正丁基、正戊基、异丙基、异丁基黄药都属于难生物降解。
(4) 黄药的碳链长度和分支度对生物降解性能影响较大,其生物降解能力由大至小的顺序为:乙基黄药、正丁基黄药、正戊基黄药、异丙基黄药和异丁基黄药。相对于碳链长度来说,分支度对黄药的生物降解性的影响更为显著。
(5) CS2,ROCSSH和单硫代碳酸盐是黄药生物降解的主要产物,同时有少量油状液滴双黄药生成。
[1]於方, 张强, 过孝民. 我国金属矿采选业废水污染特征分析[J]. 金属矿山, 2003(9): 40−44.
YU Fang, ZHANG Qiang, GUO Xiao-min. Analysis of waste water pollution characteristics of mining and mineral processing of China’s metal mines[J]. Metal Mine, 2003(9): 40−44.
[2]师伟. 烃基黄药浮选捕收剂光化学降解性能研究[D]. 武汉:武汉理工大学资源与环境工程学院, 2007: 6−10.
SHI Wei. Study on photochemical degradation properties of the alkyl xanthate flotation collecters[D]. Wuhan: Wuhan University of Technology. School of Resources and Environmental Engineering, 2007: 6−10.
[3]赵永红, 成先雄, 谢明辉, 等. 选矿废水中黄药自然降解特性的研究[J]. 矿业安全与环保, 2006, 33(6): 33−34.
ZHAO Yong-hong, CHENG Xian-xiong, XIE Ming-hui, et al.The research about the natural degradation characteristics of xanthate in beneficiation wastewater[J]. Mining Safety and Environmental Protection, 2006, 33(6): 33−34.
[4]翁建浩, 王睿, 黄道玉. 选矿废水中残余黄药降解规律的试验研究[J]. 化工矿物与加工, 2001(5): 18−22.
WENG Jian-hao, WANG Rui, HUANG Dao-yu. Study on degradation law of remaining xanthate in mineral processing waste water[J]. Industrial Minerals and Processing, 2001(5):18−22.
[5]Beran E. Experience with evaluating biodegradability of lubricating base oils[J]. Tribology International, 2008, 41(12):1212−1218.
[6]Adam R, Grochowalski D G, Cooper J A. Effect of surfactants on plasticizer biodegradation by bacillus subtilis ATCC 6633[J].Biodegradation, 2007, 18(3): 283−293.
[7]Singh D K. Biodegradation and bioremediation of pesticide in soil: Concept, method and recent developments[J]. Indian J Microbiol, 2008, 48: 35−40.
[8]OECD 301B. OECD guidelines for the testing of chemicals[S].
[9]YANG Li-he, ZHU Yong, FAN Guo-chen, et al. Test on evaluation method for biodegradability of lubricants[J].Transactions of Tianjin University, 2008, 14(1): 61−65.
[10]吴杰, 刘正芹, 奚旦立. 两种基本方法测定阳离子染料可生化性[J]. 河南师范大学学报: 自然科学版, 2003, 31(1): 74−75.
WU Jie, LIU Zheng-qin, XI Da-li. Two basic methods to gauge the biodegradability of anionic dyes[J]. Journal of Henan Normal University: Natural Science, 2003, 31(1): 74−75.
[11]胡兴刚, 孙继, 靳晓霞, 等. 水处理剂生物降解性能评价方法研究[J]. 工业水处理, 2007, 27(11): 65−67.
HU Xing-gang, SUN Ji, JIN Xiao-xia, et al. Research on biodegradability evaluation method of water treatment chemicals[J]. Industrial Water Treatment, 2007, 27(11): 65−67.
[12]王昆, 方建华, 陈波水, 等. 润滑油生物降解性快速测定方法的研究[J]. 石油学报, 2004, 20(6): 74−75.
WANG Kun, FANG Jian-hua, CHEN Bo-shui, et al. Fast method for the evaluation of biodegradability of lubricating oils[J]. Acta Petrolei Sinica, 2004, 20(6): 74−75.
[13]杨运琼. 硫化矿捕收剂的降解性能与机理研究[D]. 长沙: 中南大学化学化工学院, 2003: 41−42.
YANG Yun-qiong. Study on the degradation properties and mechanism of sulfide flotation collectors[D]. Changsha: Central South University. School of Chemistry and Chemical Engineering, 2003: 41−42.
[14]蒋展鹏, 师绍琪, 买文宁, 等. 有机物好氧生物降解性二氧化碳生成量测试法的研究[J]. 环境科学, 1996, 16(3): 11−14.
JIANG Zhan-peng, SHI Shao-qi, MAI Wen-ning, et al. Study on the determination of biodegradability of polluted organic substances using production of carbon dioxide test[J].Environmental Science, 1996, 16(3): 11−14.
[15]陈勇生, 陈丽侠, 杨杰, 等. 32种芳香化合物的好氧生物降解性表征[J]. 环境科学, 1997, 16(1): 43−45.
CHEN Yong-sheng, CHEN Li-xia, YANG Jie, et al. Study on biodegradability of 32 aromatic compounds[J]. Environmental Science, 1997, 16(1): 43−45.
[16]汤改风. 废水中硝基酚好氧生物降解性及降解动力学研究[D].青岛: 中国海洋大学环境科学与工程学院, 2006: 25−28.
TANG Gai-feng. Study on the aerobic biodegradability and degradation kinetics of nitrophenols wastewater[D]. Qingdao:Ocean University of China. College of Environmental Science and Engineering, 2006: 25−28.
[17]QIN Yong, ZHANG Gao-yong, KANG Bao-an, et al. Primary aerobic biodegradation of cationic and amphoteric surfactants[J].Journal of Surfactants and Detergents, 2005, 8(1): 55−58.
[18]舒生辉. 黄原酸盐高效降解菌的紫外诱变选育及其降解特性的研究[D]. 广州: 广东工业大学环境科学与工程学院, 2007:38−40.
SHU Sheng-hui. Breeding of xanthate-degrading bacterial strain by ultraviolet-ray mutation and its biodegradates characteristics[D]. Guangzhou: Guangdong University of Technology. Faculty of Environment Science and Engineering,2007: 38−40.
[19]ZHONG Xi-sun, Forsling W. The degradation kinetics of ethyl-xanthate as a function of pH in aqueous solution[J].Minerals Engineering,1997, 10(4): 389−400.
[20]J.赖亚. 泡沫表面浮选化学[M]. 北京: 冶金工业出版社, 1987:224−227.
J.Lai Ya. Surface chemistry of froth flotation[M]. Beijing:Metallurgical Industry Press, 1987: 224−227.
(编辑 陈灿华)
Evaluation of biodegradability of alkyl xanthates flotation collecters
CHEN Shao-hua, GONG Wen-qi, MEI Guang-jun, CHEN Xiao-dong, YAN Heng-zhen
(School of Resources and Environmental Engineering, Wuhan University of Technology, Wuhan 430070, China)
The biodegradability of alkyl xanthates was evaluated by the methods of BOD5/CODCr, static–flasks test and OECD−301B(ISO 9439) according to the testing standard for biodegradability of surfactants and other organic compounds. Meanwhile,the influence of molecular structure on biodegradability was studied. Finally, the biodegradation mechanism of alkyl xanthates was preliminarily explored. The results show that the mass concentration rate of BOD5and CODCrof ethyl xanthate, butyl xanthate, amyl xanthate, isopropyl xanthate and isobutyl xanthate are all less than 0.25,the biodegradation extent can reach 39.54%, 36.88%, 34.09%, 29.17% and 26.79%, respectively. The index of biodegradability can reach 101.020 0, 99.019 9, 88.717 5, 79.125 6, and 71.897 5, respectively in 28 d, and they have some inhibiting effects on microorganisms, the suppressed time is 12, 13, 15, 17, 18 d, respectively. Xanthates are difficult to degrade by microorganisms, and the order from strong to weak of the magnitude of the biodegradability is as follows: ethyl xanthate, butyl xanthate, amyl xanthate, isopropyl xanthate and isobutyl xanthate. Compared to alkyl chain length, the branched chains have more significant effects on the degradability of xanthates. CS2, xanthic acid and thiocarbonate are the main product of biodegradation of xanthates, in which a small amount of oil-like droplet dixanthate is produced.
alkyl xanthates; biodegradability; molecular structure; mechanism
X703
A
1672−7207(2011)02−0546−09
2009−10−26;
2010−01−10
国家高技术研究发展计划(“863”计划)项目(2007AA06Z123);武汉理工大学自主创新研究基金资助项目(2010-YB-16)
龚文琪(1948−),男,湖北武汉人,博士,教授,博士生导师,从事矿物生物技术、环境微生物技术和矿物纳米材料等方面的研究;E-mail:gongwenqi@yahoo.com.cn
