牙周膜干细胞膜片的构建及其生物学特性的研究
2011-02-02那思家郭维华李德超
那思家,黄 芳,郭维华,宫 坤,金 岩,李德超
(1.佳木斯大学口腔医学院口腔颌面外科,黑龙江佳木斯 154007;
2.第四军医大学口腔医学院组织工程中心,陕西西安 710032)
牙周膜干细胞膜片的构建及其生物学特性的研究
那思家1,黄 芳1,郭维华2,宫 坤2,金 岩2,李德超1
(1.佳木斯大学口腔医学院口腔颌面外科,黑龙江佳木斯 154007;
2.第四军医大学口腔医学院组织工程中心,陕西西安 710032)
目的:探讨牙周膜干细胞膜片的构建及其生物学特性。方法:采用胶原酶消化人牙周膜组织,获得牙周膜干细胞(Periodontal ligament stem cells,PDLSCs),经体外鉴定、扩增后构建PDLSCs细胞膜片,并通过倒置显微镜、HE染色、扫描电镜(SEM)对PDLSCs细胞膜片形态学进行检测。此外,细胞膜片厚度及膜片中细胞密度也被检测。结果:PDLSCs成功被分离、培养、鉴定,并且PDLSCs体外培养2周后,获得白色膜状PDLSCs细胞膜片。倒置显微镜下观察显示,细胞复层生长,细胞呈典型的纺锤状。体式显微镜下观察显示,细胞与细胞之间紧密连接。组织学观察显示,细胞与细胞之间存在着大量细胞外基质(Extracellular matrix,ECM)。扫描电镜下观察膜片表面显示,细胞在膜片上充分伸展,细胞之间紧密连接。PDLSCs细胞膜片厚度由起初的(48±3.2)μm到3周后的(69±3.4)μm,但在第2周细胞厚度(64±3.3)μm,变化最明显。细胞膜片中的细胞密度检测显示连续培养3周后仍然有大量具有活性的细胞存在,然而细胞密度在第2周时最大。结论:本研究证明我们已经成功探索出一套稳定、可靠的PDLSCs细胞膜片构建方法,为利用PDLSCs细胞膜片修复、再生牙周组织及牙周缺损提供了一定的技术保证。
牙周膜干细胞;细胞膜片;细胞外基质;组织工程
[牙体牙髓牙周病学杂志,2011,21(2):77]
[Chinese Journal of Conservativedentistry,2011,21(2):77]
基于工程学和生命科学而发展起来的组织工程学可以恢复或提高组织功能。组织工程学中支架材料主要采用三维立体可降解材料作为一种暂时的细胞外基质(Extracellular matrix,ECM)的代替物使接种在其上的细胞可以产生天然组织结构,而支架材料最终被降解[1];其中,常规细胞接种方法涉及细胞培养、细胞扩增、细胞消化及最后将细胞制成单细胞悬液接种于材料上[2]。首先,这种方法将导致一部分细胞在接种过程中损失掉;其次,细胞在支架材料上要重新分泌ECM,而其中一些细胞培养和细胞与细胞黏附过程中产生的蛋白是无法黏附于材料表面的[3-4]。此外,胰酶消化还会改变细胞形态和生化物质,最后导致细胞活性丢失[5]。
目前,一种不含任何可降解支架材料的三维立体细胞膜片被发明[6-7],这种膜片可以通过含有维生素C的培养基连续培养3周而获得,然后通过细胞刮将其机械刮下[8]。这样将不会破坏细胞之间的ECM及相关蛋白,同时可以避免由于胰酶消化而导致的细胞活性的丢失,从而解决了细胞接种于支架材料上的难题[9]。因此,细胞膜片已经被应用于各个领域中,如组织工程骨组织再生、组织工程肝脏、心肌及角膜修复等[8-10]。然而,细胞膜片在组织工程牙齿再生领域中应用较少[11-12]。
牙周膜干细胞(Periodontal ligament stem cells,PDLSCs)已经被证明具有较高的自我更新能力和多向分化能力[13-14],同时还拥有分泌大量ECM的能力[15-17]。而处于增值期的 PDLSCs细胞膜片同样也具有多向分化能力,这有益于组织工程的应用。虽然一些研究已经证明PDLSCs细胞膜片可以修复牙周缺损[17-18],但 PDLSCs细胞膜片的制备过程各不相同。本研究旨在探索出一套稳定、可靠的PDLSCs细胞膜片构建方法,并对PDLSCs细胞膜片的生物学特性进行鉴定。
1 材料和方法
1.1 材料
α-MEM培养基、2.5g/L胰酶、Ⅰ型胶原酶、谷氨酰胺、青链霉素(Gibco公司,美国);胎牛血清(FBS,四季青公司);维生素C、地塞米松、β一甘油磷酸钠、二甲基亚砜、TritonX-100(Sigma,美国);抗CD 146和 抗 STRO-1抗体(R&D Systems,美国)。
1.2 方法
1.2.1 牙周膜干细胞(PDLSCs)的分离、培养
选取第四军医大学口腔医学院门诊因正畸治疗需要拔除的无牙体、牙周组织炎症和畸形的第二前磨牙10个,分别来自5名身体健康的病人(15~18岁)。牙拔除后立即用0.01 mol/L PBS冲洗,无菌条件下,用锐利刀片刮取根中1/3区域的牙周膜组织。将组织块切割成约1 mm×1 mm的小块,并放置在6孔板中(含150 mL/L FBS、0.292 mg/mL谷氨酰胺、100 U/mL青霉素/链霉素的α-MEM培养基),在37℃、50 mL/L CO2和饱和湿度条件下培养,每2d换液,细胞从组织块边缘爬出后,继续培养7d,至细胞生长达80%汇合时,用胰酶/EDTA(0.25/0.1,pH=6.4)消化传代,标记为第一代。
1.2.2 PDLSCs鉴定
1.2.2.1 PDLSCs克隆形成率
将对数生长期的PDLSCs以胰酶消化,反复吹打使细胞充分分散制成细胞悬液。将细胞悬液以1×104接种至90 mm培养皿,十字方向轻轻晃动培养皿,使细胞分散均匀,加5 mL培养液培养14d后,细胞用40g/L多聚甲醛固定 20 min,弃固定液,晾干。加入结晶紫染液染色 10~20 min,弃染色液,PBS冲洗干净。体视显微镜下计大于50个细胞的克隆数,并计算克隆形成率(colony forming unit-fibroblastic,CFU-F)。

1.2.2.2 PDLSCs流式分子鉴定
取培养第5代的 PDLSCs调整细胞密度为1×106/mL,40g/L多聚甲醛固定15 min;洗涤后分别加入鼠抗人 STRO-1和 CD146单抗,室温孵育1 h;再次洗涤后分别加入羊抗鼠Ig-FITC,室温避光45 min;流式细胞仪检测细胞表面STRO-1和CD146的表达水平。
1.2.2.3 PDLSCs多向分化能力鉴定
将多克隆来源的 PDLSCs细胞悬液,以5×104/mL的密度接种于6孔板中,用含100 mL/L FBS的 α-MEM培养 24 h,待细胞伸展至 60%汇合后,换矿化诱导液(含10 mmol/l β-甘油磷酸钠、50 μg/mL维生素 C、1 ×10-8mol/L 地塞米松、100 mL/L FBS的α-MEM培养液)连续培养。镜下观察细胞复层生长并出现圆形结节后,继续培养至21d,弃原培养液,去离子水反复漂洗,40g/L多聚甲醛固定30 min,用茜素红染色。
将多克隆来源的 PDLSCs细胞悬液,以5×104/mL的密度接种于6孔板中,用含100 mL/L FBS的α-MEM培养2~3d,待细胞伸展至90%汇合后,换脂肪细胞诱导液(含 1 μmol/LdEC、0.5 mmol/L IBMX、10 rng/L BPE、100 mmo1/L Indomethacin,100 mL/L FBS的 α-MEM 培养液)诱导3d,用含10 mg/L的牛胰岛素、100 mL/L FBS的 α-MEM培养基处理1d,如此循环2次后,再用含10 mg/L的牛胰岛素,100 mL/L FBS的 α-MEM培养基继续培养7d,每隔 3~4d换液1次。100 mL/L甲醛固定,油红O染色。
1.2.3 PDLSCs细胞膜片的构建
将对数生长期的第三代PDLSCs以胰酶消化,反复吹打使细胞充分分散制成细胞悬液。将细胞悬液以1×105接种至90 mm培养皿,十字方向轻轻晃动培养皿,使细胞分散均匀,加入 10 mL α-MEM培 养 液 (含 100 U/mL维 生 素 C,100 mL/L FBS)。每3d换液1次,连续培养3周,于培养2周后,倒置显微镜下观察细胞复层生长情况。
1.2.4 PDLSCs细胞膜片组织学检查及其厚度测量
分别取培养1、2、3周PDLSCs细胞膜片置于40g/L多聚甲醛固定,甲酸-甲酸钠复合脱钙液脱钙2~3d,常规脱水,石蜡包埋,连续切片,HE染色。分别在1、2、3周细胞膜片的组织学切片中随机选5个点,根据标尺测量其厚度并取平均值,此值即细胞膜片厚度。此部分最少重复5次。
1.2.5 PDLSCs细胞膜片扫描电镜检测
取培养2周牙周膜干细胞膜片与牙本质片附合,并置于37℃、50 mL/L CO2饱和湿度条件下孵育3~5d,在0℃条件下25 mL/L戊二醛中固定,经脱水和临界点干燥后,于样品表面喷镀薄层金膜,最后在扫描电子显微镜下观察细胞膜片表面情况。
1.2.6 PDLSCs细胞膜片细胞密度检测
将PDLSCs以2×104/cm2接种在24孔板中,连续培养1、2、3 周后,毎孔加入100 μL MTT,37 ℃孵育4 h,中止培养,吸去上清培养液。每孔加入500 μLdMSO,振荡15 min,使结晶物充分溶解后,毎孔分别吸取100 μL转移到96孔板中,在酶联免疫检测仪上测定各孔490 mm处的光吸收值,求均值。此部分最少重复5次。
1.3 统计学分析
2 结果
2.1 PDLSCs的分离、鉴定
PDLSCs细胞形态呈长梭形类似成纤维样细胞(图1A),一般可稳定传代至少在8代以上,具有很强的克隆形成能力[13-14](图1B)和成骨成脂多向分化能力(图1D,E),并且 PDLSCs阳性表达Stro-1 和 CD146(图1C、F)。
2.2 PDLSCs细胞膜片形态学观察
PDLSCs连续培养2周后,可在培养皿底部出现乳白色膜样物质,此即已经形成的PDLSCs细胞膜片。将PDLSCs细胞膜片沿培养皿小心剥离时,可见细胞膜片中细胞与细胞的连接十分紧密,呈膜状(图2B)。完全剥离后的细胞膜片,呈现白色皱缩膜状物并且具有一定厚度和强度(图2C);倒置显微镜下清晰地观察到细胞复层生长,呈典型的纺锤状(图2A)。HE染色可观察到PDLSCs细胞膜片中细胞含量较高,细胞外基质丰富,细胞与细胞的连接非常紧密(图2D)。SEM可观察到PDLSCs在细胞膜片表面伸展良好,细胞与细胞之间存在很好的连接,并形成了一张致密的膜片结构(图2E)。
2.3 PDLSCs细胞膜片厚度和细胞密度
PDLSCs在含有100 U/mL抗坏血酸的培养基里被连续培养1、2、3周,并且分别对PDLSCs细胞膜片中细胞密度、细胞膜片的厚度进行检测。结果显示在3周的细胞膜片仍有大量具有活性的细胞存在,但细胞密度在第2周时最大(图3);并且细胞膜片厚度随着天数的增加而增加,在起初的(48±3.2)μm 到3 周后的(69±3.4)μm,然而,在第2周时PDLSCs细胞厚度(64±3.3)μm变化最为明显(图4)。
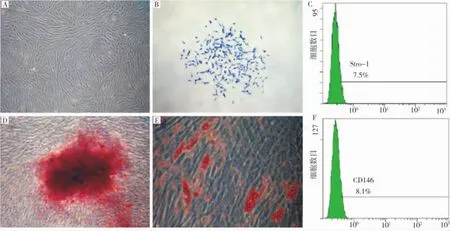
图1 PDLSCs的分离、鉴定
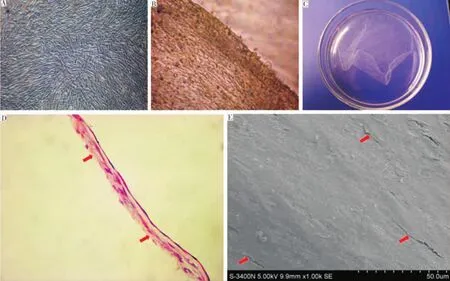
图2 PDLSCs细胞膜片的检测
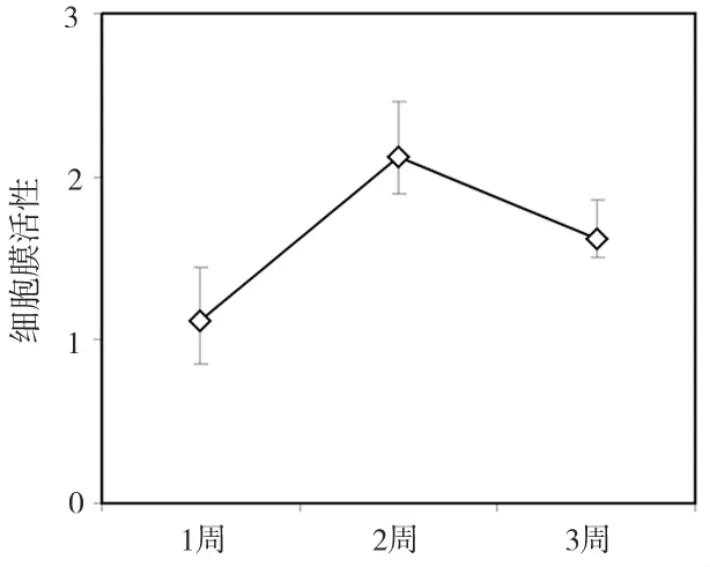
图3 PDLSCs细胞膜片活性检测(各时间段间P<0.05)

图4 PDLSCs细胞膜片厚度检测(各时间段间P<0.05)
3 讨论
由于PDLSCs的高增殖能力和多潜能性以及牙周膜临床收集比较容易等特点[13-14,16],使得PDLSCs 被广泛应用于组织工程领域[11-12,15-17]。随着细胞膜片的发明[18],PDLSCs细胞膜片也被引入到组织工程学中。理想的PDLSCs细胞膜片应具备以下优点:①常规细胞的获得是通过胰酶消化而得到的,因此会导致细胞的ECM和细胞与细胞之间的黏附蛋白被破坏,以及细胞表面活性的丧失。而细胞膜片则避免了胰酶的消化,从而保留了大量的ECM和细胞之间的黏附蛋白以及细胞表面活性[3-5,9];②细胞膜片无需支架材料,避免了常规细胞被消化、接种于支架材料导致细胞的损失、无法保证材料上的细胞量和支架材料植入体内会产生的炎症反应等[19]。③细胞膜片具有弹性好,可塑性等特点,容易通过注射、包裹等进行移植[8,20];④最近有研究证实在细胞膜片培养过程中,细胞膜片可以产生血管内皮增长因子(VEGF-A)[8],这有利于细胞膜片在体内的血管化,从而有利于组织的再生。但是,目前PDLSCs细胞膜片的制备方法各不相同,其稳定、可靠的制备方法尚需进一步研究。
在本实验中我们分离、培养、鉴定了人的PDLSCs并且成功构建PDLSCs细胞膜片该细胞膜片持续培养3周仍有大量具有活性的细胞存在,但细胞密度在第2周时最大。同时还观察到细胞在研究期间继续产生胶原,其厚度由起初的(48±3.2)μm 到3周后的(69±3.4)μm,但在第2周细胞厚度(64±3.3)μm变化最大。对第2周PDLSCs细胞膜片的形态通过大体、倒置显微镜、HE和SEM进行了观察,发现细胞随机排列,呈长梭形、复层生长、细胞伸展充分、细胞与细胞之间连接紧密,还可观察到细胞之间存在着大量ECM。以上数据提示连续培养2周是PDLSCs细胞膜片较为理想的体外培养时间。从而说明我们成功探索出一套稳定、可靠的PDLSCs细胞膜片构建方法,这为利用PDLSCs细胞膜片修复、再生牙周组织及牙周缺损提供了一定的技术保证。
[1]Langer R,Vacanti JP.Tissue engineering[J].Science,1993,260(3):920-926.
[2]AltmangH,Horan RL,Lu HH,et al.Silk matrix for tissue engineered anterior cruciate ligaments[J].Biomaterials,2002,23(20):4131-4141
[3]Li Y,Ma T,KnissdA,et al.Effects of filtration seeding on celldensity,spatialdistribution,and proliferation in nonwoven fibrous matrices[J].Biotechnol Prog,2001,17(5):935 -944.
[4]Kim BS,Putnam AJ,Kulik TJ,et al.Optimizing seeding and culture methods to engineer smooth muscle tissue on biodegradable polymer matrices[J].Biotechnol Bioeng,1998,57(1):46 -54.
[5]Fujioka N,Morimoto Y,Takeuchi K,et al.Difference in infrared spectra from cultured cellsdependent on cell-harvesting method[J].Appl Spectrosc,2003,57(2):241 -243.
[6]Shimizu T,Yamato M,Kikuchi A,et al.Cell sheet engineering for myocardial tissue reconstruction [J].Biomaterials,2003,24(13):2309-2316.
[7]Michel M,Heureux N,Pouliot R,et al.Characterization of a new tissue-engineered human skin equivalent with hair[J].In Vitro Celldev Biol Anim,1999,35(6):318-326.
[8]Nakamura A,Akahane M,Shigematsu H,et al.Cell sheet transplantation of cultured mesenchymal stem cells enhances bone formation in a rat nonunion model[J].Bone,2010,46(2):418-424.
[9]Kikuchi A,Okuhara M,Karikusa F,et al.Two-dimensional manipulation of confluently cultured vascular endothelial cells using temperature-responsive poly(N-isopropylacrylamide)-grafted surfaces[J].J Biomater Sci Polym Ed,1998,9(12):1331-1348.
[10]Shimizu T,Yamato M,Isoi Y,et al.Fabrication of pulsatile cardiac tissuegrafts using a novel 3-dimensional cell sheet manipulation technique and temperature-responsive cell culture surfaces[J].Circ Res,2002,90(3):e40.
[11]Liu Y,Zheng Y,Dingg,et al.Periodontal ligament stem cell-mediated treatment for periodontitis in miniature[J].Stem cells,2008,26(4):1065 -1073.
[12]Wataru SY,Liu Y,FangdJ,et al.Mesenchymal stem cellmediated functional tooth regeneration in swine[J].PLoS ONE,2006,1(1):e79.
[13]高秦,刘宏伟,金岩,等.人牙周膜干细胞的体外分离、纯化及初步鉴定[J].实用口腔医学杂志,2006,22(1):34 -37.
[14]Seo BM,Miura M,Gronthos S,et al.Investigation of multipotent postnatal stem cells from human periodontal ligament[J].Lancet,2004,364(9429):149 -155.
[15]Takanori I,Masayuki Y,Hiroaki T.Periodontal regeneration with multi-layered periodontal ligament-derived cell sheets in a canine model[J].Biomaterials,2009,30(14):2716 -2723.
[16]Yang ZH,Jin F,Zhang XJ,et al.Tissue engineering of cementum/periodontal-ligament complex using a novel three-dimensional pellet cultivation system for human periodontal ligament stem cells[J].Tissue Engineering:Part C,2009,15(4):571-581.
[17]gomez Flores M,Hasegawa1 M,Yamato M,et al.Cementumperiodontal ligament complex regeneration using the cell sheet technique[J].J Periodont Res,2008,43(3):364-371.
[18]Yamada N,Okano T,Sakai H,et al.Thermo-responsive polymeric surfaces;control of attachment anddetachment of cultured cells[J].Makromol Chem Rapid Commun,1990,(11):571-576.
[19]Fellah BH,Josselin N,Chappardd.Infiammatory reaction in rats muscle after implantation of biphasic calcium phosphate micro particles[J].J Mater Sci Mater Med,2007,18(2):287-294.
[20]Manabu A,Hideki S,Mika T,et al.Scaffold-free cell sheet injection results in bone formation[J].J Tissue Eng Regen Med,2010,4(5):404-411.
Construction of periodontal ligament stem cell sheet and characterization of its biological properties
NA Si-jia*,HUANG Fang,GUO Wei-hua,GONG Kun,JIN Yan,LIde-chao
(*Department of Oral and Maxillofacial Surgery,College of Stomatology,Jiamusi University,Jiamusi 154004,China)
AIM:To construct periodontal ligament stem cell(PDLSC)sheet and characterize the biological property of the constructed sheet.METHODS:PDLSCs were obtained by collagenasedigestion of human periodontal ligament tissues.After identification,PDLSCs were subcultured to construct PDLSC sheet.Cell sheet was examined by inverted microscope,HE staining and scanning electron microscope.PDLSC sheet thickness and celldensity were assayed.RESULTS:After 2 weeks in vitro culture,a white membranaceous PDLSC sheet formed.Under inverted microscope,it was shown that PDLSCsgrew in multilayer and retained their fibroblastic spindle shape.Histological examination indicated abundant extracellular matrix(ECM)existed among the cells.By scanning electron microscopy,it was found that PDLSCs expanded adequately on the surface of PDLSC sheet and PDLSCs connected closely.Cell sheet thickness varied from an initial 48 ±3.2 μm to 69 ±3.4μm at 3 weeks.The cells in the cell sheet were shown to be viableduring the 3-week culture period,with the maximum cell number in the second week.CONCLUSION:We successfully established a stable and reliable method for constructing PDLSC sheet,which provided technological founda-tion for future studies in regeneration and repair of periodontal tissuedestruction.
periodontal ligament stem cells;cell sheet;extracellular matrix;tissue engineering
R780.2
A
1005-2593(2011)02-0077-06
2010-11-16;
2010-12-29
那思家(1984-),男,满族,黑龙江绥化人。硕士生(导师:李德超)
李德超,E -mail:dechaoli2004@yahoo.com.cn
金 岩,E -mail:yanjin@fmmu.edu.cn
·临床经验总结·
