骨形态发生蛋白-4基因单核苷酸多态性与颈椎后纵韧带骨化症
2011-01-31赵伟光谢延平闫亮胡志恒王浩林欣
赵伟光,谢延平,闫亮,胡志恒,王浩,林欣
骨形态发生蛋白-4基因单核苷酸多态性与颈椎后纵韧带骨化症
赵伟光,谢延平,闫亮,胡志恒,王浩,林欣
目的探讨骨形态发生蛋白-4(BMP-4)单核苷酸多态性与颈椎后纵韧带骨化(OPLL)的遗传关联性。方法OPLL病例组和正常对照组各200例,利用聚合酶链反应(PCR)和直接测序法分析BMP-4上4个单核苷酸多态性位点6007C>T(rs17563),-5826G>A(rs1957860),3564C>T(rs2855532)和IVS-160C>T(rs2071047)基因型及等位基因的分布。结果两组间位点rs17563、rs2855532基因型与等位基因型有显著性差异(P<0.05)。病例组中 rs17563带C+基因型与 C-基因型骨化椎体数量有非常高度显著性差异(P<0.001),前者骨化椎体数量明显少于后者;rs2855532 T+基因型与T-基因型骨化椎体数量有显著性差异(P<0.05),前者骨化椎体数量多于后者。余两位点无显著性差异(P>0.05)。结论BMP-4基因的两个单核酸多态性位点rs17563、rs2855532等位基因型突变与OPLL的发生和发展有关。
后纵韧带骨化症;骨形态发生蛋白-4;基因;单核苷酸多态性
颈椎后纵韧带骨化症是指因颈椎的后纵韧带发生骨化,从而压迫相应节段的脊髓和(或)神经根,产生肢体的感觉和运动障碍及内脏自主神经功能紊乱的一种疾病。保守治疗不能阻止本病的发展。目前其发病机制还未完全明了,大多数学者认为与遗传及外界损伤等多重因素有关,其中遗传背景在本病的发生和发展中起主要作用。已报道一些因子与OPLL高度相关,如转化生长因子-β(TGF-β)、骨形态发生蛋白-2(BMP-2)、骨形态发生蛋白-4(BMP-4)等。其中对骨形态发生蛋白-4报道较少。本文研究BMP-4基因上4个单核苷酸多态性位点6007C>T(rs17563)、-5826G>A(rs1957860)、3564C>T(rs2855532)和 IVS-160C>T(rs2071047)与颈椎后纵韧带骨化症的关联性。
1 材料与方法
1.1 试验材料
1.1.1 实验样本 由骨科专家组根据Tsuyama的临床诊断[1]标准将样本分为OPLL病例组和对照组。病例组:男性 117例,女性83例,年龄 42~71岁,平均56.7岁;对照组:男性122例,女性78例,年龄47岁~68岁,平均 55.4岁。收集每位参与者周围静脉血4 ml,EDTA K2抗凝。对样本进行随机混合编号。
1.1.2 主要仪器及试剂 Wizard Genomic DNA Purification Kit:美国 Promega公司;dNTP及耐热性DNA酶:日本TaKaRa公司;引物由北京三博远志生物有限责任公司合成。ABI 3730XL DNA测序仪、PCR仪MYCYCLER:美国BIO-RaD公司;SIGMA低温高速离心机、凝胶成像系统Biospectrum。
1.2 实验方法
1.2.1 DNA的提取 利用DNA提取试剂盒进行人血白细胞基因组DNA提取。提取的DNA样品经0.8%琼脂糖凝胶电泳测定,A260/A280紫外定量,确定每个样本已提取DNA成功。
1.2.2 聚合酶链反应(PCR)及产物序列测定 利用PCR仪,50 μ l反应体系对目的DNA片段进行体外扩增 :10 ×LA PCR Buffer 5 μ l+Mg+(25 mmol/L)5 μ l+dNTPs Mixture(25 mmol/L)8 μ l+上游引物(10 μ mol/L)1 μ l+下游引物(10 μ mol/L)1 μ l+Tap 酶(5 U/μ l)0.5 μ l+模板 2.5 μ l,最后加灭菌蒸馏水至50 μ l。反应条件及引物见表1。对产物纯化后用直接测序法测定序列。

表1 SNP位点及其引物、扩增片段的长度
1.3 统计学方法 利用SPSS 13.0软件对病例组与对照组基因型、等位基因型分布进行χ2检验。不同基因型与骨化程度之间的关系采用非参数检验(Mann-Whitney法)。
2 结果
位点6007C>T(rs17563)、3564C>T(rs2855532)基因型、等位基因在两组间的分布有显著性差异(P<0.05);而其余两个位点无显著性差异(P>0.05)。见表 2、表 3 。
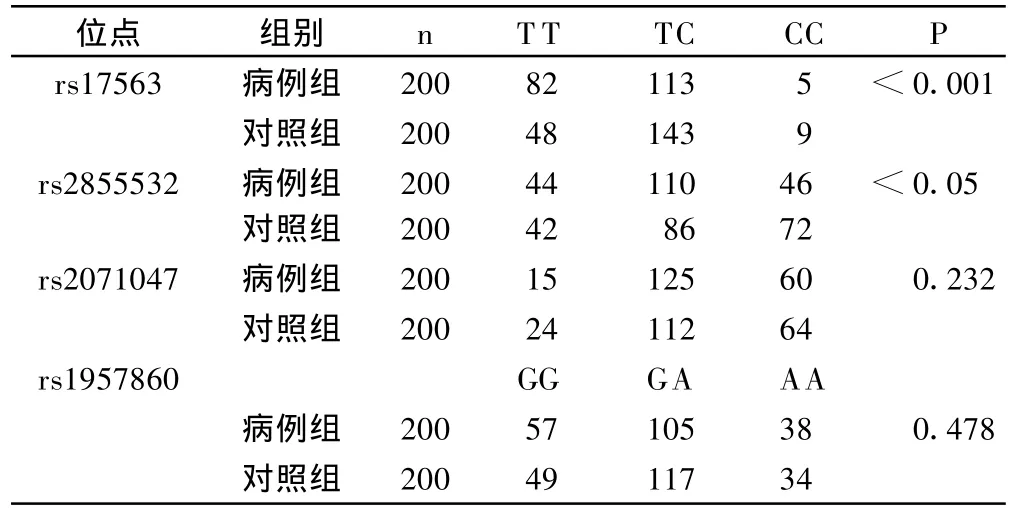
表2 两组间各位点基因型的分布比较
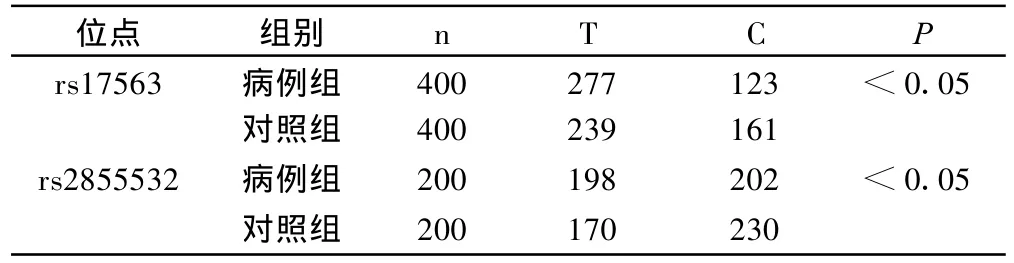
表3 两组间rs17563、rs2855532位点等位基因的分布比较
无显著性差异的两个位点 rs2071047、rs1957860在分性别比较后,两组同性别之间基因型的分布仍无显著性差异。见表4、表5。
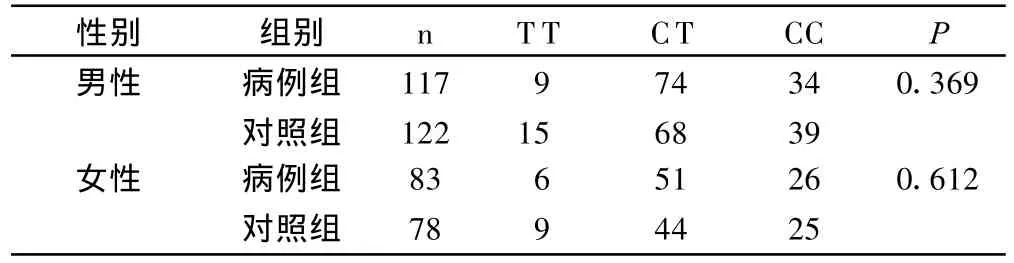
表4 两组间不同性别rs2071047位点基因型的分布比较
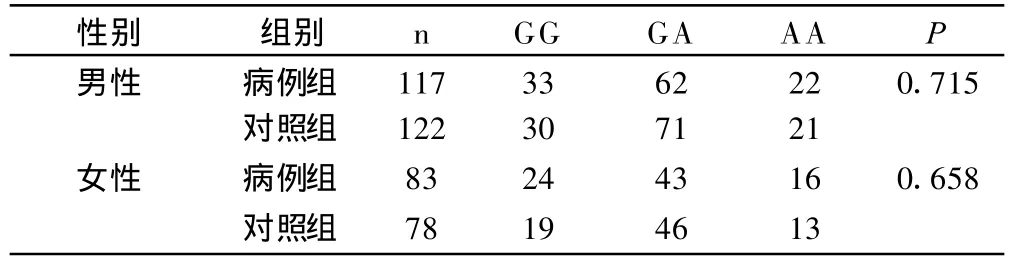
表5 两组间不同性别rs1957860位点基因型的分布比较
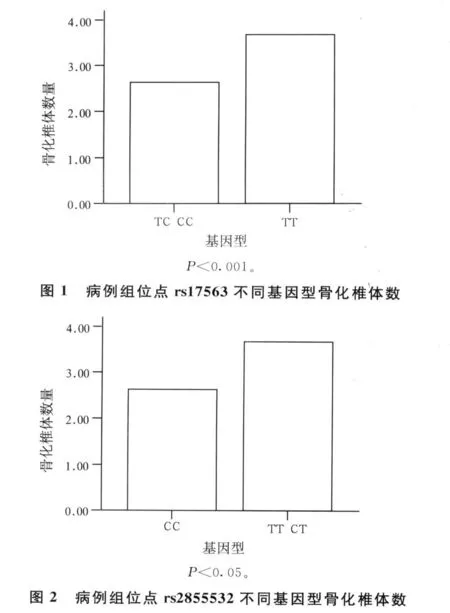
病例组中,rs17563基因型为TT的患者骨化椎体数量显著多于基因型为TC或CC患者(P<0.001,图1);rs2855532基因型为TT或CT的患者骨化椎体数量多于基因型为CC的患者(P<0.05,图2);其余两个位点比较无显著性差异(P>0.05)。
3 讨论
已有实验证明颈椎后纵韧带骨化症具有强大的遗传背景。Taizo等进行的一项大样本病例对照研究(711例OPLL患者和896名对照)发现,TGF-β3基因的单核苷酸多态性与OPLL的发生具有显著相关性(P=0.00040)[2]。
免疫组织病理学研究发现,在OPLL患者骨化的后纵韧带中,BMP-4、BMP-2、TGF-β、骨形态发生蛋白受体(BMPRs)和活化素受体(ActRs)等都有异常过量的表达。BMPs是一族独特的糖蛋白,是目前发现的惟一具有诱导诱导性成骨祖细胞(inducible osteogenic precursor cells,IOPC)类细胞向成骨细胞方向转化的蛋白质。BMPs由一个结构和功能相似的多肽因子家族组成,除了BMP-1都属于 TGF-β超家族的成员。BMPs家族迄今已发现20多种蛋白,根据同源性可分为以下4个亚族:①BMP-2/BMP-4;②BMP-3;③OP-1/BMP-7;④GDF-5,6,7。基因连锁分析研究表明,调节骨形成、骨量及其微观结构的基因定位于染色体14q12-23[3-4],其中BMP-4基因位于14q22-23;它除了具有强大的诱导成骨能力外,还通过BMP-Smads及MAPK的级联激活途径等广泛参与包括心血管、胃肠、呼吸、泌尿、生殖及神经系统的胚胎发育、生长和分化[5-7]。BMP-4与BMP-2高度形似,均可在体内外诱导骨和软骨形成[8]。Sato等进行的免疫组织化学研究表明,BMP-4、BMP-2在后纵韧带骨化灶表面肥大化生的软骨细胞内高表达[9]。已有文献报道BMP-2单核苷酸多态性与颈椎后纵韧带骨化症有关[10]。
本实验选定的 4个 SNP位点 6007C>T(rs17563)、3564C >T(rs2855532)、IVS-160C >T(rs2071047)、-5826G>A(rs1957860)分别位于BMP-4基因外显子、内含子及转录起始点5′端,其中rs17563是惟一位于编码区域的SNP位点。已有报道其等位基因C突变为 T,使产物蛋白质分子152位置上的丙氨酸变为缬氨酸,这种突变可以降低绝经后妇女粗隆间和全髋关节的骨密度(P=0.012)[11]。本实验也证实了此位点T基因的突变具有促使OPLL发病及增强骨化程度的作用。位点rs2855532同样由于C-T基因的突变而促进了OPLL的发病以及增加了骨化椎体数量。
本研究有以下局限性:未完全覆盖BMP-4上所有SNPs位点;病例组仅入选颈椎后纵韧带骨化症患者,而BMP-4基因单核苷酸多态性很有可能对骨化范围涉及胸、腰段的患者有关联;两个位点等位基因的突变如何导致了OPLL的发生与发展机制尚不清楚,但是这种突变可能增加了BMP-4在颈椎后纵韧带中的表达,从而主要通过Smads途径起到调控下游基因转录的作用。
一些血清及其他体液中颈椎后纵韧带骨化症标志物的研究可以对颈椎OPLL起到早期提示及诊断作用。Ito等发现,白细胞介素-8在脊髓型颈椎病组(n=35)、病例组(n=7)脑脊液中的含量高于正常对照组(n=12)[12]。Yamada等通过测定24例OPLL患者与正常对照组血清发现,男性患者中MK-4(属于Vitamin K2家族)含量显著高于对照组男性,而女性间则未显示出差异[13]。
本病中国人平均发病率为3.08%[14],目前尚无特殊血液学、影像学检查方法对本病起到早期诊断作用。分子遗传学及血清学的一些研究有助于该病的早期诊断及治疗。这些突变的基因如何导致了颈椎后纵韧带骨化症的发生和发展还待进一步研究阐明。
[1]Tsuyama N.Ossification of the posterior longitudinal ligament of the spine[J].Clin Orthop Relat Res,1984,184:71-84.
[2]T aizo H,Koichi M,Yoshiharu K,et al.A large-scale genetic association study of ossification of the posterior longitudinal ligament of the spine[J].Hum Genet,2006:611-616.
[3]Wilson SG,Reed PW,Andrew T,et al.A genome-screen of a large twin cohort reveals linkage for quantitative ultrasound of the calcaneus to 2q33-37 and 4q12-21[J].J Bone Miner Res,2004,19:270-277.
[4]Karasik D,Myers RH,Cupples LA,et al.Genome screen for quantitative trait loci contributing to normal variation in bone mineral density:the Framingham Study[J].J Bone Miner Res,2002,17:1718-1727.
[5]F rank NY,Kho AT,Schatton T,et al.Regulation of myogenic progenitor proliferation in human fetal skeletal muscle by BM P4 and its antagonist Gremlin[J].J Cell Biol,2006,175:99-110.
[6]Hoshino T,Shimizu R,Ohmo ri S,et al.Reduced BMP-4 abundance in Gata2 hypomorphic mutant mice result in uropathies resembling human CAK UT[J].Genes Cells,2008,13:159-170.
[7]Zakin L,De Robertis EM.Inactivation of mouse Twisted gastrulation reveals its role in promoting BM P-4 activity during forebrain development[J].Development,2004,131:413-424.
[8]Jane JA Jr,Dunford BA,K ron A,et al.Ectopic osteogenesis using adenoviral bone morphogenetic protein(BMP)-4 and BMP-6 gene transfer[J].M ol Ther,2002,6:464-470.
[9]Sato R,Uchida K,Kobayashi S,et al.Ossification of the posterior longitudinal ligament of the cervical spine:histopathological findings around the calcification and ossification front[J].J Neurosurg Spine,2007,7(2):174-183.
[10]Wang Hao,Liu Dongmei,Yang Zhaohui,et al.Association of bone morphogenetic protein-2 gene polymorphisms with susceptibility to ossification of the posterior longitudinal ligament of the spine and its severity in Chinese patients[J].Euro Spine J,2008,17:956-964.
[11]Ramesh Babu L,Wilson SG,Dick IM,et al.Bone mass effects of a BM P-4 gene polymorphism in postmenopausal women[J].Bone,2005,36:555-561.
[12]Ito K,Matsuyama Y,Yukawa Y,et al.Analysis of interleukin-8,interleukin-10,and tumor necrosis factor-αin the cerebrospinal fluid of patients with cervical spondy lotic myelopathy[J].Spinal Disord Tech,2008,21:145-147.
[13]Yamada K,Inui K,Iwamoto M,et al.High serum levels of menatetrenone in male patients with ossification of the posterior longitudinal ligament[J].Spine,2003,28:1789-1793.
[14]Li Z,Zhang G,Sheng C.The incidence of the ossification of the posterior longitudinal ligament in northern region of China[J].Chin J Spine Spinal Cord,1999,9(5):285-286.
Bone Morphogenetic Protein-4 Gene Polymorphism Associated with Ossification of Posterior Longitudinal Ligament in Chinese Pa-tients
ZHAO Wei-guang,XIEYan-ping,YAN Liang,et al.Departmentof Orthopaedics,Tiantan Hospital,Capital Medical University,Beijing 100050,China
ObjectiveTo explore the relationship of single nucleotide polymorphism(SNPs)of the bone morphogenetic protein-4(BMP-4)gene with the morbidity and severity of the ossification of posterior longitudinal ligament(OPLL)of the spine in Chinese patients.MethodsThe venous blood samples of 200 OPLL patients and 200 non-OPLL controls were measured with the DNA sequences in four locus of BMP-4 gene with polymerase chain reaction(PCR).ResultsThere was a significant association between the rs17563,rs2855532 polymorphism and the occurrence of OPLL(P<0.05).The''T''allele in these 2 SNPs promotes the extent of OPLL(P<0.05).However,no significant association in morbidity and severity was found between the other 2 SNPs(rs1957860,rs2071047).ConclusionSNPs in rs17563,rs2855532 associates with the morbidity and severity of the ossification of posterior longitudinal ligament of the spine in Chinese patients.
ossification of posterior longitudinal ligament;bone morphogenetic protein-4;gene;single nucleotide polymorphism
[本文著录格式]赵伟光,谢延平,闫亮,等.骨形态发生蛋白-4基因单核苷酸多态性与颈椎后纵韧带骨化症[J].中国康复理论与实践,2011,17(1):39—41.
1.国家自然科学基金(30872599);2.北京市自然科学基金(7092028)。
首都医科大学附属北京天坛医院骨科,北京市 100050。作者简介:赵伟光(1984-),男,河北邢台市人,硕士研究生,主要研究方向:脊柱分子生物力学。通讯作者:林欣。
R686.5
A
1006-9771(2011)01-0039-03
2010-11-12)
·专题·
