苯并三氮唑和磷酸钠对锌的协同缓蚀*
2011-01-24柳松钟燕蒋荣英冯自平肖睿
柳松 钟燕 蒋荣英 冯自平 肖睿
(1.华南理工大学应用化学系,广东广州510640;2.中国科学院广州能源研究所,广东广州510640)
四丁基溴化铵(TBAB)包络化合物浆具有易生成、高潜热及可流动等特点,是一种良好的蓄冷及潜热输送介质,在中央空调及区域供冷系统中显示出了巨大的节能应用前景[1].目前,对于TBAB包络化合物浆的传热特性等方面的研究工作业已开展[1],但是对金属材料在TBAB介质中的腐蚀行为则研究得较少[2].在中央空调及区域供冷系统中不可避免地会用到金属材料,因此,研究金属材料在TBAB介质中的腐蚀行为具有重要意义.在溶液中加入缓蚀剂是一种常见的抑制金属腐蚀的方法.苯并三氮唑(BTA)或Na3PO4(SP)作为锌的缓蚀剂已有多年的历史[3-12],已研究过的主要介质有 NaCl[6-12]、Na2SO4[3]和 H2SO4[4]等.在各种介质中,BTA 和 Na3PO4单独使用时对锌均具有良好的缓蚀作用,但两者要达到较高的缓蚀效率时所对应的浓度均较高[8-9],而BTA和Na3PO4复配使用对锌的缓蚀鲜见报道.文献[2]中研究了TBAB介质中BTA和Na3PO4对碳钢的缓蚀,发现两者的协同作用显著.为了降低缓蚀剂的使用浓度以及提高缓蚀效率,文中采用静态失重法、动电位极化曲线法、电化学交流阻抗法、扫描电镜(SEM)和X射线光电子能谱(XPS)研究在质量分数为17%(0.534 mol/L)的TBAB溶液中,BTA和Na3PO4单独和复配使用时对锌的缓蚀作用以及缓蚀机理.
1 实验部分
1.1 静态失重实验
静态失重实验所用锌挂片(纯度为99.99%)尺寸为35mm×20 mm×2 mm,实验前用金相砂纸(200~1200#)逐级打磨,用蒸馏水冲洗后,在室温下干燥备用.实验介质为不含及含有缓蚀剂的17%的TBAB溶液,实验温度为(25±1)℃.将试样完全浸于实验介质中,42d后取出并用蒸馏水冲洗,干燥后称重.由试样的失重来计算腐蚀速率和缓蚀效率.所用药品均为分析纯.
静态失重实验所得缓蚀效率(η)由下式计算[3]:

式中:m0和m分别为在空白溶液及含有缓蚀剂溶液中的锌的失重.
1.2 电化学测试
电化学测试采用CHI660C电化学工作站(上海辰华公司)和三电极体系.实验用工作电极为纯锌(纯度为99.99%,直径为5 mm),用环氧树脂封装.实验前用金相砂纸(200~1200#)逐级打磨.辅助电极为大面积铂片,参比电极为饱和甘汞电极(SCE).极化曲线扫描速率为0.5mV/s,扫描范围为-200~+200mV(相对于开路电位).电化学阻抗谱(EIS)在开路电位下进行,交流激励信号峰值为5 mV,频率范围为100kHz~10 mHz.将锌电极浸入溶液1 h后方开始进行电化学测试.
极化曲线及电化学阻抗的缓蚀效率分别用式(2)和(3)计算[6,13]:
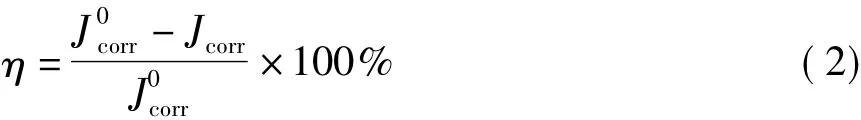

1.3 表面分析
将锌在溶液中浸泡72h后用Hitachi S-3700N型扫描电镜观察其表面形貌.用英国Kratos公司的Axis Ultra(DLD)型多功能光电子能谱仪进行XPS分析.
2 结果与讨论
2.1 静态失重实验结果
锌的静态失重实验结果如表1所示.结果表明BTA和Na3PO4对锌的缓蚀效率随缓蚀剂质量浓度的增大而提高.两者复配时对锌具有更好的保护作用.复配缓蚀剂的缓蚀效率达到93.0%,腐蚀速率从28.4mg/(m2·h)降到2.0mg/(m2·h).
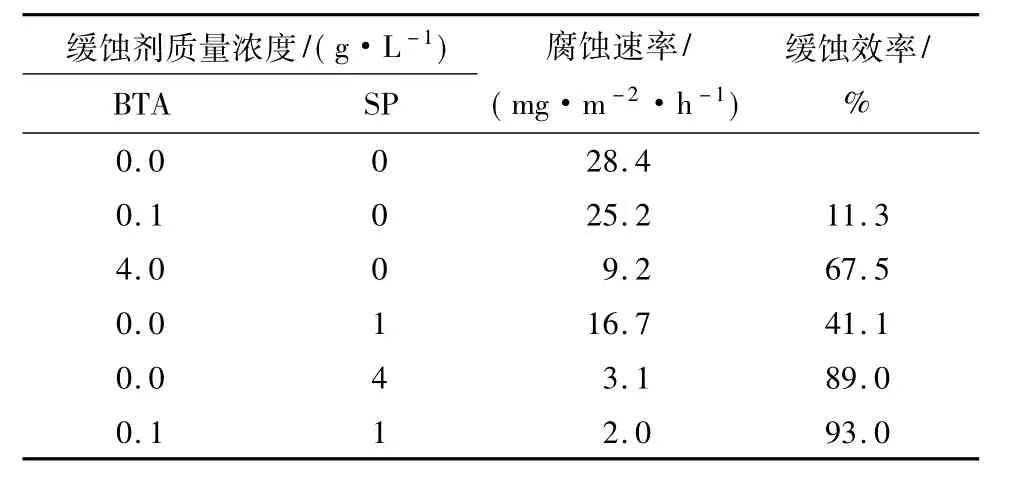
表1 锌在17%TBAB溶液中的静态失重实验结果Table 1 The experimental results of zinc in 17%TBAB solution obtained from static weight-loss test
2.2 动电位(Tafel)极化曲线
图1为锌电极在空白溶液和含缓蚀剂的溶液中的极化曲线,图中E为电位,J为电流密度.在电极上发生的阴极反应是氧的还原反应.在空白溶液中,阴极极化曲线出现了一个平台,其电流是氧还原反应的极限电流.当锌电极浸入到溶液后,在电极表面会形成一层多孔膜.该膜的存在使氧的扩散缓慢.阳极极化曲线电流密度迅速增大表明金属锌溶解的速度很快.当加入缓蚀剂后,发现阴极极化曲线平台消失了,这可能是因为在电极表面形成了保护膜[Zn(BTA)2]m或/和 Zn3(PO4)2·Zn(OH)2·ZnO,从而抑制了多孔膜的形成.此时,阴极过程转为由电化学反应控制[13].
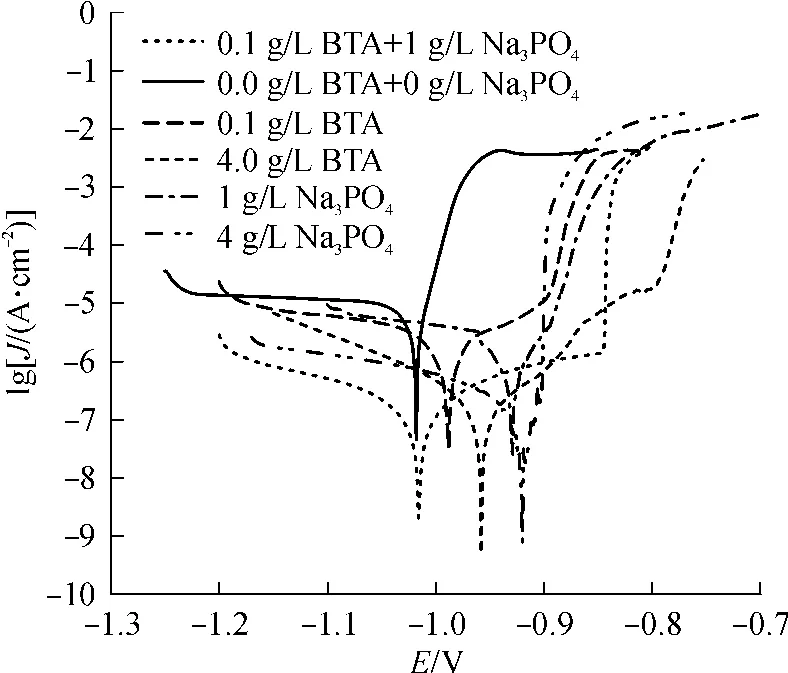
图1 锌在含有不同缓蚀剂的17%TBAB溶液中的极化曲线Fig.1 Tafel polarization curves of zinc in 17%TBAB solution in the presence of different corrosion inhibitors
水溶液中锌的腐蚀反应由阴极反应控制[13],因此,J0corr为阴极极化曲线的极限电流密度[14],Jcorr则由阴极极化曲线外推而得.在极化曲线外推法中,同时使用阳极和阴极曲线推算腐蚀电流密度比只使用其中一条要好.但是,腐蚀电流密度Jcorr也可以只使用阳极或者阴极曲线推算出来[15].从图1中可以看出,由于钝化以及金属表面的粗化会使电极的电化学行为偏离Tafel行为(阳极),因此阳极极化曲线没有线性很好的极化区[14],故文中只使用阴极极化曲线外推计算电流密度.
腐蚀电位、腐蚀电流密度、阴极Tafel斜率及缓蚀效率等参数列于表2中.BTA和Na3PO4复配使用后,腐蚀电流密度由12.30μA/cm2减小到0.23μA/cm2,腐蚀电位基本不变,且阴、阳极电流密度均下降,说明复配缓蚀剂对电极的阴、阳极反应均有抑制作用.BTA和Na3PO4的协同效应增加了17%TBAB溶液中锌的缓蚀效率.
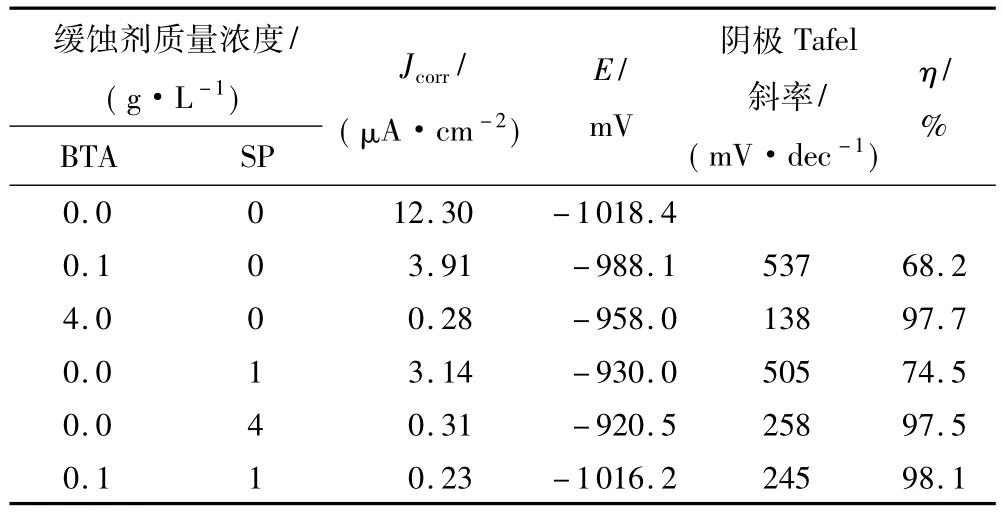
表2 锌在含有不同缓蚀剂的17%TBAB溶液中的极化曲线参数Table 2 Polarization parameters of zinc in 17%TBAB solution in the presence of different corrosion inhibitors
2.3 电化学交流阻抗

图2 锌在含有不同缓蚀剂的17%TBAB溶液中的Nyqusit图Fig.2 Nyqusit plots of zinc in 17%TBAB solution in the presence of different corrosion inhibitors点表示实验数据,线表示拟合曲线,拟合的等效电路见图4,图3同

图3 锌在含有不同缓蚀剂的17%TBAB溶液中的Bode图Fig.3 Bode plots of zinc in 17%TBAB solution in the presence of different corrosion inhibitors
图2和3分别是锌电极在空白溶液和含缓蚀剂的溶液中的Nyquist图和Bode图.其中,Z为阻抗,Z'、Z″分别表示阻抗实部与虚部,f为频率.从图2(b)所示局部放大图可以看出,空白溶液的阻抗图在低频区出现一个感抗弧.感抗弧可能与吸附组分的表面弛豫有关[16].当往溶液中加入 BTA、Na3PO4或者复配缓蚀剂后,感抗弧消失,出现了Warburg阻抗[17].Warburg阻抗与溶解氧和侵蚀性离子(Br-)从本体溶液到电极表面的扩散有关,或者与可溶性锌配合物从电极表面到本体溶液的扩散有关.
图4(a)为锌电极在空白溶液中的等效电路,该电路与Shao等[18]提出的类似;图4(b)为锌电极在含有缓蚀剂的溶液中的等效电路,该电路与Bastos等[11]提出的类似.图中,Re为溶液电阻,Rct为电化学反应电阻,Rf为膜电阻,ZW为 Warburg阻抗,ZL是感抗,RL是感抗电阻.Q1是金属电极表面与溶液之间的双电层电容,Q2代表膜电容,Q3为吸附组分的扩散电容[18].在这里,常相位角元件(CPE)的阻抗 Q 用下式表示[7-8,11]:

式中,ω为角频率;n=1,Q相当于电容C;n=0,Q相当于电阻R;n=0.5,Q相当于Warburg阻抗;n=-1,Q 相当于 ZL.
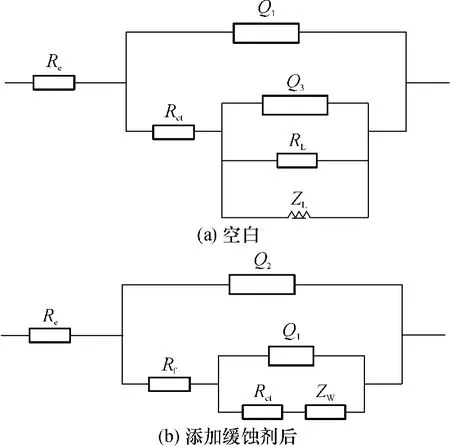
图4 拟合电化学阻抗谱的等效电路Fig.4 Equivalent circuits used to fit the EIS data
在图2和3中的拟合曲线由图4的等效电路模拟得出.电化学交流阻抗的拟合参数见表3.
如表3所示,往17%TBAB溶液中添加缓蚀剂后,电化学反应电阻(Rct)变大,双电层电容(Q1)减小,表明在TBAB溶液中锌的腐蚀被有效地抑制了.例如,加入复配缓蚀剂后,Rct从2.2kΩ·cm2增加到120.0kΩ·cm2,Q1从14.4×10-5sn1/(Ω·cm2)减小到4.2×10-5sn1/(Ω·cm2).Q1的减小是由于局部介电常数的减小或双电层厚度的增加[7],表明BTA或/和Na3PO4在锌电极表面上形成了保护膜.
从表1-3中可以看出,尽管由静态失重法得到的缓蚀效率比由动电位极化曲线法和电化学交流阻抗法得到的要低,但3种方法的缓蚀效率趋势是一致的.静态失重法测得的腐蚀速率是长时间的平均值,而电化学方法测得的是短时间的值.因此,静态失重法是更准确的测量方法,而动电位极化曲线法和电化学交流阻抗法的结果可以用来判断缓蚀效率的变化趋势[19].
2.4 表面分析
图5(a)和5(b)分别为锌在空白溶液和添加复配缓蚀剂的17%TBAB溶液中浸泡72h后的腐蚀表面形貌图.从图5(a)中可以看出,空白试片的腐蚀非常严重,表面布满了大量腐蚀产物;而加入复配缓蚀剂的样品表面的腐蚀产物明显减少,还可观察到较清晰的抛光线(见图5(b)).

图5 锌在17%TBAB溶液中腐蚀后的SEM照片Fig.5 SEM images of zinc immersed in 17%TBAB solution
图6为锌在含复配缓蚀剂的17%TBAB溶液中腐蚀后的XPS谱图.图6(a)表明锌表面含有Zn、O、P、N等元素.Zn 2p3/2结合能为1021.3和1022.4 eV处分别为 Zn0和 Zn2+的特征峰[9-10].O 1 s在530.4、532.6和531.5 eV处的特征峰表明O分别以O2-、的形式存在[9-10],结合能 399.6和133.4eV 分别对应于 N 1s[6]和 P 2p[10]的特征峰.
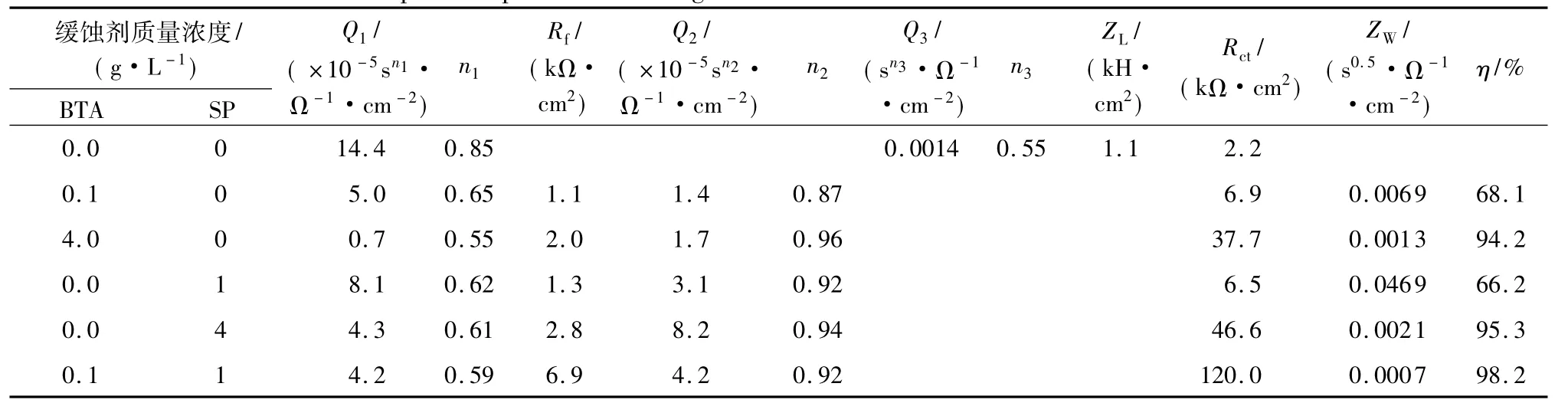
表3 17%TBAB溶液中锌电极的交流阻抗参数1)Table 3 Impedance parameters during corrosion inhibition of zinc in 17%TBAB solutions

图6 锌在含复配缓蚀剂的17%TBAB溶液中腐蚀后的XPS谱图Fig.6 XPS spectra of zinc immersed in 17%TBAB solution containing combined corrosion inhibitor
2.5 缓蚀机理分析
BTA是众多金属的优异缓蚀剂,许多研究者认为BTA的缓蚀作用来自于BTA与金属表面形成金属-BTA的络合物.最近的一些研究表明BTA与Zn在金属的表面形成[Zn(BTA)2]m络合膜,从而有效抑制金属的溶解[3-8].磷酸盐也是工业中常用的缓蚀剂.磷酸盐与锌作用,形成了含有 ZnO、Zn(OH)2和Zn3(PO4)2的保护薄膜[9-11].从表1-3中的结果可以看出,BTA和Na3PO4均对锌有缓蚀作用,且缓蚀效率随缓蚀剂质量浓度的增大而提高.将0.1g/L BTA与1g/L Na3PO4复配使用时,缓蚀作用增大.由SEM和XPS的结果可知,这种协同效应可能是由于Na3PO4在锌的表面形成含有ZnO、Zn(OH)2和Zn3(PO4)2的保护层,而BTA可以吸附在该保护层的表面或者镶嵌在保护层的内部,使保护层的稳定性增强,从而增加了对锌的保护能力.
3 结语
采用静态失重法、动电位极化曲线法、电化学交流阻抗法、扫描电镜和X射线光电子能谱法研究BTA和SP对锌腐蚀的抑制作用,发现在质量分数为17%(0.534mol/L)的TBAB溶液中,BTA和Na3PO4对锌腐蚀具有缓蚀协同效应,两者复配时可以以更低的质量浓度达到较高的缓蚀效率.更多复配比下的缓蚀协同效应还有待进一步研究.
[1] 宋文吉,肖睿,董凯军,等.TBAB包络化合物浆水平管内的传热特性研究[J].工程热物理学报,2009,30(9):1502-1504.Song Wen-Ji,Xiao Rui,Dong Kai-jun,et al.Investigation on convective heat transfer of TBAB clathrate hydrate slurry in a cylinder pipe with constant heat flux[J].Journal of Engineering Thermophysics,2009,30(9):1502-1504.
[2] Liu S,Xu N N,Duan J M,et al.Corrosion inhibition of carbon steel in tetra-n-butylammonium bromide aqueous solution by benzotriazole and Na3PO4[J].Corrosion Science,2009,51(6):1356-1363.
[3] Wippermann K,Schultze J W,Kessel R,et al.The inhibition of zinc corrosion by bisaminotriazole and other triazole derivatives[J].Corrosion Science,1991,32(2):205-230.
[4] Jinturkar P,Guan Y C,Han K N.Dissolution and corrosion inhibition of copper,zinc,and their alloys[J].Corrosion,1998,54(2):106-114.
[5] Sirtori V,Zambon F,Lombardi L.XPS and ellipsometric characterization of zinc-BTA complex [J].Journal of Electronic Materials,2000,29(4):463-467.
[6] Aramaki K.Effects of organic inhibitors on corrosion of zinc in an aerated 0.5 M NaCl solution [J].Corrosion Science,2001,43(10):1985-2000.
[7] Fenelon A M,Breslin C B.An electrochemical study of the formation of benzotriazole surface films on copper,zinc and a copper-zinc alloy[J].Journal of Applied Electrochemistry,2001,31(5):509-516.
[8] Kosec T,Merl D K,Milošev I.Impedance and XPS study of benzotrizole films formed on copper,copper-zinc alloys and zinc in chloride solution [J].Corrosion Science,2008,50(7):1987-1997.
[9] Aramaki K.The inhibition effects of chromate-free,anion inhibitors on corrosion of zinc in aerated 0.5 M NaCl[J].Corrosion Science,2001,43(3):591-604.
[10] Aramaki K.Improvement in the self-healing ability of a protective film consisting of hydrated cerium(Ⅲ)oxide and sodium phosphate layers on zinc[J].Corrosion Science,2003,45(2):451-464.
[11] Bastos A C,Ferreira M G S,Simoes A M.Comparative electrochemical studies of zinc chromate and zinc phosphate as corrosion inhibitors for zinc[J].Progress in Organic Coatings,2005,52(4):339-350.
[12] 王新葵,李宁,张景双,等.苯并三氮唑对锌的缓蚀行为[J].材料保护,2002,35(7):15-16.Wang Xin-kui,Li Ning,Zhang Jing-shuang,et al.Inhibitor behavior of 1,2,3-benzontriazole for zinc [J].Materials Protection,2002,35(7):15-16.
[13] Manov S,Lama zouère A M,Ariès L.Electrochemical study of the corrosion behaviour of zinc treated with a new organic chelating inhibitor[J].Corrosion Science,2000,42(7):1235-1248.
[14] Amin M A,Abd Ei Rehim S S,Abdel-Fatah H T M.Electrochemical frequency modulation and inductively coupled plasma atomic emission spectroscopy methods for monitoring corrosion rates and inhibition of low alloy steel corrosion in HCl solutions and a test for validity of the Tafel extrapolation method [J].Corrosion Science,2009,51(4):882-894.
[15] Flitt H J,Schweinsberg D P.A guide to polarisation cure interpretation:deconstruction of experimental curves typical of the Fe/H2O/H+/O2corrosion system[J].Corrosion Science,2005,47(9):2125-2156.
[16] Cachet C,Ganne F,Maurin G,et al.EIS investigation of zinc dissolution in aerated sulfate medium(PartⅠ):bulk zinc[J].Electrochimica Acta,2001,47(3):509-518.
[17] 张大全,高立新,周国定,等.苯并三唑和8-羟基喹啉对铜的缓蚀作用[J].物理化学学报,2002,18(1):74-78.Zhang Da-quan,Gao Li-xin,Zhou Guo-ding,et al.Synergistic effects of benzotriazole and 8-hydroxyquinoline combined inhibitors on copper corrosion[J].Acta Physico-Chimica Sinica,2002,18(1):74-78.
[18] Shao Y,Huang H,Zhang T,et al.Corrosion protection of Mg-5Li alloy with epoxy coatings containing polyaniline[J].Corrosion Science,2009,51(12):2906-2915.
[19] Budruk Abhijeet S,Balasubramaniam R,Gupta M.Corrosion behaviour of Mg-Cu and Mg-Mo composites in 3.5%NaCl[J].Corrosion Science,2008,50(9):2423-2428.
