白假丝酵母活性代谢物种类及分离技术的研究进展
2011-01-24王慧曹颖瑛李燕谭光国朱臻宇
王慧,曹颖瑛,李燕,谭光国,朱臻宇
1. 第二军医大学药学院,上海 200433; 2. 北京中国人民解放军总后勤部郑常庄干部休养所,北京 100141
白假丝酵母是一种人类常见条件致病真菌,通常存在于正常人口腔、上呼吸道、肠道及阴道,在人体抵抗力下降时会引起感染甚至危及生命。近年来,深部真菌感染日益成为医院内主要感染,其中白假丝酵母成为假丝酵母感染中最常见的病原[1]。
白假丝酵母是一种具有多种形态的真菌,形态有厚膜孢子、酵母、假菌丝、菌丝等。其中菌丝相与酵母相的转化被认为是影响致病的重要因素。已有许多研究证实,不产生菌丝相的基因缺陷型白假丝酵母在动物模型中致病性降低,而酵母相的白假丝酵母则有助于播散性感染[2]。生物被膜是由酵母细胞、菌丝和细胞外多聚基质3部分组成的一种结构群体[1]。在白假丝酵母中,生物被膜的形成会使其对一些临床常用抗真菌感染药物产生高度耐药性。因此,白假丝酵母的形态变化对其在宿主环境下的生存、致病及耐药性有很大意义。在白假丝酵母形态转化过程中,能自发向细胞外释放一些特定信号分子,调节微生物的密度变化,这类小分子物质称为群体感应分子(quorum sensing molecule)。目前白假丝酵母中已确定的群体感应分子有法尼醇(farnesol)、酪醇(tyrosol)和麝油酸(farnesoic acid)[3]。此外,不同形态的白假丝酵母对氨基酸的摄取不完全相同,甚至存在很大差异[4]。
在宿主中生存时,受大量外界环境的影响,如宿主的免疫系统、渗透性、温度、pH值、氧化水平、养分有效性、氧化还原态等,白假丝酵母会发生很大变化,承受极大的外界压力。处于逆境中的白假丝酵母会于数分钟内在基因和代谢水平上作出适当反应,最终使细胞获得对逆境的抗性[5]。这些对外界环境产生的应激性使白假丝酵母快速适应外界环境,对其耐药性的产生起一定作用。当处于对数生长期的白假丝酵母面临高温、NaCl、H2O2、CuSO4、高浓度乙醇、弱有机酸(山梨酸酯和苯甲酸)等胁迫时,会不同程度引起细胞内海藻糖(trehalose)浓度上升[5-7];受高渗和柠檬酸影响时会积累大量甘油(glycerol);受高温和氧化应激时会生成大量阿拉伯糖醇(D-arabitol)[8],这些化合物都对白假丝酵母的生物大分子有一定的保护作用。
1 胞外活性代谢物
白假丝酵母在生长过程中,会产生一些有机化合物,分泌至胞外,其中部分为群体感应分子。对这类化合物的提取和分离主要是收集培养上清液,再对培养上清液进行一系列处理,然后供分析。
1.1 法尼醇
法尼醇是第1个被发现的白假丝酵母生长过程中分泌的胞外群体感应分子[9]。有文献报道,它能影响白假丝酵母的双相性和被膜生长,抑制芽管形成[10],抑制酵母向菌丝转化[11],抑制被膜形成;同时也会增强由H2O2等引起的氧化性应激下白假丝酵母的存活率[12],是目前发现的白假丝酵母中作用最强、研究最多的群体感应分子。
法尼醇是挥发性的萜类化合物,因此常用气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)进行检测。 Hornby等[10]将收集的含法尼醇的培养上清液进行过滤后直接进样,或采用乙酸乙酯液-液萃取,进一步提纯其中脂溶性有效成分,并分别采用反相高效液相色谱-质谱(reversed-phase high performance liquid chromatography-mass spectrometry,RP-HPLC-MS)、衍生化GC-MS、薄层色谱法(thin layer chromatography,TLC)对法尼醇进行鉴定。而Ghosh等[13]也是将培养上清液过滤后,用液-液萃取(乙酸乙酯)结合GC-MS方法来分离、检测法尼醇。与Hornby等不同的是,样品并未进行衍生化处理,若采用己烷或乙酸乙酯/己烷(1∶4)萃取上清液,只适用于提取法尼醇;而用乙酸乙酯萃取,可同时提取白假丝酵母中苯乙醇(phenylethyl alcohol)、法尼醇、色醇(tryptophol)和酪醇4种小分子。Martins 等[14]采用顶空固相微萃取(headspace-solid phase microextraction,HS-SPME)/GC-MS同时测定浮游和被膜型白假丝酵母中异戊醇、2-苯乙醇、1-十二醇、橙花叔醇和法尼醇等醇类化合物。Gregus等[15]采用乙腈沉淀蛋白的方法处理样品后,用超高效液相色谱-质谱 (ultra-performance liquid chromatography-mass spectrometry,UPLC-MS)测定尼醇和酪醇。
1.2 麝油酸
Oh等[16]最早分离出麝油酸,并发现其能抑制酵母向菌丝转化。与法尼醇相比,麝油酸的分泌有局限性,仅能在特定菌株中表达,且作用相对较弱,仅为法尼醇的3%[3]。高浓度麝油酸可抑制白假丝酵母菌丝生长,但不抑制酵母生长[16,17]。相对法尼醇,麝油酸对酵母向菌丝形态转化的选择性更强[18]。
Oh等[16]将培养上清液冻干,用甲醇复溶,离心后取上清液;再用旋转蒸发仪将甲醇溶液挥干,用己烷复溶;正相高效液相色谱(normal-phase high performance liquid chromatography,NP-HPLC)进行分离,收集流出的有效成分;挥干,用0.1 ml的90%乙腈复溶,RP-HPLC进行梯度洗脱,获得麝油酸单体;并用GC-MS和核磁共振波谱(nuclear magnetic resonance,NMR)进行结构鉴定。
1.3 酪醇
Chen等[19]指出,酪醇的分泌会促进菌丝生长,从而缩短转化时间。在利于菌丝生长的条件下,酪醇还会缩短细胞发展成芽管的时间,促进芽管形成,该作用在被膜生长的早期和中期最为显著[20]。
Chen等[19]固相萃取、富集白假丝酵母培养液后,用RP-HPLC纯化、制备酪醇,并对其结构进行NMR鉴定。Alem等[20]改良了上述方法,缩短了酪醇的出峰时间。Ghosh等[13]采用乙酸乙酯液-液萃取结合GC-MS的方法分离、鉴定酪醇,该法同样可用于测定白假丝酵母中苯乙醇、法尼醇、色醇等其他小分子。魏昕等[21]将生物被膜培养上清液离心、抽滤后,采用HPLC检测酪醇。Gregus等[15]将收集的液体用乙腈沉淀蛋白后,采用UPLC-MS测定酪醇,同时测定了法尼醇和酪醇。
1.4 苯乙醇和色醇
有报道,苯乙醇和色醇在白假丝酵母中起抑制菌丝形成和细胞生长的作用,但这2个化合物对白假丝酵母形态的影响机制尚不明确[3,22],但要达到500 μmol/L才能抑制丝化现象[22],所以其在正常浓度范围内抑制菌丝的作用有待进一步研究。此外,研究还发现色醇具有细胞毒性[22]。Lingappa等[22]用氯仿萃取培养上清液,用MS鉴定这2种化合物。Hazen等[23]采用将上清液过滤后以GC方法测定苯乙醇和色醇。Kosalec等[24]采用液相色谱-质谱(liquid chromatography-mass spectrometry,LC-MS)鉴别和定量色醇。Martins等[14]采用HS-SPME/GC-MS对苯乙醇等醇类进行分析。Ghosh等[13]采用乙酸乙酯液-液萃取方法分离、提纯苯乙醇和色醇,并将浓缩液用GC-MS进行分析。
1.5 MARS
Hazen和Cutler[25]在白假丝酵母研究中发现了一种物质并命名为MARS,它能耐高温,70 ℃下放置30 min还能保持稳定,但在分离48 h后或pH超出4~9.5时,就会失去抑制丝化的活性。不仅白假丝酵母可分泌MARS,热带假丝酵母也可分泌。Hazen 和 Cutler将含MARS的组分用吡啶或乙醚萃取后,经RP-HPLC进一步纯化、收集。经鉴定,MARS有1个含氮杂环结构,能抑制假丝酵母中氨基酸摄取。但MARS分子结构及其在调节白假丝酵母形态转化中的作用仍需深入研究。
2 胞内代谢物
白假丝酵母代谢产生用于合成蛋白质、核酸、类脂和多糖等的一些小分子物质,如氨基酸、核苷酸、有机酸和单糖衍生物等,与微生物细胞内生物合成息息相关。要对这类物质进行分析,首先要进行细胞破碎,目前主要方法有[26,27]化学试剂裂解、低渗溶液胀破、反复冻融和机械性方法,将细胞破碎后才能对胞内代谢物进行下一步研究。
2.1 氨基酸类
氨基酸对白假丝酵母形态转化起一定作用。有文献报道,血清和氨基酸都是已知的能诱导白假丝酵母发生形态转化的物质,但其分子机制仍不明确[28]。氨基酸种类或数量不足也会刺激白假丝酵母的形态变化。白假丝酵母的2种形态对各种氨基酸的摄取需求也不完全相同,甚至存在很大差异[4,29,30]。
早期,对白假丝酵母中氨基酸的分析方法主要是往培养基中加入放射性核素标记的氨基酸(如L-3H-氨基酸),待菌体收集、洗涤完全后,吹干,转移到闪烁瓶中,用液体闪烁计数器计数[6]。近年来,色谱技术广泛运用于氨基酸的分析。Flynn等[31]采用柱前衍生化RP-HPLC对氨基酸进行测定。
2.2 海藻糖
海藻糖是化学性质稳定的非还原性二糖,由2个吡喃葡萄糖分子通过α-1,1-糖苷键连接而成[6]。它是细胞中的一种应激代谢物,当细胞处于长时间饥饿、高渗、热激以及孢子萌发时,海藻糖含量会发生显著变化,恢复正常环境后又迅速降解。因此,海藻糖含量的变化从某种程度上反映了机体对外界环境的响应,在对不同胁迫应答中,海藻糖的积累被认为起关键作用[5,7]。
Pfyffer等[32]采用热乙醇将细胞破碎后,过滤取上清液,再经三甲基硅烷衍生化后进行GC分析,该法可同时测定甘油、核糖醇、阿拉伯糖醇和海藻糖。Cao等[33]和Lu等[34]将细胞以微波破碎后,收集上清液,用HPLC-MS分析海藻糖。Askew等[35]则用热水萃取胞内代谢物,取上清液后用酶法分析海藻糖和甘油。
2.3 甘油和阿拉伯糖醇
白假丝酵母在生长过程中会积累大量甘油和D-阿拉伯糖醇,造成哺乳动物感染。在培养6 h后能产生最大量的甘油,在12 h产生最大量的D-阿拉伯糖醇和核糖醇。这些多元醇的释放与胞外环境有关[36]。
1981年Bernard等[36]将细胞处理后,用三甲基硅醚衍生化,以α-甲基甘露苷作为内标,通过GC定量测定D-阿拉伯糖醇。Pfyffer等[32]采用热乙醇将细胞破碎,过滤取上清液,有效成分经三甲基硅烷衍生化后进行GC分析。该法可同时测定甘油、核糖醇、阿拉伯糖醇和海藻糖,但未能将核糖醇和阿拉伯糖醇分开,且甘油出峰时间较靠前,可能被衍生化试剂的峰掩盖。Kayingo和 Wong[8]以α-甲基甘露苷和α-甲基葡萄糖苷作为内标,通过GC分析同时测定D-阿拉伯糖醇、核糖醇、甘露醇和山梨醇(半乳糖醇),其中将D-阿拉伯糖醇和核糖醇(同分异构体)分离;但该法未能检测甘油,作者进一步将样品酶解后采用紫外吸光度法对甘油进行定量。Wesolowski等[37]和Askew等[35]也采用酶法分析胞内甘油。而Kayingo等[38]则采用放射性核素标记甘油(14C-甘油),收集菌体后,转移到闪烁瓶中,用液体闪烁计数器计数。
3 结语
白假丝酵母的胞内、外活性代谢物种类繁多(表1),功能非常复杂。作为生物体基因表达的终产物,活性代谢物的变化反映了细胞对基因或环境变化的最终响应。通过对活性代谢物种类和含量的动态监测,结合已有的代谢网络数据库进行研究,将为深入探索白假丝酵母自身代谢调节机制提供新的思路。
表1白假丝酵母相关代谢物
Tab.1RelatedmetabolitesofCandidaalbicans
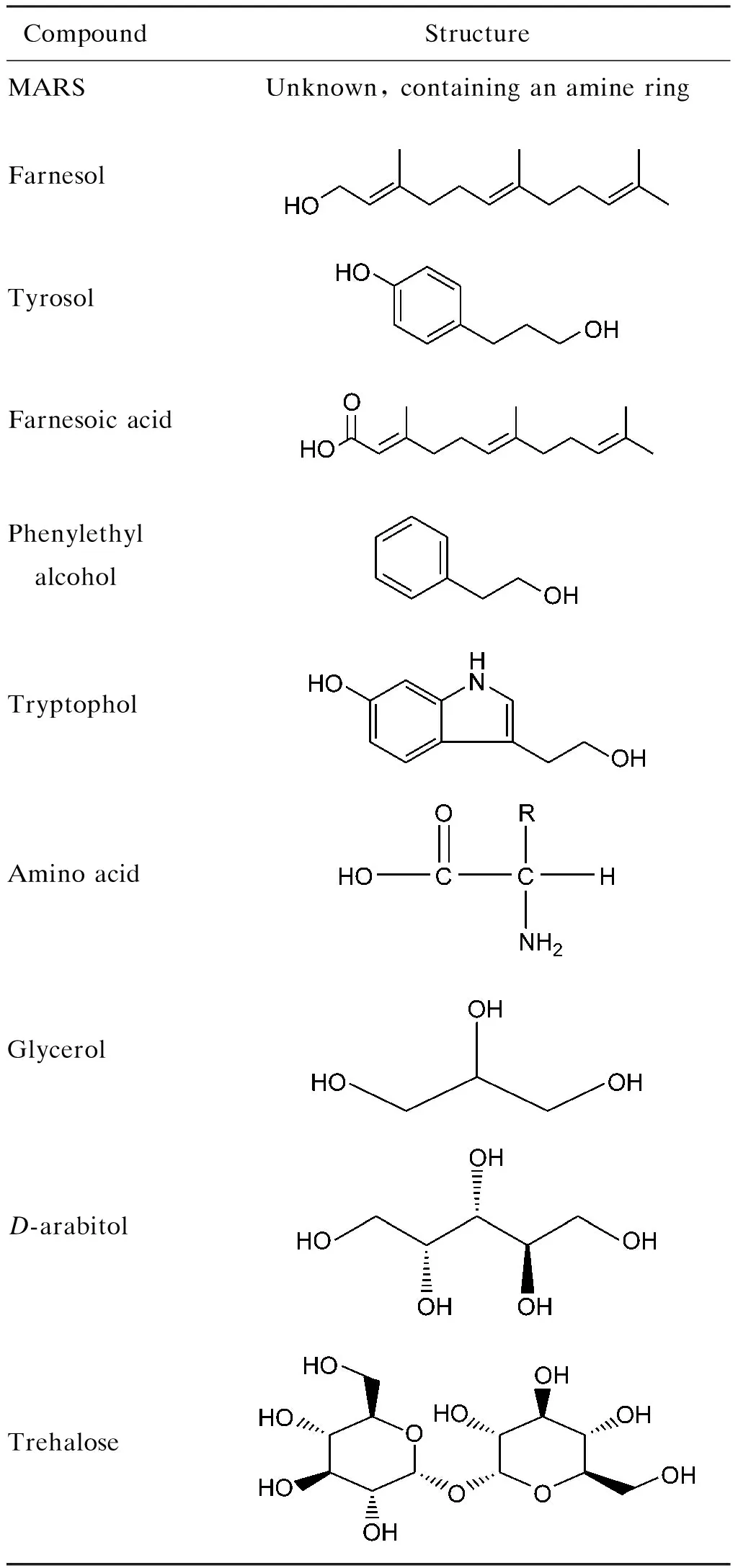
CompoundStructureMARSUnknown, containing an amine ringFarnesolTyrosol Farnesoic acidPhenylethyl alcoholTryptopholAmino acidGlycerolD-arabitolTrehalose
[1] 吴绍熙,郭宁如.深部真菌感染的诊断与治疗. 抗真菌药物与真菌感染诊治研究学术会议论文集[C]. 2003: 21-30. http://www.ilib.cn/A-%E4%BC%9A%E8%AE%AE%E8%AE%B0%E5%BD%95ID~5406214.html.
[2] 刘泽虎. 氨基酸对白念珠菌形态学影响的研究[J].中国真菌学杂志,2009,4(2), 65-69.
[3] Kruppa M. Quorum sensing and Candida albicans. Mycoses, 2008, 52(1): 1-10.
[4] Torosantucci A, Angiolella L, Filesi C, Cassone A. Protein synthesis and amino acid pool during yeast-mycelial transition induced by N-acetyl-D-glucosamine in Candida albicans [J]. J Gen Microbiol, 1984, 130(12): 3285-3293.
[5] Voit EO. Biochemical and genomic regulation of the trehalose cycle in yeast: review of observations and canonical model analysis [J]. J Theor Biol, 2003, 223 (1): 55-78.
[6] 池振明, 梁丽琨, 朱开玲, 张风丽. 酵母海藻糖的代谢与调控研究进展[J]. 中国海洋大学学报, 2006, 36(2): 209-214.
[7] Alvarez-Peral FJ, Zaragoza O, Pedreo, Argüelles JC. Protective role of trehalose during severe oxidative stress caused by hydrogen peroxide and the adaptive oxidative stress response in Candida albicans [J]. Microbiology, 2002, 148(8): 2599-2606.
[8] Kayingo G, Wong B. The MAP kinase Hog1p differentially regulates stress-induced production and accumulation of glycerol and D-arabitol in Candida albicans [J]. Microbiology, 2005, 151(9): 2987-2999.
[9] Nickerson KW, Atkin AL, Hornby JM. Quorum sensing in dimorphic fungi: farnesol and beyond [J]. Appl Environ Microbiol, 2006, 72 (6):3805-3813.
[10] Hornby JM, Jensen EC, Lisec AC, Tasto JJ, Jahnke B, Shoemaker R, Dussault P, Nickerson K. Quorum sensing in the dimorphic fungus Candida albicans is mediated by farnesol [J]. Appl Environ Microbiol, 2001, 67 (7): 2982-2992.
[11] Langford ML, Hasim S, Nickerson KW, Atkin AL. Activity and toxicity of farnesol towards Candida albicans are dependent on growth conditions [J]. Antimicrob Agents Chemother, 2010, 54: (2): 940-942.
[12] Deveau A, Piispanen AE, Jackson AA, Hogan DA. Farnesol induces hydrogen peroxide resistance in Candida albicans yeast by inhibiting the Ras-cAMP signaling pathway [J]. Eukaryot Cell, 2010, 9(4): 569-577.
[13] Ghosh S, Kebaara BW, Atkin AL, Nickerson KW. Regulation of aromatic alcohol production in Candida albicans [J]. Appl Environ Microbiol, 2008,74: (23): 7211-7218.
[14] Martins M, Henriques M, Azeredo J, Rocha SM, Coimbra MA, Oliveira R. Morphogenesis control in Candida albicans and Candida dubliniensis through signaling molecules produced by planktonic and biofilm cells [J]. Eukaryot Cell, 2007, 6(12): 2429-2436.
[15] Gregus P, Vlcková H, Buchta V, Kestranek J, Krivcíková L, Nováková L. Ultra high performance liquid chromatography tandem mass spectrometry analysis of quorum-sensing molecules of Candida albicans [J]. J Pharm Biomed Anal, 2010, 53 (3): 674-681.
[16] Oh KB, Miyazawa H, Naito T, Matsuoka H. Purification and characterization of an autoregulatory substance capable of regulating morphological transition in Candida albicans [J]. Proc Nat Acad Sci USA, 2001, 98: (8): 4664-4668.
[17] Hogan DA. Talking to themselves: Autoregulation and quorum sensing in fungi [J]. Eukaryot Cell, 2006, 5(4): 613-619.
[18] Kim S, Kim E, Shin DS, Kang H, Oh KB. Evaluation of morphogenic regulatory activity of farnesoic acid and its derivatives against Candida albicans dimorphism [J]. Bioorg Med Chem Lett, 2002, 12(6): 895-898.
[19] Chen H, Fujita M, Feng Q, Clardy J, Fink GR. Tyrosol is a quorum-sensing molecule in Candida albicans [J]. Proc Nat Acad Sci USA, 2004, 101: (14): 5048-5052.
[20] Alem MAS, Oteef MDY, Flowers TH, Douglas LJ. Production of tyrosol by Candida albicans biofilms and its role in quorum sensing and biofilm development [J]. Eukaryot Cell, 2006, 5 (10): 1770-1779.
[21] 魏昕, 吴观陵, 刘卫红, 张琰, 胡琴. 白念珠菌的菌体密度与生物被膜形成及tyrosol分泌[J]. 中华微生物学和免疫学杂志, 2010, 30(4): 344-348.
[22] Lingappa PT, Prasad M, Lingappa Y, Hunt DF, Biemann K. Phenethyl alcohol and tryptophol: autoantibiotics produced by the fungus Candida albicans [J]. Science, 1969, 163 (863): 192-194.
[23] Hazen K, Cutler JE. Autoregulation of germ tube formation by Candida albicans [J]. Infect Immun, 1979, 24 (3):661-666.
[24] Kosalec I, Puel O. Isolation and cytotoxicity of low-molecular-weight metabolites of Candida albicans [J]. Front Biosci, 2008, 13: 6893-6904.
[25] Hazen KC, Cutler JE. Isolation and purification of morphogenic autoregulatory substance produced by Candida albicans [J]. J Biochem, 1983, 94 (3): 777-783.
[26] Maharjan RP, Ferenci T. Global metabolite analysis: the influence of extraction methodology on metabolome profiles of Escherichia coli [J]. Anal Biochem, 2003, 313(1): 145-154.
[27] Canelas AB, Pierick AT, Ras C, Seifar RM, Dam JC, Gulik WM, Heijnen JJ. Quantitative evaluation of intracellular metabolite extraction techniques for yeast metabolomics [J]. Anal Chem, 2009, 81 (17):7379-7389.
[28] Brega E, Zufferey R, Mamoun CB. Candida albicans Csy1p is a nutrient sensor important for activation of amino acid uptake and hyphal morphogenesis [J]. Eukaryot Cell, 2004, 3(1): 135-143.
[29] Braun PC. The effect of farnesol on amino acid incorporation by a wild-type and cell-wall variant strain of Candida albicans [J]. Can J Microbiol, 2005, 51(8): 715-718.
[30] Tripathi G, Wiltshire C, Macaskill S, Tournu H, Budge S, Brown AJP. Gcn4 co-ordinates morphogenetic and metabolic responses to amino acid starvation in Candida albicans [J]. EMBO J, 2002, 21(20): 5448-5456.
[31] Flynn NE, Patyrak ME, Seely JB, Wu GY. Glycine oxidation and conversion into amino acids in Saccharomyces cerevisiae and Candida albicans [J]. Amino Acids, 2010, 39(2): 605-608.
[32] Pfyffer GE, Rast DM. Accumulation of acyclic polyols and trehalose as related to growth form and carbohydrate source in the dimorphic fungi Mucor rouxii and Candida albicans [J]. Mycopathologia, 1989, 105(1): 25-33.
[33] Cao YY, Wang Y, Dai BD, Wang B, Zhang H, Zhu ZY, Xu YG, Cao YB, Jiang YY, Zhang GQ. Trehalose is an important mediator of Cap1p oxidative stress response in Candida albicans [J]. Biol Pharm Bull, 2008, 31(3): 421-425.
[34] Lu H, Zhu ZY, Dong LL, Jia XM, Sun XR, Yan L, Chai YF, Jiang YY, Cao YY. Lack of trehalose accelerates H2O2-induced Candida albicans apoptosis through regulating Ca2+signaling pathway and caspase activity [J]. PLoS One, 2011, 6(1): e15808.
[35] Askew C, Sellam A, Epp E, Hogues H, Mullick A, Nantel A, Whiteway M. Transcriptional regulation of carbohydrate metabolism in the human pathogen Candida albicans[J]. PLoS Pathog, 2009, 5(10): e1000612.
[36] Bernard EM, Christiansen KJ. Rate of arabinitol production by pathogenic yeast species [J]. J Clin Microbiol, 1981, 14(2): 189-194.
[37] Wesolowski J, Hassan RYA, Reinhardt K, Hodde S, Bilitewski U. Antifungal compounds redirect metabolic pathways in yeasts: metabolites as indicators of modes of action [J]. J Appl Microbiol, 2010, 108 (2): 462-471.
[38] Kayingo G, Martins A, Andrie R, Neves L, Lucas C, Wong B. A permease encoded by STL1 is required for active glycerol uptake by Candida albicans [J]. Microbiology, 2009, 155 (Pt 5): 1547-1557.
