毕赤酵母工程菌 pk53产纤溶酶发酵条件的优化*
2011-01-13焦龙于宏伟郭润芳白玉贾英民
焦龙,于宏伟,郭润芳,白玉,贾英民
人体内的血栓常引发严重的心血管疾病,发病突然,死亡率极高,溶栓治疗是抢救与治疗此类疾病的常用手段[1]。纤溶酶能分解血栓的主要骨架纤维蛋白从而溶解血栓,以恢复血流通畅,促进组织恢复。该酶在发挥溶栓作用时,不水解血浆纤维蛋白质,故不易引起出血倾向,因此具有广阔的研究开发前景[2]。
巴斯德毕赤酵母 (Pichia pastoris)表达系统是目前最优秀、应用最广泛的外源基因表达系统之一[3],它在表达异源蛋白上具有诸多优点[4],能使外源真核基因正确地翻译和翻译后加工,并能对许多蛋白质产物进行分泌,使产物易于提纯。目前毕赤酵母工程菌摇瓶培养所采用的培养基是用以甘油为碳源的细胞增殖培养基 (BMGY)作为基础生长培养基,然后用以甲醇为碳源的诱导培养基 (BMMY)表达产酶。BMGY与 BMMY价格昂贵,不适宜工业化生产[5]。本实验在前期已构建产纤溶酶的基因工程菌菌株基础上,对产纤溶酶毕赤酵母基因工程菌的培养基进行研究,旨在找到一种廉价的培养基配方,并对其液态发酵条件进行优化,以确定最佳产酶条件。
1 材料与方法
1.1 材料
1.1.1 菌种
毕赤酵母工程菌 (pichia pastoris)pk53:河北农业大学食品科技学院酶工程实验室构建并保存。
1.1.2 培养基
10 ×D(20%Dextrose,葡萄糖 ):将 200 gD-葡萄糖溶于 1 000 mL去离子水中,过滤除菌或高压灭菌 15 min,4℃保存备用。
YPD培养基[6]:称取蛋白胨 20 g,酵母抽提物 10 g溶于 900 mL去离子水中,高压灭菌 20 min,冷却后加入 100 mL 10×D贮液,4℃保存,制备平板时加 15 g/L琼脂粉。
基础生长培养基:甘油 1%,豆粕粉 2%,KH2PO40.3%,MgSO4·7H2O 0.03%,pH 6.0。
诱导培养基:甲醇 1%,豆粕粉 2%,KH2PO40.3%,MgSO4·7H2O 0.03%,pH 6.0。
1.2 方法
1.2.1 种子培养
将基因工程菌划线于 YPD平板,28℃培养至长出单菌落。从平板挑单菌落到 YPD液体培养基中,摇床 28℃,200 r/min培养 12 h,作为接种用的种子。
1.2.2 发酵培养
在 250 mL三角瓶中装入发酵培养基 30 mL,种子接种量为 1%,200 r/min,28℃恒温振荡培养 24 h后,将菌体接入摇瓶诱导培养基,每隔 24 h再添加1%甲醇诱导培养 144 h。在 96、108、120、132 h分别取发酵液,离心取上清液作为粗酶液,测定酶活和OD600。将最大酶活力,最大 OD600设为 100%。
1.2.3 酶活测定
定性酶活测定采用纤维蛋白平板法与采用分光光度计法[7]。
1.2.4 生物量测定
采用细胞光密度 (OD600)分析法:将菌液稀释后,于波长 600 nm处,以去离子水为对照进行比色测定。OD600=OD600读数 ×稀释倍数。
2 结果与分析
2.1 发酵培养基的优化
2.1.1 生长阶段不同碳源对产酶的影响
分别以 1%葡萄糖、糊精、蔗糖、玉米粉、麦芽糖、可溶性淀粉、甘油和麸皮为唯一碳源替代基础培养基中碳源进行培养工程菌 pk53,结果如图1。在供试碳源中,工程菌 pk53在糊精中生长最好,但促进产酶能力较低;在麸皮中生长良好,促进产酶能力最高;其他碳源对产酶促进能力均有所下降。麸皮具有来源广泛,价格低廉,营养丰富的特点,因此选择其作为碳源。

图1 不同碳源对产酶和生长的影响
2.1.2 生长阶段不同氮源对产酶的影响
分别以 2%豆粕粉、蛋白胨、氨水、牛肉膏、(NH4)2SO4、NH4NO3、KNO3为唯一氮源进行培养 ,结果 (图2)发现 ,无机氮源 (NH4)2SO4、NH4NO3、KNO3促进产酶能力相对较低且不利于菌体生长,而有机氮源有利于促进产酶且菌体生长量较大,其中以豆粕粉为氮源时对菌体产酶促进能力最大。

图2 不同氮源对产酶和生长影响
2.1.3 诱导阶段不同氮源对产酶的影响
分别以 2%豆粕粉、蛋白胨、氨水、牛肉膏、(NH4)2SO4、NH4NO3、KNO3为唯一氮源进行培养 ,结果 (图3)发现,有机氮源有利于产酶且菌体生长量较大,其中以蛋白胨为氮源时发酵液酶活最大,牛肉膏、豆粕粉次之,但蛋白胨、牛肉膏相对价格较高,因此本试验采用豆粕粉作为菌株发酵产纤溶酶的最适诱导氮源。在无机氮源中,以氨水的产酶和菌体生长量为最高。(NH4)2SO4、NH4NO3、KNO3产酶活力和菌体生长量相对较低,可能是这些氮源缺少酶合成所需要的某种成分。

图3 不同氮源对产酶和生长影响
2.1.4 培养基成分的正交试验
对 3个主要营养源:麸皮、豆粕粉、KH2PO4的不同配比对菌株产酶促进能力的协同效应进行了研究。采用正交实验,试验数据和处理结果见表1。依据正交试验的直观分析结果,极差值R(麸皮)>R(KH2PO4)>R(豆粕粉),因此 ,麸皮为主要影响因素 ,KH2PO4的影响次之,豆粕粉的影响最小。最佳组合为 A3B1C3D2。由表2的方差分析结果看出,麸皮、KH2PO4对产酶促进能力影响差异极显著,豆粕粉对产酶促进能力影响差异不显著。在试验因子水平范围内,促进产酶能力最高的组合为 A3B1C3D2,由于正交试验处理中包含有该工艺条件组合,因此在该因子组合下进行发酵试验。结果表明,在优化的培养基条件下发酵,纤溶酶活力为 110.92 U/mL。根据单因素及正交试验结果,确定培养基优化配比为:麸皮 1.5%、豆粕粉 2%、KH2PO40.5%。
2.2 发酵条件的优化
2.2.1 种龄对工程菌 pk53产酶的影响
分别取处于对数生长期 10、12、14、16、18、20 h的种子液接种,测定酶活力和OD600。结果如图4。结果表明,菌龄为对数生长 10~18 h的菌种发酵过程中,其生物量随菌龄增大而增加,18 h达到最大,之后下降。而菌种酶活力最高的接种种龄为对数生长14 h的菌种,14 h后的菌种酶活力大大下降。选择酶活力最高的菌种做种子液,据图4结果,选择最适接种龄为对数生长 14 h。
2.2.2 接种量对工程菌 pk53产酶的影响

图4 接种龄对产酶和生长的影响
接种量对发酵产酶有一定的影响。接种量过大,培养基消耗快,在进入稳定期后反而不利于产物的合成。反之,接种量过小,菌体生长缓慢,导致发酵周期延长。本试验种子液接种量分别为 0.5%、1%、1.5% 、2%、2.5%,测定酶活力和OD600,结果表明(图5),随接种量增大,菌浓度逐步提高,2%达到最高。但由酶活测定结果可见接种量为 1%时菌体酶活力最高,高于低于 1%接种量菌体酶活力均减少。因此确定 1%为最适接种量。
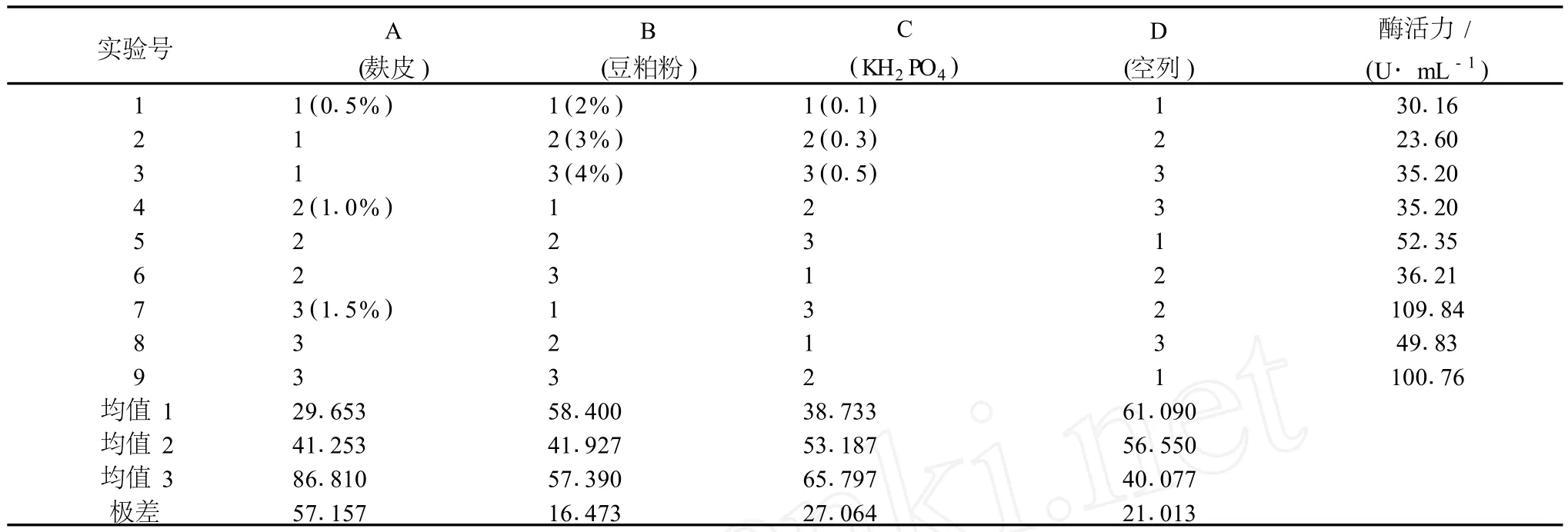
表1 L9(34)正交试验表

表2 培养基成分的方差分析
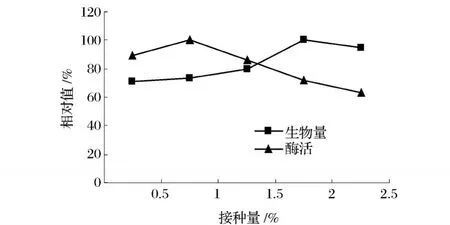
图5 接种量对产酶和生长的影响
2.2.3 甲醇添加量对工程菌 pk53产酶的影响
按摇瓶培养的方法每 24 h补加甲醇,添加量分别为 0.5%,1%,1.5%,2%,2.5%,测定酶活力和OD600。结果如图6。在甲醇浓度为 0.5%~1.5%范围时,菌体生物量和酶活力都在逐步增加,但甲醇添加量高于 1.5%时,菌体生物量和酶活力都在下降。甲醇是工程菌诱导产酶阶段的唯一碳源和能源,如果其代谢消耗速率跟不上所加入的速率而在发酵液中累积时,会对菌体本身有伤害,限制菌体的生长,而且还会对酶的表达有抑制作用,导致酶活性下降[8]。所以确定甲醇添加量为 1.5%。
2.2.4 培养基 pH值对工程菌 pk53产酶的影响
2.2.4.1 生长阶段初始 pH值对工程菌 pk53产酶的影响
调节生长培养基 pH值为 4.0,4.5,5.0,5.5,6.0,6.5,测定酶活力和OD600。结果由图7可知,pH值为 4.0~5.0时菌体生物量逐步增大,pH值为 5.0~6.5时菌体生物量变化不大,且 pH值为 5.5时菌体酶活力最高,所以确定最适初始 pH值为 5.5。

图6 甲醇浓度对产酶和生长的影响

图7 生长阶段 pH对产酶和生长的影响图
2.2.4.2 诱导阶段初始 pH值对工程菌 pk53产酶的影响
调节诱导培养基 pH值为 4,4.5,5,5.5,6.0,6.5,测定酶活力和OD600。结果由图8所示,随 pH值的增加,越不利菌体生长,酶活力却逐渐升高,pH为 6.0时产酶最高,当 pH高于 6.0时,随 pH增加酶活逐渐下降。说明 pk53产酶量并不单纯取决于生物量,还与单位菌体产酶量相关,通过诱导阶段初始 pH的优化提高了 pk53产纤溶酶的比生产率。所以确定诱导阶段初始 pH值为 6.0。

图8 诱导阶段 pH对产酶和生长的影响
2.2.5 装液量对工程菌 PK53产酶的影响
通过改变装液量控制溶氧,调整 250 mL三角瓶中装液量分别为 20、30、40、50、60 mL测定酶活力和OD600,结果如图9。

图9 装液量对产酶和生长的影响
结果表明,装液量大于 30 mL时,酶活力随着装液量的增加而显著下降;装液量小于 30 mL时,酶活力也下降,生物量的变化与酶活力的变化呈正相关。说明生物量大小与溶氧对 pk53产酶影响是偶联的,因此确定 30 mL/250 mL的装液量为宜。
2.3 工程菌 pk53发酵过程曲线
在上述优化的发酵工艺条件下,连续诱导 144 h,每隔 24 h取样测酶活。结果显示 (图10),随着诱导时间的延长,发酵液的酶活力逐渐升高,96 h到达最高,上清的酶活力为 429.06 U/mL,随后发酵液的酶活力下降,可能与衰老细胞释放出的蛋白水解酶有关[10]。优化发酵条件前,诱导 120h达到最大酶活为48.31 U/mL,发酵活力提高了 8.88倍,产酶高峰提前 1 d。表明采用优化的工艺条件,不仅大大提高了发酵产量,且缩短了发酵周期。

图10 纤溶酶 pk53发酵曲线
3 结论与讨论
本试验菌株 pk53遗传表型Mut+,醇氧化酶启动子 AOX1,载体 pPIC9K。其最佳培养基组成:麸皮1.5%,豆粕粉 2.0%,,KH2PO40.5%,MgSO4·7H2O 0.05%;最佳培养条件:接种龄 14 h,接种量 1%,甲醇添加量 1.5%,培养基装液量 30 mL(250 mL三角瓶),生长 pH值 5.5,诱导 pH值 6.0。在此条件下培养,纤溶酶酶活力达 429.06 U/mL,是初始发酵条件下产酶活力的 8.88倍。
试验发现促进产酶的主要影响因素为麸皮。麸皮中含有较丰富的酶系、蛋白质、碳水化合物、维生素和矿物质等[11],推测麸皮中可能存在某种“刺激因子”能够促进毕赤酵母基因工程菌 PK53产纤溶酶。这一研究结果与刘明启,孙建义等人[12]的报道一致,利用麸皮做碳源来促进外源目的蛋白的表达。
本试验采用两阶段调控法研究了基因工程菌PK53在菌体生长和诱导表达阶段的最适初始 pH值,研究发现菌体生长阶段初始 pH值为 5.5,诱导产酶阶段初始 pH值为 6.0时纤溶酶表达量显著提高。国内也有类似报道,不同阶段采用变 pH发酵,提高目的蛋白表达量[13-15]。发现甲醇毕赤酵母对溶解氧的需求很大,但也不是溶氧越高越好。试验中装液量20 mL反而比 30 mL产酶低,可能因为溶氧过多造成氧中毒[9],但氧气不足则限制菌体生长,进行厌氧发酵产生乙醇且会积累甲醇。
毕赤酵母工程菌常规培养基为 BMGY与 BMMY,但成分复杂,价格较高[16]。目前,研究多集中在产植酸酶的酵母工程菌培养基的优化。李洪淼等人制成麦芽-麸皮培养基,用于培养植酸酶毕赤酵母工程菌 PP-NPm-8[17]。洒荣波等人制成葡萄糖、氨水培养基,用于培养植酸酶毕赤酵母工程菌 K M71[18]。本试验研制的产纤溶酶毕赤酵母工程菌培养基在国内尚没发现类似报道。培养基中的组分麸皮,豆粕粉具有来源广,成本低的特点,更利于工业化生产。下一步我们将通过发酵罐培养对 pH、供氧等发酵条件进行控制和优化。
[1] 刘彩平,崔堂兵.产纤溶酶微生物的筛选鉴定及生长模型的建立[J].食品与发酵工业,2010,36(6):12-15.
[2] 李宝库 ,周岩,靳玉卯,崔哲 .纤溶酶产生菌液体培养条件的研究[J].中国酿造,2008(14):29-31.
[3] Sreekrishna K,Brankamp R G,Kropp K E,et al.Strategies for optimal synthesis and secretion of heterologous p roteins in the methylotrophic yeastPichia pastoris[J]. Gene,1997,190(1):55-621.
[4] 戴秀玉,一种值得注意的基因表达系统 -巴斯德毕赤酵母[J].微生物学报,1997,36(7):483.
[5] 王海宽,路福平 .培养条件对甲醇毕赤酵母异源表达木质素过氧化物酶的影响[J].天津科技大学学报,2007,22(1):33-36.
[6] Klaus W(ed).Nonconventional Yeasts in Biotechnology[M].Berlin:Springer,1996:203-253.
[7] Hanxin-mian,Guo Run-fang.Cloning and expression of one fibrinolytic enzyme fromBacillussp.zlw~2[J].Agricultural Sciences in China.2009,8(5):591-596.
[8] 李洪淼,王红宁 .毕赤酵母高密度发酵研究进展[J].生物技术通讯,2005,16(2):210-212.
[9] 林俊涵 .毕赤酵母高密度发酵工艺的研究[J].中国生物工程杂志,2009,29(5):120-125.
[10] 邱荣德,朱建蓓,王垒.人 p53蛋白在巴氏德毕赤酵母中的表达[J].生物工程学报 .1999.15(4):477-481.
[11] 郭祯祥,李利民,温纪平 .小麦麸皮的开发与利用[J].粮食与饲料工业,2003(6):43-45.
[12] 刘明启,孙建义 .重组毕赤酵母产木聚糖酶条件的优化[J].浙江大学学报,2006,32(2):222-226.
[13] 谢子文.工程菌产植酸酶摇瓶发酵条件初探[J].中国饲料,2007(3):13-16.
[14] 李洪淼,王红宁 .重组巴斯德毕赤酵母高密度发酵表达植酸酶[J].中国生物工程杂志,2005,2(16):295-298.
[15] 姚钰舜,储炬,杭海峰 .培养条件对重组毕赤酵母高密度表达猪胰岛素前体的影响 [J].华东理工大学学报:自然科学版,2006,32(4):397-401.
[16] 王平章 .植酸酶phyA基因转化毕赤酵母的筛选及工程菌培养基研究[D].成都:四川农业大学学位论文,2002.
[17] 李洪淼 .植酸酶毕赤酵母基因工程菌发酵条件研究[D].成都:四川农业大学学位论文,2005.
[18] 洒荣波,石贵阳,王正祥 .基因工程菌Pichia pastoris高密度培养条件的摇瓶研究[J].食品研究与开发,26(2):52-56.
