微波辅助提取红菊芋色素及稳定性研究
2011-01-13王丽威郑彦山张晓宇于涛吴祥云孔涛
王丽威,郑彦山,张晓宇,于涛,吴祥云,孔涛
菊芋,学名Jerusalem artichoke(Helianthus tubeuosus),别名洋姜、鬼子姜、地姜等,为菊科向日葵属多年生草本植物,地下形成块茎。按块茎皮色可分为白皮和红皮 2个品种。白皮菊芋菊芋菊粉含量较低,水分较多,适宜腌制咸菜,红皮菊粉含量可达 14%~19%,适宜加工菊粉。菊芋的根系发达,繁殖力强,耐寒、耐旱,生产成本低,产量大。近年来,一些地区将其种植在沙地、荒坡、滩涂、沟沿、盐碱地等贫瘠的土地,用于防风固沙、保持水土和改良土壤。菊糖,作为世界公认的“双歧因子”,已经引起广泛的关注。国内外许多学者在研究从红菊芋中提取菊糖和进一步降解菊糖生产高果糖浆、低聚果糖或发酵生产乙醇等方面取得了大量的成果,而对于红菊芋色素的利用还未见报道。花色苷是自然界一类广泛存在于植物中的水溶性天然色素,属多酚类化合物,是一类具有保健功能的活性成分。国内外大量研究表明,花色苷具有很强的抗氧化、抗突变、抗肿瘤、抗过敏、抗炎、保护胃黏膜、肝脏及改善视力等多种功能[1-6]。
本文以红菊芋皮为原料,研究了其红色素的微波辅助提取工艺及其稳定性,为菊芋的综合利用提供一条新的途径。
1 材料与设备
1.1 材料
红菊芋,产于辽宁省阜新市农业园区,10月上旬采收。新鲜菊芋经清洗、剥皮得到菊芋红皮,40℃,真空干燥 3~4 d,粉碎,放入干燥器中保存。
1.2 主要仪器
PHS-3C型精密 PH计 (上海精密科学仪器有限公司),DZK W-4恒温水浴锅 (上海精密科学仪器有限公司),UV1810PC紫外可见分光光度计 (上海精密科学仪器有限公司),G8023YSL-V1微波炉 (格兰仕集团),R-200型旋转蒸发仪 (巩义市予华仪器有限责任公司)。
2 试验方法
2.1 提取方法
精确称取一定量的菊芋外皮粉末放入锥形瓶中,加入一定量的提取剂,置于预热的微波炉中,提取一定时间后,转移至离心管中,6 000 r/min离心 5 min,取上清液,得色素粗提液。试验中以提取液在最大波长下的吸光度值为试验指标,采用单因素试验和正交试验设计,研究乙醇浓度、料液比、微波功率和提取时间等因素对提取效果的影响,其正交试验因素水平如表1。

表1 因素水平表
2.2 纯化方法
将色素粗提液用旋转蒸发仪在 (40±1)℃,(40±2)r/min的条件下减压浓缩,得红色浓浆。调整乙醇体积分数至 80%,沉淀除去糖分和蛋白质;滤液经减压蒸发去乙醇后,用石油醚萃取,以除去脂溶性的杂质;萃取后得到的水相再用乙酸乙酯萃取,所得水相经减压蒸发去除残留的乙酸乙酯,得初步纯化的色素。将初步纯化的色素按侯方丽等方法用 AB-8大孔吸附树脂进行纯化[7]。
2.3 稳定性试验方法
取一定量纯化的色素样品经适当稀释后,分别经过处理,以保存率为试验指标,研究光、热对红菊芋色素稳定性的影响。
2.4 试验指标测定方法
2.4.1 红菊芋色素提取液的紫外可见光谱分析
精确称取 2.000 0 g样品放入 50 mL容量瓶中,加入 1%HCl-60%乙醇-水溶液 50 mL,在 40℃恒温水浴中提取 1 h后,用 0.1 moL/L的 NaOH溶液调节pH=0.98,用 pH=0.98的 HCl-NaCl-60%乙醇溶液定容到 100 mL,以 pH=0.98的 HCl-NaCl-60%乙醇溶液为空白对照,在波长 200~700内进行光谱扫描。
2.4.2 花色苷相对含量的测定
用示差法计算溶液中总花色苷含量[8],将试样分别用 pH值 1.0、pH值 4.5的缓冲液定容至 50 mL,测定 510nm下的吸光值,按下面公式计算花色苷的总含量:
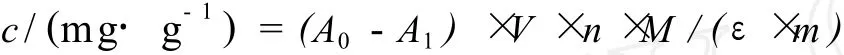
式中:A0,pH值 1.0时花色苷在 510 nm下的吸光度值;A1,pH值 4.5时花色苷在 510 nm下的吸光度值;V,提取液总体积 (mL);n,稀释倍数;M,cy-3-glu的相对分子质量 (449);ε,cy-3-glu的消光系数,其值为 29 600;m,样品干重 (g)。
2.4.3 花色苷保存率的测定
保存率 /% =(c处理后/c处理前) ×100
3 结果与分析
3.1 红菊芋色素最大吸收波长的确定
红菊芋色素提取液的光谱扫描结果如图1所示。由图1可知,该色素在紫外光区 254、281和 296 nm处分别有较强的吸收峰,为花色苷酰基结构的特征吸收峰,在可见光区的 533 nm处可见一个吸收峰,为典型的花青素光谱特性[3-4]。由此确定红菊芋色素可见光区最大吸收波长为 533 nm。
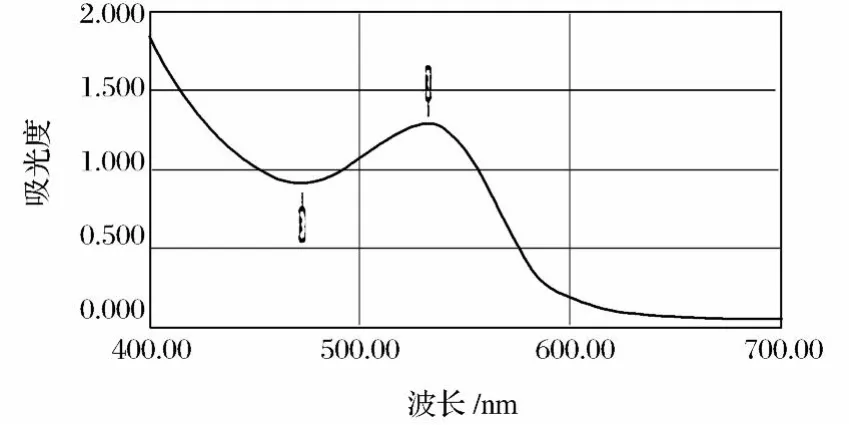
图1 红菊芋色素提取液的可见光谱扫描结果
3.2 提取工艺单因素试验结果
3.2.1 乙醇浓度对红菊芋色素提取效果的影响
以不同体积分数的乙醇-2%HCl-水溶液为提取剂,料液比 1∶30,微波功率 320 W下提取 30 s,所得结果如表2。
由表2可知,随着乙醇体积分数的增加,红菊芋色素粗提液的OD533值呈先增加后下降的趋势,乙醇浓度为 60%时达到最大。进一步的方差分析,F=654.272>F0.01(4,10)=5.99,多重比较结果表明,60%乙醇浓度对红菊芋色素的提取效果极显著的高于其他处理 (P<0.05)。因此,确定红菊芋色素提取剂的乙醇体积分数为 60%左右合适。
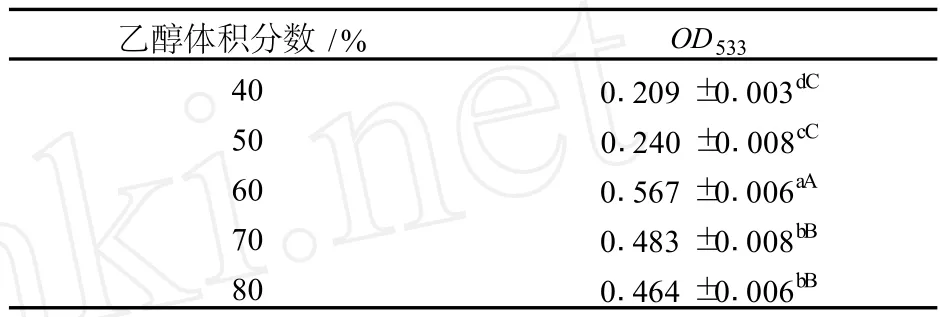
表2 乙醇浓度对红菊芋色素提取效果的影响
3.2.2 料液比对红菊芋色素提取效果的影响
以 2%HCl-60%乙醇-水溶液为提取剂,料液比分别为 1∶10、1∶20、1∶30、1∶40和 1∶50,微波功率 320W下提取 30 s,6 000 r/min离心 5 min,取上清,用提取剂定容,取样,λ=533 nm下测定OD值。结果见表3。

表3 料液比对红菊芋色素提取效果的影响
由表3可以看出,随着提取剂的增加,红菊芋色素粗提液的OD533值呈先增加后下降的趋势,料液比为 1∶30时达到最大。方差分析和多重比较结果表明 ,F=81.78 > F0.01(4,10)=5.99,料液比为 1∶30、1∶40和 1∶50对红菊芋色素提取效果影响差异不显著 ,三者均极显著的高于 1∶10和 1∶20(P<0.01),考虑到提取效果和提取剂的成本,确定红菊芋色素提合适的料液比为 1∶30左右。
3.2.3 微波功率对红菊芋色素提取效果的影响
以 2%HCl-60%乙醇-水溶液为提取剂,料液比 1∶30,分别在不同微波功率下提取 30 s,结果见表4。

表4 微波功率对红菊芋色素提取效果的影响
由表4可以看出,随着微波功率的增大,红菊芋色素粗提液的OD533值呈先增加后下降的趋势,功率为 480 W时达到最大。方差分析,F=73.59>F0.01(4,10)=5.99,多重比较结果表明,480W对红菊芋色素的提取效果极显著的高于其他处理(P<0.01)。这可能是由于随着微波功率的增大,分子震动加快,摩擦增加,产生的热效应增加,有利于色素的溶出,但是当功率过大时,其强热效应则可对色素产生破坏作用。
3.2.4 微波提取时间对红菊芋色素提取效果的影响
以 2%HCl-60%乙醇-水溶液为提取剂,料液比1∶30,于微波功率为 320 W下分别提取不同时间,结果见表5。
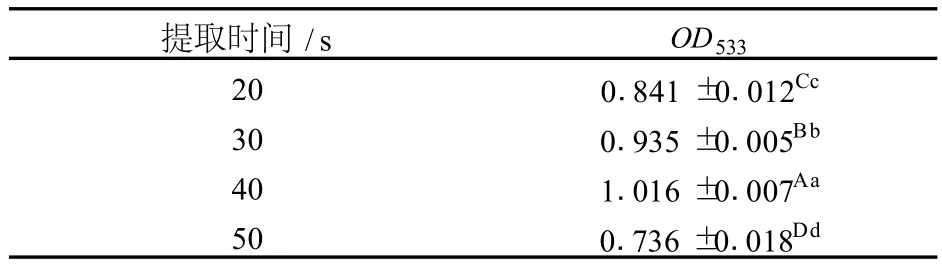
表5 不同微波提取时间对红菊芋色素提取效果的影响
由表5可以看出,当功率为 320 W时,随着提取时间的延长,红菊芋色素的提取效果呈先增加后下降的趋势,微波提取 40 s时达到最大。这是因为微波作用时间愈长热效应愈大,当时间过长时,所产生的热量过高,使部分花色苷发生分解[5-6]。方差分析,F=112.255>F0.01(4,10)=5.99,多重比较结果表明,微波提取 40 s的色素提取效果极显著的高于其他处理 (P<0.01)。因此,合适的微波辅助提取时间为 40 s左右。
3.3 正交试验结果
在单因素试验的基础上,对提取液乙醇浓度、料液比、微波功率、提取时间 4个因素进行正交试验,所得结果如表6和表7。
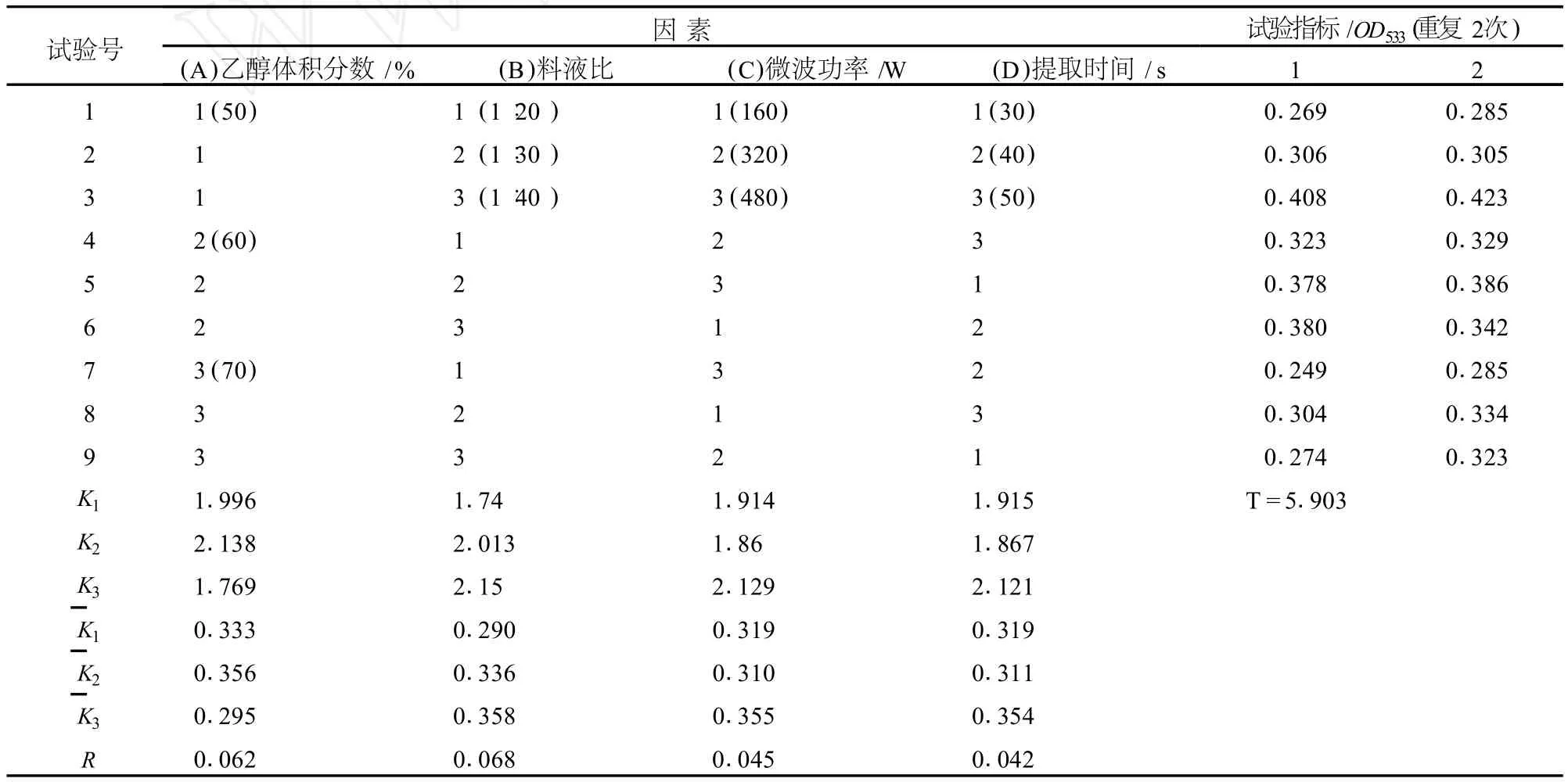
表6 正交试验结果 L9(34)
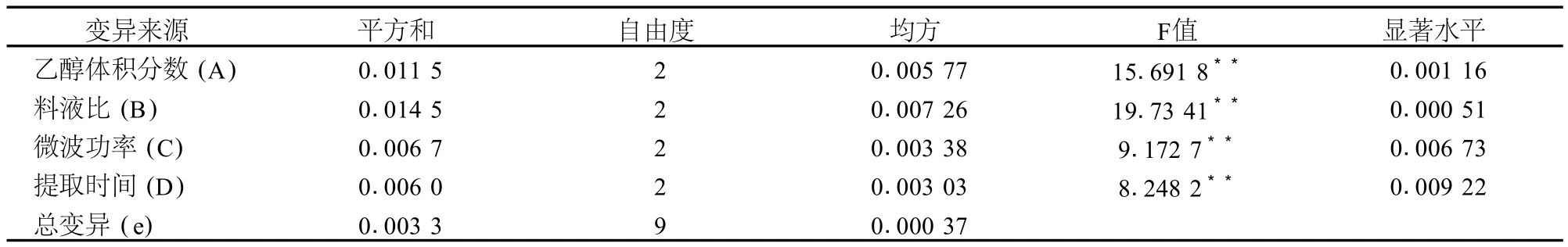
表7 正交试验方差分析表
由极差分析和方差分析结果可知,乙醇体积分数(A)、料液比 (B)、微波功率 (C)和提取时间 (D)4个因素对红菊芋色素提取效果影响极显著,各因素的主次顺序为 B>A>C>D;各因素多重比较结果表明,乙醇体积分数为 60%、料液比为 1∶40与 1∶30、微波功率 480 W、提取时间 50 s显著高于其他处理 (P<0.01)。因此,微波辅助法的最佳提取条件为:B2A2C3D3,即 2%HCl-60%乙醇 -水溶液 ,1∶30的料液比,微波功率 480 W,微波提取 50 s。由于该组合在正交试验中没有出现,因此需进行验证试验,其结果表明,采用该工艺条件提取菊芋红色素,提取液花色苷相对含量达 29.84 mg/g。
3.4 光热稳定性结果
3.4.1 光照对红菊芋色素稳定性的影响
将纯化的色素用 1%HCl水溶液稀释 3倍,分别取 50 mL于容量瓶中,置于自然光下,每隔 24 h取样,冷却后用示差法测定其花色苷含量,计算花色苷保存率,并观察色素颜色变化。结果如表8所示。

表8 红菊芋色素在自然光照下的保存率
由表8可知,随光照时间的延长,红菊芋色素溶液的保存率逐渐降低。放置 7 d后,色素的保存率仍可达到 75.96%,肉眼观察色素减退不明显。因此,红菊芋色素的光稳定性较好。
3.4.2 热对红菊芋色素稳定性的影响
将纯化的色素用 1%HCl水溶液稀释 3倍,分别取 50 mL于容量瓶中,置于水浴中处理 4h,取出冷却后用示差法测定其花色苷含量,计算花色苷保存率,观察色素颜色变化。结果如表9所示。

表9 红菊芋色素在不同热处理条件下的保存率
由表9可知,在 60℃加热 4h,保存率在 80%以上,随着温度的升高,花色苷发生降解,保存率随之下降,100℃处理 4 h,色素保存率下降至 50%,肉眼可见红色减退。有研究结果表明[8],花色苷对热不稳定,但粗提取物比纯提取物的热稳定性好。因此,可以推断红菊芋色素应用在食品中时其稳定性会加强,但需要进一步研究。
4 结论
(1)根据红菊芋色素可见光区光谱扫描结果得知,在可见光区的 533 nm米处有吸收峰,初步确定红菊芋色素为花色苷。
(2)单因素试验和正交试验结果表明乙醇体积分数、料液比、微波功率和微波时间对红菊芋色素的提取效果影响差异极显著,各因素影响的主次顺序为料液比 >乙醇浓度 >微波功率 >微波时间,适宜提取工艺:提取溶剂为 2%HCl-60%乙醇-水溶液,料液比1∶30,微波功率 480 W,微波提取时间 50 s。
(3)热和光照对红菊芋色素的稳定性影响较大,热处理对红菊芋色素破坏最为明显,光照时间越久,保存温度越高,红菊芋色素溶液稳定性越差。因此对工业生产的红菊芋色素,建议在低温、避光条件下密封保存。菊芋红色素色调自然,性质较稳定,是一种较为理想的天然色素资源。
[1] 徐渊金,杜琪珍 .花色苷分离鉴定方法及其生物活性[J].食品与发酵工业,2006,32(3):67-72.
[2] KongJM,ChiaL S,GohN K,et al.Analysis and biological activities of anthocyanins[J].Phytochemistry,2003,64(5):923-933.
[3] 孙建霞,张燕,胡小松,等 .花青素的提取、分离以及纯化方法研究进展[J].食品与发酵工业,2008,34(08):111-117.
[4] 于东,陈桂星,方忠祥,等 .花色苷提取、分离纯化及鉴定的研究进展[J].食品与发酵工业,2009,35(03):127-133.
[5] Sun Yangzhao,Liao Xiaojun,Wang Zhengfu,et al.Optimization ofmicrowave-assisted extraction of anthocyanins in red raspberries and identification of anthocyanin of extracts using high-perfor mance liquid chromatography-mass spectrometry[J].European Food Research and Technology,2007,225:511-523.
[6] 许正虹,高彦祥,石素兰,等 .微波辅助萃取紫甘薯色素的研究[J].食品科学,2005,26(9):234-238.
[7] 侯方丽,张名位,苏东晓,等 .黑米皮花色苷的大孔树脂吸附纯化研究 [J].华南师范大学学报:自然科学版,2009(1):100-104.
[8] 张燕,谢玫珍,廖小军 .热和紫外辐照对红莓花色苷稳定性的影响[J].食品与发酵工业,2005,31(3):37- 40.
