酵母破碎液对红曲霉红色素生产能力的影响*
2011-01-13梁志洲徐民俊胡海艳周世宁
梁志洲 ,徐民俊 、2,胡海艳 ,周世宁
红曲霉(M onascus)的应用在我国有着悠久的历史,它是生产红曲酒、红曲米、功能性红曲和天然色素的主要菌种[1]。红曲色素生产的传统工艺是利用红曲霉固态发酵,但此方法操作繁琐、周期长、耗粮多、产率低,不适应大规模工业化生产;近年发展起来的液态发酵培养法则具有工艺简单、生产周期短、节约粮食等优点,然而此法生产的红曲色素色价偏低,制约着其进一步工业化大生产[2]。因此,对液态发酵生产红曲色素的培养条件进行研究以提高色价,具有重要的现实意义。
在众多优化培养方法中,菌种联合培养效果显著。Shin等将红曲霉分别与酿酒酵母、米曲霉等菌种进行联合固态培养,发现红曲霉的细胞形态发生了改变,红曲霉细胞数量增加了 2倍,色素产量提高了 30~40倍[3]。朱振元等将酵母发酵液及酵母细胞破碎液分别加入到红曲霉液态发酵摇瓶中,使得亲水性色素和疏水性色素产量都得到很大提高[4]。由此可见,酵母与红曲霉的共培养不失为色素增产的一条有效途径。本文通过优化酵母破碎液的加入时间和加入量以获得更高的色素产率。
1 材料与方法
1.1 材料
1.1.1 菌种
紫色红曲霉 (M onascus purpureous),色素高产菌株,经遗传改造,实验室保藏
啤酒酵母 (Saccharom yces cerevisiae),由广州珠江啤酒股份有限公司提供。
1.1.2 培养基
(1)产孢斜面[5]:10%蔗糖,0.3%酵母抽提物,0.5%酪蛋白氨基酸,0.2%NaNO3,0.1%KH2PO4,0.05%MgSO4·7H2O,0.05%KCl,0.001%FeSO4,1.5%琼脂。
(2)YPD液体培养基:20%葡萄糖,10%酵母抽提物,20%胰蛋白胨。
(3)YPD斜面:YPD液体培养基中加入 1.5%琼脂。
(4)液体发酵培养基:7%米粉,3%豆粉,0.25%NaNO3,0.25%KH2PO4,0.25%MgSO4·7H2O,乳酸调节至 pH3.5。
1.1.3 试剂与仪器
无水乙醇,广州化学试剂厂,配制成 70%乙醇使用。
S W-CJ-1F超净工作台,苏州安泰空气技术有限公司;HZQ-F160全温振荡培养箱,中国哈尔滨东联电子技术开发有限公司;XW-80A涡旋混合器(25W),上海医科大学仪器厂;DK-8D型电热恒温水槽,上海精宏实验设备有限公司;Centrifuge MR23i,Thermo;紫外分光光度计 UV-2000,Unico。
1.2 试验方法
1.2.1 红曲霉菌株孢子悬液的制备
将红曲霉菌株接种到产孢斜面培养基上,30℃培养 4~7 d,待孢子成熟后,加入适量无菌水,用小铲子轻刮斜面,将红曲霉气生菌丝体全部剥下并转移至装有搅拌子的小三角瓶内。置于磁力搅拌器上振荡,将孢子充分打散后,6层擦镜纸过滤,离心弃上清液,用无菌水洗涤 2次,调整浓度至 1×106个 /mL。上述步骤均需无菌操作。
1.2.2 啤酒酵母的液态培养
YPD斜面活化啤酒酵母,用 2 mL无菌水冲洗斜面,按 1%的接种量接种于 YPD液体培养基中,30℃,150 r/min条件下培养 24 h,测得OD600值。
1.2.3 酵母破碎液的制备
取上述酵母发酵液 50 mL,6 000 r/min离心 10 min,收集菌体,重悬于 15 mL,pH为 7.4,浓度为 0.1 mol/L的磷酸钠缓冲液中,同时加入等体积的直径为 0.5 mm的玻璃珠,涡旋振荡器上振荡 15 min(间隔冰浴),使酵母细胞充分破裂。破碎后 12 000 r/min,4℃离心 10 min,取上清液备用。
1.2.4 酵母破碎液作用下的红曲霉液态发酵培养
在 500 mL三角瓶中装入液体发酵培养基 150 mL,接入上述红曲霉孢子悬液 1 mL,30℃,160 r/min条件下培养,间隔相同时间加入相同量的酵母破碎液,探讨加入时间对色素生产的影响。选定最佳时间后在此时间点加入不同量的酵母破碎液,进一步探讨加入量对色素生产的影响。对照组不加酵母破碎液。
1.2.5 水溶性色价的测定[6]
发酵液经定性滤纸过滤后,取滤液于 10 000 r/min离心 1 min,上清液用适量水稀释,摇匀,以水做空白对照,用分光光度计分别测定 510 nm和 410 nm的OD值。
水溶性红色素色价 (U/mL)=OD510×稀释倍数
1.2.6 醇溶性色价的测定
参考 GB15961-2005中色价测定方法。发酵液过滤后的菌丝体经 60℃烘干至恒重,称取 0.025 g菌体,于 70%乙醇中加石英砂充分研磨,以 70%乙醇定容至 10 mL,60℃浸提 30 min,期间每间隔 10 min摇匀 1次。取 2 mL该浸提液,10 000 r/min离心 1 min去除石英砂及菌渣,上清液稀释 10倍后,以 70%乙醇为空白,测定 510 nm和 410 nm的OD值。
醇溶性红色素色价 (U/g)计算:
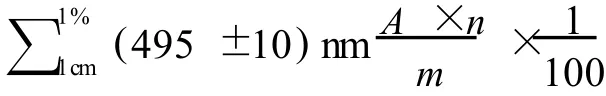
1.2.7 色调测定
色调=OD510/OD410
1.2.8 生物量的测定
发酵周期结束后,发酵液经定性滤纸过滤,取菌丝体,60℃烘干至恒重,称重得生物量。
2 结果与讨论
2.1 酵母破碎液对红曲霉红色素产量的影响
将酵母破碎液加入红曲霉液态发酵摇瓶中,培养1 W后开始取样测量,追踪色素生产在酵母破壁液的影响下随时间的变化情况。对照组不添加酵母破碎液。结果见图1。
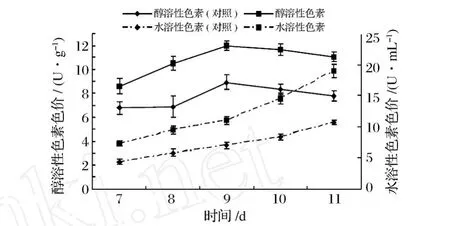
图1 红曲霉红色素生产的发酵历程曲线
由图1可以看出,添加酵母破碎液并不改变红曲霉色素生产曲线的基本模式,与对照组的趋势一致,色素随发酵时间的延长产量有所增加,其中醇溶性色素在第 9天达到最大值,水溶性色素产量则继续上升。红曲霉液态发酵产生的红曲色素,约 70%~80%存在于菌体内,20%~30%分泌到发酵液中,其比例会随着培养基的组成、培养时间等有较大的变化[7]。因为胞内的醇溶性色素能与蛋白质、氨基酸、氨基糖等物质的氨基发生反应,形成水溶性色素,分泌于胞外[8]。但是 2种性质的色素,具有应用价值的主要是醇溶性色素,因此下述实验选取醇溶性色素产量最高的第 9天作为测量点。
2.2 酵母破碎液加入时间对红曲霉红色素产量的影响
每隔 12h分别向一系列已接种红曲霉并开始培养的液态发酵摇瓶中的一瓶加入 1.5 mL酵母破碎液,直至第 60 h。不加酵母破碎液为对照,全部摇瓶培养至第 9天,测OD510和OD410,进行色素分析。
图2显示,在红曲霉培养了 24 h后加入酵母破碎液,醇溶性色素和水溶性色素产量都有很大的提高,且均以第 48h时加入增幅最大,增幅分别达120%和 190%。研究者[3,9]认为,酿酒酵母产生的几丁质酶是一种提高红曲色素产量的刺激因子,能作用于作为真菌细胞壁多糖中的主要成分几丁质,增加细胞壁的透性,解除细胞内的产物抑制,从而提高色素产量;此外,有研究者推测,当红曲霉的细胞壁受到水解酶类的降解时,为了进行自我防护,会大量产生疏水类物质比如色素来抵制酶类的作用。
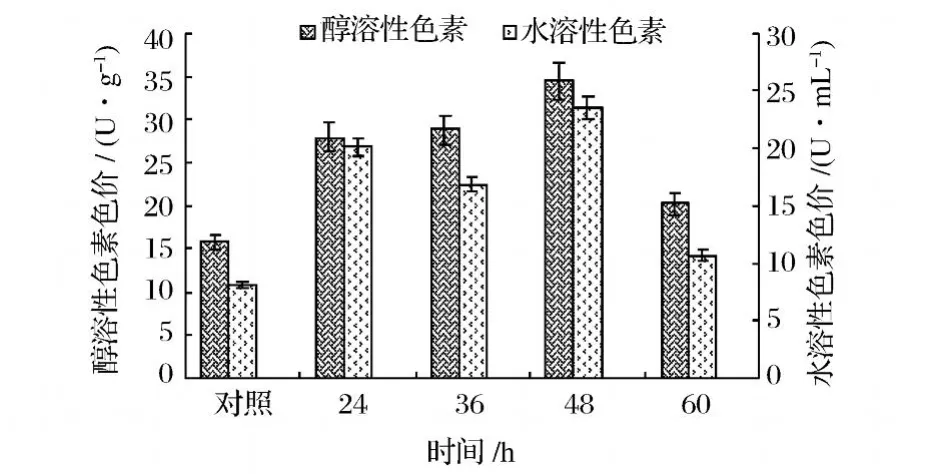
图2 不同时间加入酵母破碎液对红曲霉红色素产量的影响
不同时间加入酵母破碎液对红曲霉生长及色素的生产有着较大差异。红曲霉液态发酵过程中,0~48 h为快速生长期,在 0 h和 12 h加入酵母破碎液,受到水解酶类的作用,生长受到很大影响,菌丝体很少,色素产量很低 (数据未显示)。从图2还可以看出,24、36和 60h加入酵母破碎液后的色素产量均不及 48 h加入的高。而 60 h加入酵母破碎液时效果有所降低,推测是由于菌体生长繁殖阶段已接近结束,破碎液对细胞壁的影响较小;亦可能是伴随发酵的进行,摇瓶内的环境条件发生改变,酶类不能很好地发挥作用。
2.3 酵母破碎液加入量对红曲霉红色素产量的影响
液态发酵摇瓶接种培养 48 h,分别往摇瓶中加入 1.5 mL、3 mL、4.5 mL、6 mL酵母破碎液 ,不加酵母破碎液为对照,培养至第 9天,测OD510和OD410,测定红色素产量
实验结果表明,在 48 h加入酵母破碎液,醇溶性色素和水溶性色素产量提高明显,虽然不同体积破碎液的加入对色素产生的影响不是很明显 (可能是同一数量级体积内的破壁液里影响因子含量差别不是很大),但是从图3中看出,随着加入体积的增大,增幅有下降的趋势。推测红曲霉应对外界刺激可能会有一个临界范围,超出这个范围,菌体的正常生长就会受到影响,进而色素的生成也会受到影响。超出越多,影响越大,甚至可能会抑制生长。
2.4 酵母破碎液对红曲色素色调的影响
红曲色素是多种色素成分的混合物,主要含有红和黄两种色素成分,分别在 510 nm和 410 nm有最大吸收峰。红色素与黄色素的比值即为色调。红曲色素的色调是评价色素质量的一个重要指标,红多于黄(>1),视觉感官就感到红曲色素颜色深红,反之,若黄多于红 (<1),红曲色素则呈现橙红或橙黄色。

图3 不同体积酵母破碎液对红曲霉红色素产量的影响
表1和表2显示,在酵母破碎液的影响下,胞内的醇溶性色素色调有所减小,但减小程度不明显,而胞外的水溶性色素色调则明显增大,幅度达 10%。酵母破碎液在促进红色素增产的同时,对黄色素的生产也有促进作用。计算各时间及体积OD值相对于对照OD值的增幅,醇溶性色素中,红色素增幅比相对应的黄色素增幅略小;反之,水溶性色素中红色素增幅比黄色素增幅大,因此导致醇溶性色素色调略微减小,水溶性色素色调增大。此外,由于水溶性色素是由醇溶性色素转化而来的,胞内的醇溶性色素向胞外转化为水溶性色素,红色素若比黄色素转化效率高,也能对两种性质色素色调的变化产生影响。

表1 不同时间加入酵母破碎液对红曲色素色调的影响
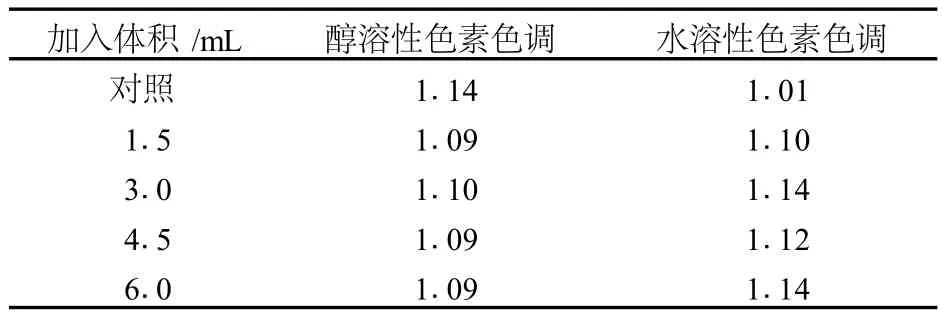
表2 不同体积酵母破碎液对红曲色素色调的影响
2.5 酵母破碎液对红曲霉菌体生长的影响
发酵结束后,取 20 mL发酵液过滤获取菌丝体,60℃烘干至恒重后,称重得生物量,比较酵母破碎液在不同时间加入及加入不同体积对红曲霉生物量的影响,结果如表3所示。

表3 不同时间加入酵母破碎液对红曲霉菌体生长的影响
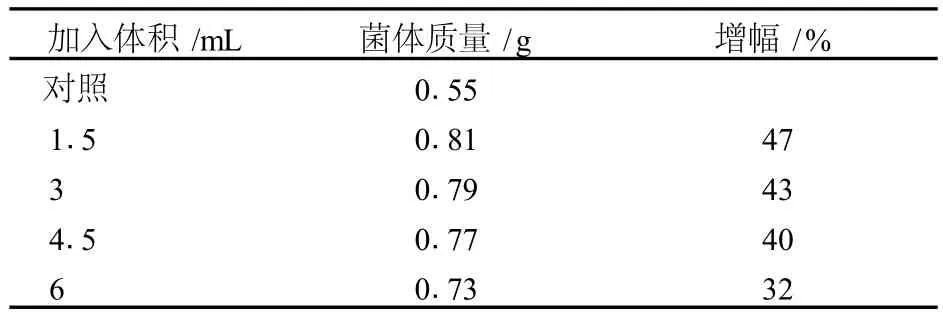
表4 不同体积酵母破碎液对红曲霉菌体生长的影响
从表3中可以看出,发酵液中菌体的含量随着加入酵母破碎液时间的后延而有所增加,且在 48 h浓度达到最高,此外在加入体积增大的情况下,菌体量则在缓慢减少,均与色素产量受破碎液的影响情况一致。研究表明,酿酒酵母产生的水解酶类作用于红曲霉细胞壁时,会影响其细胞形态,从而刺激其生长,提高了菌体量,同时也提高了色素产量[9]。
3 结论
本研究通过探讨啤酒酵母破碎液加入时间与体积对色素产量的影响,得出 500 mL的三角瓶装液150 mL情况下接种红曲霉培养 48 h时加入 1.5 mL酵母破碎液效果较佳。发酵结束后,菌体生长量相比于对照提高了 47%,相应地,测得胞内胞外色素也比对照有明显的提高,分别增加了 120%和 190%。
此外,本研究还探讨了添加酵母破碎液对色素色调所产生的影响,发现添加酵母破碎液在促进红色素增产的同时对黄色素的生产也有促进作用,从而导致色调的变化。在酵母破碎液的影响下,醇溶性色素色调有略微减小,水溶性色素色调有所增大。
添加酵母破碎液是提高色素产量的一条有效途径,如在规模化生产中应用将可能产生可观的效益。
[1] 傅金泉.中国红曲及其实用技术[M].北京:中国轻工业出版社,1997:3-21.
[2] 衣珊珊,沈昌,韩永斌,等.红曲色素形成机理及提高其色价的途径[J].食品科学,2005,26(7):256-261.
[3] Shin C S,Kim H J,KimM J,et al.Morphological change and enhanced pigment production ofM onascuswhen cocultured withSaccharom yces cerevisiaeorAspergillus oryzae[J].Biotechnology and Bioengineering,1998,59:576-581.
[4] 朱振元,满金浩,刘安军,等.酵母细胞影响红曲霉次生代谢产物的研究[J].现代食品科技,2009,25(2):136-140.
[5] Hiroi T,Shima T,Suzuki T,et al.Hyperpigment-productive mutant ofM onascusanka for solid culture[J].AgrBiol Chem,43:1 975-1 976.
[6] 郭红珍,王秋芬,马立芝.液态发酵产红曲色素的研究[J].食品工业科技,2009,29(3):154-156.
[7] 童群义,欧仕益,高孔荣.液态深层发酵生产红曲色素的最佳培养条件[J].湖南农业大学学报:自然科学版,1998,24(3):226-230.
[8] Lin T F,Demain A L.Leucine interference in the production of water-soluble redM onascuspigment[J].Arch Microbiol,1994,162:114-119.
[9] Suh J H,Shin C S.Analysis of the morphololgic changes ofM onascussp.J101 cells cocultured withSaccharom yces cerevisiae[J].FEMSMicrob Letters,2000,190:143-147.
