新生大鼠缺氧/缺血性脑损伤时皮层神经元HIF-1α的表达与凋亡相关基因P53、Bcl-2的关系
2011-01-06王娟张玉真蒋犁
王娟,张玉真,蒋犁
(东南大学医学院,江苏南京 210009)
缺氧/缺血性脑损伤(hypoxia-ischemia brain damage,HIBD)是指各种围生期窒息引起的部分或完全缺氧、脑血流减少或暂停而导致的胎儿或新生儿脑损伤,是新生儿时期最常见且严重的神经系统损伤[1],至今仍无有效的治疗方法。HIBD过程中神经元损伤主要表现为坏死和凋亡,凋亡引起的损伤更严重[2]。缺氧诱导因子-1α(hypoxia induced factor-1α,HIF-1α)是一种在缺氧应答过程中起重要作用的核转录因子。目前的研究结果显示,HIF-1α广泛参与各种细胞的凋亡过程[3],但在新生大鼠脑组织中其与神经元凋亡的关系国内研究很少。研究表明,细胞凋亡过程受多种基因调控,P53和 Bcl-2被认为是凋亡的标志性基因[4-5]。因此,我们以新生7日龄SD大鼠HIBD模型为研究对象,观察HIBD伤后皮层HIF-1α的表达情况及其与P53和Bcl-2的关系,并与单纯缺氧组及假手术组比较,探讨新生大鼠脑HIBD时HIF-1α与神经元凋亡的关系。
1 材料和方法
1. 1 动物分组和模型建立
1.1.1 动物分组 新生7日龄SD大鼠,雌雄不限,体重11~16 g,由东南大学医学院实验动物中心提供。动物随机分为假手术组(n=6)、单纯缺氧组(n=30)和缺氧/缺血组(n=30)。单纯缺氧组和缺氧/缺血组按缺氧和缺氧/缺血后断头时间不同又分为3、6、12、24、72 h 5个亚组,每个亚组动物数相同(n=6)。
1.1.2 动物模型的建立 按照经典Rice方法[6]建立HIBD动物模型。SD大鼠经乙醚麻醉后取仰卧位固定,颈正中切口,假手术组仅分离右侧颈总动脉,不作任何处理;单纯缺氧组分离右侧颈总动脉,不结扎,仅作缺氧处理,方法同缺氧/缺血组;缺氧/缺血组分离并结扎右侧颈总动脉,缝合皮肤,术后回笼恢复2 h,然后放入缺氧容器中,充以湿化的92%氮气-8%氧气混合气体(1 L·min-1)2 h,回到常氧环境中恢复饲养。
1.1.3 标本采集 大鼠经10%水合氯醛(350 mg·kg-1)麻醉后,心脏灌注40 g·L-1多聚甲醛内固定,开颅将脑组织完整取出,放入40 g·L-1多聚甲醛固定3~7 d,选取视交叉到视丘的脑组织,厚约5 mm,经脱水透明包被后石蜡包埋切片,切片厚约6 μm,备用。
1. 2 HE 染色
石蜡组织切片经二甲苯及梯度酒精脱蜡水化处理后,HE染色10 min,自来水冲洗约10 min洗去多余的液体,盐酸酒精分化,镜下观察控制分化程度,自来水冲洗返蓝,放入95%乙醇数秒,伊红染色液染色2 min。脱水、透明、中性树胶封片,显微镜下观察,细胞核呈蓝色,而细胞浆呈粉红色。
1. 3 HIF-1α、P53 和 Bcl-2 蛋白表达检测
将切片脱蜡,梯度酒精水化,3%双氧水封闭内源性过氧化物酶,PBS冲洗3次,微波抗原修复后加山羊血清封闭20 min,弃去多余液体,分别加入抗HIF-1α大鼠多克隆抗体(1∶50)、P53鼠多克隆抗体(1∶100)、Bcl-2鼠多克隆抗体(1∶100),4℃过夜。充分洗涤后,加生物素标记的抗大鼠IgG抗体(1∶100)孵育30 min,PBS洗涤3次,滴加辣根过氧化物酶标记的链霉素卵白素工作液37℃孵育1 h,充分洗涤,DAB显色,显微镜下控制反应颜色,自来水冲洗,终止显色,苏木素复染,盐酸酒精分化,氨水返蓝,二甲苯透明,中性树胶封片,显微镜下观察,阳性细胞显色为棕黄色。空白对照组不加抗HIF-1α大鼠多克隆抗体、P53鼠多克隆抗体、Bcl-2鼠多克隆抗体,其余步骤同前,均无阳性细胞表达。显微镜下观察HF-1α、P53和Bcl-2表达情况,取右侧大脑皮层3个视野,放大400倍,计算100个神经元中阳性染色的细胞数。
1. 4 统计学处理
2 结 果
2. 1 HE 染色结果
单纯缺氧组和缺氧/缺血组均可见不同程度的细胞胞体肿胀,气体样变,细胞稀疏,间隙增宽,细胞排列紊乱,结构不清,核固缩变圆,主要表现见于皮层和海马区,证实模型建立成功。单纯缺氧组细胞损伤程度较缺氧/缺血组轻,缺氧或缺氧/缺血损伤后24 h皮层神经元损伤最重,细胞溶解缺失明显。假手术组皮层神经元排列有序,细胞核大,胞浆少,见图1。
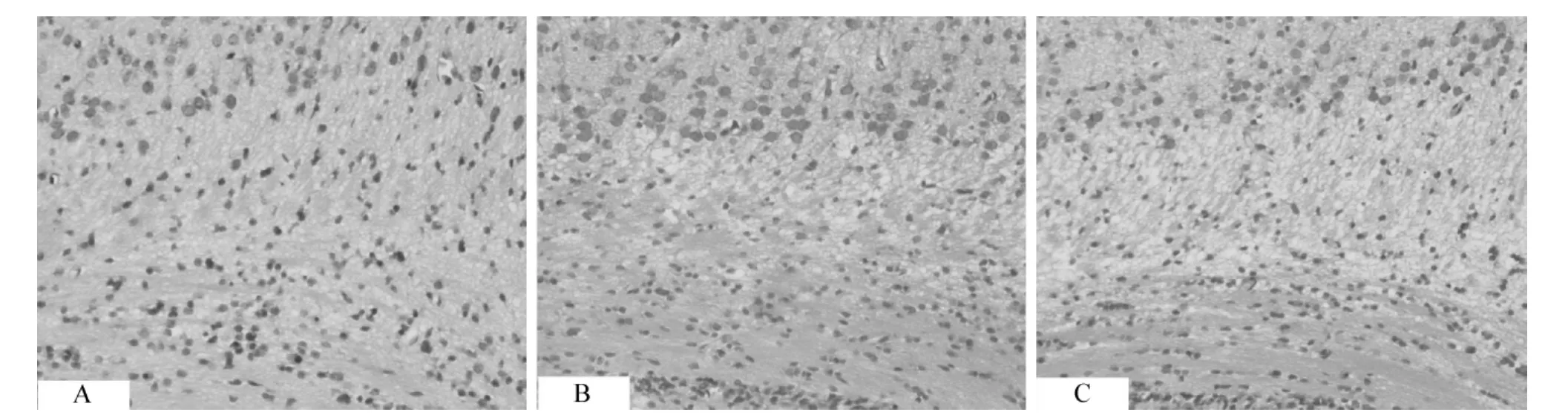
图1 缺氧后24 h各组皮层区HE染色 10×40A.sham group;B.hypoxia group;C.hypoxia ischemia groupFig 1 HE staining of cortex in brain tissues at 24 h after hypoxia in each group 10×40
2. 2 HIF-1α的表达和分布
假手术组脑组织HIF-1α蛋白仅有少量表达。单纯缺氧组和缺氧/缺血组皮层区HIF-1α在单纯缺氧或缺氧/缺血后表达增多(P<0.05),主要分布于皮层、海马等部位;单纯缺氧和缺氧/缺血后3 h HIF-1α开始出现表达,12 h达高峰,24 h后降低,72 h仍可见其少量表达。在同一时间点上,单纯缺氧组皮层区HIF-1α表达较缺氧/缺血组高,但差异无统计学意义。见表1、图2。
2. 3 P53和Bcl-2蛋白表达与分布
单纯缺氧组和缺氧/缺血组P53和Bcl-2主要分布于皮层和海马区。单纯缺氧组和缺氧/缺血组皮层区P53蛋白在单纯缺氧和缺氧/缺血后3 h表达增多,12 h表达明显,24 h表达达高峰,72 h表达仍较明显。高倍镜下P53蛋白表达强的细胞受损较重,形态变化明显。单纯缺氧组24 h时皮层区P53蛋白表达较缺氧/缺血组减少,差异有统计学意义(P<0.05)。见表1、图3。
表1 大鼠单纯缺氧和缺氧/缺血后不同时间点皮层区HIF-1α、P53及Bcl-2阳性细胞表达情况Tab 1 Comparison of positive cell of HIF-1α、P53 and Bcl-2 in cortex after hypoxia or hypoxia ischemia in neonatal rats
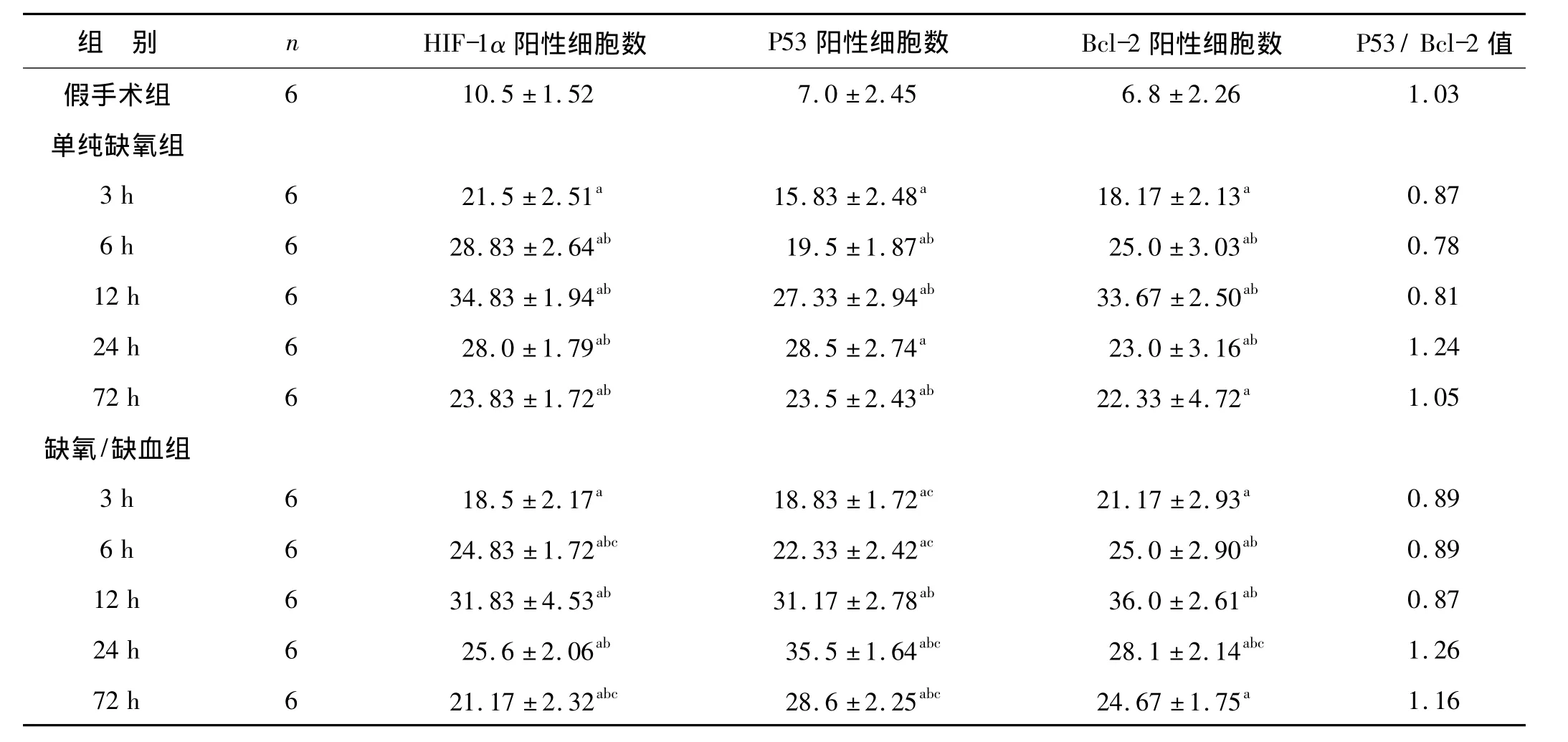
表1 大鼠单纯缺氧和缺氧/缺血后不同时间点皮层区HIF-1α、P53及Bcl-2阳性细胞表达情况Tab 1 Comparison of positive cell of HIF-1α、P53 and Bcl-2 in cortex after hypoxia or hypoxia ischemia in neonatal rats
与假手术相比较,a P<0.05;与同组内前一时间点比较,b P<0.05;与单纯缺氧组同一时间点比较,c P<0.05
组 别 n HIF-1α阳性细胞数 P53阳性细胞数 Bcl-2阳性细胞数 P53/Bcl-2值10.5 ±1.52 7.0 ±2.45 6.8 ±2.26 1.03单纯缺氧组3 h 6 21.5 ±2.51a 15.83 ±2.48a 18.17 ±2.13a 0.87 6 h 6 28.83 ±2.64ab 19.5 ±1.87ab 25.0 ±3.03ab 0.78 12 h 6 34.83 ±1.94ab 27.33 ±2.94ab 33.67 ±2.50ab 0.81 24 h 6 28.0 ±1.79ab 28.5 ±2.74a 23.0 ±3.16ab 1.24 72 h 6 23.83 ±1.72ab 23.5 ±2.43ab 22.33 ±4.72a 1.05缺氧/缺血组3 h 6 18.5 ±2.17a 18.83 ±1.72ac 21.17 ±2.93a 0.89 6 h 6 24.83 ±1.72abc 22.33 ±2.42ac 25.0 ±2.90ab 0.89 12 h 6 31.83 ±4.53ab 31.17 ±2.78ab 36.0 ±2.61ab 0.87 24 h 6 25.6 ±2.06ab 35.5 ±1.64abc 28.1 ±2.14abc 1.26 72 h 6 21.17 ±2.32abc 28.6 ±2.25abc 24.67 ±1.75a假手术组6 1.16

图2 缺氧后12 h各组皮层区HIF-1α的表达 10×40A.sham group;B.hypoxia group;C.hypoxia ischemia groupFig 2 Expression of HIF-1α at 12 h after hypoxia in cortex in each group 10×40

图3 缺氧后24 h各组皮层区P53的表达 10×40A.sham group;B.hypoxia group;C.hypoxia ischemia groupFig 3 Expression of P53 at 24 h after hypoxia in cortex in each group 10×40
假手术组脑组织Bcl-2蛋白阳性表达低,单纯缺氧组和缺氧/缺血组皮层区Bcl-2蛋白在单纯缺氧或缺氧/缺血后3 h表达增多,12 h达高峰,24 h后逐渐下降,72 h仍有少量表达。高倍镜下Bcl-2显色深的细胞形态较为正常,细胞核完整。单纯缺氧组12 h时皮层区Bcl-2蛋白表达较缺氧/缺血组减少,但差异无统计学意义(P >0.05)。见表1、图4。

图4 缺氧后12 h各组皮层区Bcl-2的表达 10×40A.sham group;B.hypoxia group;C.hypoxia ischemia groupFig 4 Expression of Bcl-2 at 12 h after hypoxia in cortex in each group 10×40
2. 4 HIF-1α与P53、Bcl-2表达的相关性分析
HIF-1α阳性细胞数与P53阳性细胞数表达呈正相关(单纯缺氧组 r=0.589,P <0.01;缺氧/缺血组r=0.531,P <0.01);HIF-1α 阳性细胞数与 Bcl-2 阳性细胞表达呈正相关(单纯缺氧组r=725,P<0.01;缺氧/缺血组 r=0.811,P <0.01)。假手术组 P53/Bcl-2值约等于1,单纯缺氧组和缺氧/缺血组3、6和12 h这3个时间点上P53/Bcl-2值小于1,单纯缺氧组和缺氧/缺血组24 h和72 h这两个时间点上P53/Bcl-2值大于1。
3 讨 论
在生理和病理状态下,细胞或机体对缺氧的适应能力对其存活十分重要。目前研究已证实:当组织或细胞缺氧时会发生不同程度的细胞凋亡。HIF-1是一种在维持氧平衡中起重要作用的转录调节因子[7],由α和β亚单位组成,其中α是活性单位,β是结构单位。在常氧下HIF-1α是一种极不稳定的蛋白,主要由细胞内的泛素蛋白酶将其降解,其半衰期不超过5 min。当低氧时,泛素蛋白酶的活性受抑制,HIF-1α稳定性增加,与HIF-1 β形成异二聚体,结合到核DNA序列,引起多种靶基因的转录激活,如促红细胞生成素、糖酵解酶、血管内皮生长因子等[8]。
本研究结果显示,HIF-1α表达主要分布于皮层和海马等部位,在单纯缺氧和HIBD中其表达具有时间规律性,即在单纯缺氧或缺氧/缺血3 h后皮层区HIF-1α出现表达增加,12 h达高峰,以后其表达量呈下降趋势。我们推测,单纯缺氧或缺氧/缺血使HIF-1α稳定性增加,其表达也随之增加,但随着复氧时间的延长,缺氧程度减轻,泛素蛋白酶活性增强,加速HIF-1α降解,使其表达减少,因而表现为先升后降的趋势。在正常组织中,促凋亡与抗凋亡维持在一定的动态平衡中。我们的实验结果显示,假手术组大鼠脑组织P53/Bcl-2值约等于1,也就是说在正常脑组织中P53和Bcl-2维持着平衡,而当细胞受到凋亡等信号刺激,此平衡被打乱,相应的促凋亡基因表达增多,抗凋亡基因表达相对减少,反之亦然[3]。单纯缺氧组或缺氧/缺血组在3、6、12 h这3个时间点上P53/Bcl-2值小于1,单纯缺氧组或缺氧/缺血组在24 h和72 h这两个时间点上P53/Bcl-2值大于1,也就是说在3、6和12 h这3个时间点上细胞主要以抗凋亡为主,24 h和72 h这两个时间点上主要以促凋亡为主。我们认为,这可能与HIF-1α表达下降导致Bcl-2表达减少有关。因此,我们推测,在新生大鼠脑HIBD中,HIF-1α在缺氧损伤早期可能具有抗凋亡作用,与Fan等[9-10]关于HIF-1α在新生大鼠HIBD的研究结果是一致的,提示在HIBD早期自我保护机制启动,这给临床医师快速干预提供了时间窗。但本实验仅从HIF-1α与P53和Bcl-2的表达上进行分析,尚未涉及对HIF-1α的干预研究,对此,仍需进行进一步的实验研究。
[1]FERRIERO D M.Neonatal brain injury[J].N Engl J Med,2004,351(19):1985-1995.
[2]HAGBERG H,MALLARD C,ROUSSET CI,et al.Apoptotic mechanisms in the immature brain:involvement of mitochondria[J].J Child Neurol,2009,24(9):1141-1146.
[3]杨月霞,黄文新.HIF-1在缺血缺氧性疾病中的研究进展[J].山西医药,2010,50(20):111-114.
[4]XU F L,ZHU C L,WANG X Y,et al.Expression of p53 in neonatal mice following hypoxia-ischemia and effects of its inhibitor on neonatal brain injury[J].Zhongguo Dang Dai Er Ke Za Zhi,2006,8(2):137-140.
[5]ZHUO P H,XIONG Y,QIN L,et al.Expression of bcl-2 protein and apoptosis of neurocytes in neonatal rats with brain white matter damage[J].Zhongguo Dang Dai Er Ke Za Zhi,2007,9(2):164-168.
[6]RICE J E 3rd,VANNUCCI R C,BRIERLEY J B.The influence of immaturity on hypoxic-ischemic brain damage in the rats[J].Ann Neurol,1981,9(2):131-141.
[7]赵小祺,王春光,王小荣,等.缺氧诱发细胞凋亡的机制[J].中国老年学杂志,2010,7(30):1012-1014.
[8]MU D,JIANG X,SHELDON R A,et al.Regulation of hypoxia-inducible factor 1alpha and induction of vascular endothelial growth factor in a rat neonatal stroke model[J].Neurobiol Dis,2003,14(3):524-534.
[9]FAN X,HEIJNEN C J,van DERKOOIJ M A,et al.The role and regulation of hypoxia-inducible factor-1alpha expression in brain development and neonatal hypoxia-ischemia brain injury[J].Brain Res Rev,2009,62(1):99-108.
[10] SHELDON R A,OSREDKAR D,LEE C L,et al.HIF-1alpha-deficient mice have increased brain injury after neonatal hypoxia-ischemia[J].Dev Neurosci,2009,31(5):452-458.
