铜绿假单胞菌注射液与5-Fu腹腔化疗对大鼠结肠吻合口愈合影响的对比研究
2011-01-06高成生董哲李海玲祁永利郑鹏飞
高成生,董哲,李海玲,祁永利,郑鹏飞
(1.辽宁医学院附属第一医院普外科,辽宁 锦州 121001;2.莱芜市羊里医院普外科,山东 莱芜 271100)
腹腔化疗(intraperitoneal chemotherapy,IPC)属于高选择性的区域化疗,虽然能在一定程度上可防止肿瘤的复发和转移,但在临床应用中常出现并发症,尤其是影响术后肠吻合口的愈合,严重时可导致吻合口漏。铜绿假单胞菌(PA)注射液是一种由生物工程技术制备的新型菌类制剂,属于非特异性免疫激活物,主要用于恶性肿瘤的辅助治疗。十余年的临床应用证明,PA注射液不但能防止肿瘤的术后复发和转移,还能激活机体的体液免疫和细胞免疫,诱导跨菌属抗体的产生,有效地预防术后感染的发生。相对于传统的腹腔化疗药物,PA注射液特有的免疫调节和直接杀伤作用使其有望成为肠道肿瘤术后理想的辅助用药。本研究以大鼠结肠吻合模型作为研究对象,比较围手术期使用PA注射液与5-Fu术中腹腔化疗对大鼠结肠吻合口愈合的影响,为PA注射液进一步的临床应用以及肠道肿瘤术后辅助用药的选择提供实验依据。
1 材料与方法
1. 1 实验动物及分组
健康SD大鼠40只,体重230~270 g,雌雄不限,由辽宁医学院动物实验中心提供。随机分为4组:模型对照组、PA注射液皮下注射组(PA皮下注射组)、PA注射液皮下注射+术中腹腔喷洒组(皮下注射+腹腔喷洒组)、5-Fu腹腔化疗组(5-Fu组),每组10只。PA皮下注射组和PA皮下注射+腹腔喷洒组大鼠于术前3 d开始皮下注射PA注射液(北京万特尔生物制药有限公司生产),每次0.5 ml,隔日1次,至术后7 d;PA皮下注射+腹腔喷洒组同时术中腹腔喷洒PA注射液0.5 ml;5-Fu组术中腹腔应用5-Fu(20 mg·kg-1)。
1. 2 大鼠结肠吻合模型
术前大鼠禁食12 h,以10%水合氯醛(3 mg·kg-1)腹腔麻醉,于剑突下1 cm处取腹正中切口,长约3 cm。逐层切开入腹腔,距盲肠端3 cm处切除1 cm结肠,6-0无损伤线间断内翻缝合8~10针,1号丝线分层缝合腹部切口,术后12 h后自由进食饮水。
1. 3 观察指标及方法
1.3.1 腹腔粘连情况 术后7 d颈部脱臼处死各组大鼠,分别观察腹部粘连情况。
1.3.2 吻合口破裂压(ABP) 距吻合口近、远端各3 cm切断肠袢,置于恒温台氏液中,肠袢一端与微量输液泵连接,另一端与压力换能器连接。用输液泵向肠管内注入亚甲蓝溶液(3 ml·min-1),将观察到有亚甲蓝溢出或压力突然下降时的数值记为破裂压。
1.3.3 吻合口组织HE染色、Masson染色及电镜观察 取吻合口处肠袢,置于10%中性甲醛液内固定,常规石蜡包埋,切片层厚4 μm,行HE染色,光镜下观察吻合口上皮移行情况及吻合口瘢痕中巨噬细胞和成纤维细胞等炎性细胞的分布状况。常规Masson染色,观察吻合口组织中胶原纤维的分布情况,胶原纤维被苯胺蓝染成蓝色,肌纤维被酸性品红染成红色。吻合口组织用3%戊二醛固定液预固定,1%锇酸固定液复固定,丙酮系列脱水,环氧树脂EP0N812包埋,半薄切片,光镜定位,Relehert超薄切片机切片,醋酸双氧铀及柠檬酸铅双重染色,JEM-120透射电镜观察黏膜下淋巴的形态及内皮细胞的超微结构。
1.3.4 吻合口组织转化生长因子(TGF-β)和纤维连接蛋白(FN)的表达 将吻合口组织病理标本以石蜡包埋,切片厚度为5 μm,按S-P法进行免疫组织化学染色。所用试剂均由北京博奥森生物技术有限公司提供。评定标准:TGF-β和FN均以细胞胞质和(或)细胞膜出现黄色或棕黄色颗粒者为阳性细胞,在高倍镜下(×400)各随机选取5个视野,分别计数阳性细胞数的平均值半定量分析。
1. 4 统计学处理
2 结 果
术后模型对照组大鼠死亡1只,5-Fu组死亡3只,解剖均发现吻合口漏。
2. 1 腹部粘连情况
术后7 d,解剖大鼠观察腹部粘连情况,结果显示,PA皮下注射组和PA皮下注射+腹腔喷洒组大鼠的腹部粘连情况均比较轻微,与模型对照组大鼠相近;而5-Fu组大鼠腹部脏器粘连现象非常明显,而且肠管由于慢性梗阻而明显变粗(图1)。
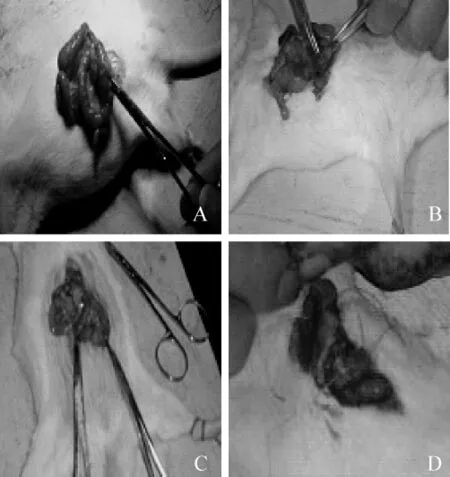
图1 术后7 d各组大鼠腹部粘连情况Fig 1 The level of visceral adhesions afer 7 days
2. 2 吻合口破裂压
术后7 d PA皮下注射组和PA皮下注射+腹腔喷洒组之间肠吻合口破裂压无差异(P>0.05),但显著高于模型对照组和5-Fu组(P<0.01),说明PA注射液对肠吻合口的愈合有一定的促进作用。5-Fu组大鼠破裂压最低,显著低于模型对照组(P<0.01),说明化疗药物5-Fu对肠吻合口组织愈合有严重影响。
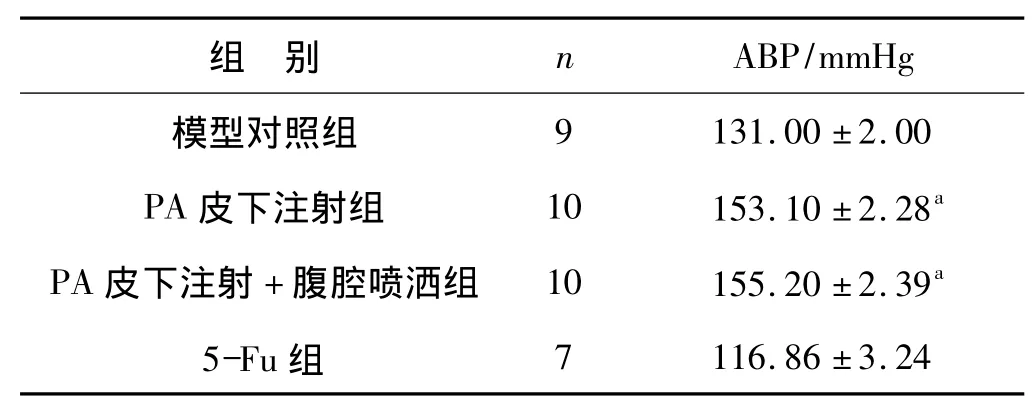
表1 各组吻合口破裂压Tab 1 Anastomotic bursting pressure ineach group
2. 3 病理学及电镜观察结果
吻合口组织HE染色(图2)显示,PA皮下注射组和皮下注射+腹腔喷洒组大鼠的肠吻合口组织中中性粒细胞、成纤维细胞和巨噬细胞等炎性细胞明显增多,细胞核增大、浓染,且胞浆丰富,黏膜上皮移行,肉芽组织毛细血管丰富,可见大量腺体结构。5-Fu组大鼠吻合口组织中炎性细胞较少,且有黏膜破坏。电镜下观察(图3)显示,PA皮下注射组和皮下注射+腹腔喷洒组大鼠吻合口组织黏膜的杯状上皮细胞及黏膜下的淋巴细胞的细胞核明显增大、色深,线粒体等细胞器增多。

图2 大鼠结肠吻合口组织HE染色 ×200Fig 2 The HE stain of anastomosis ×200

图3 电镜下观察结果Fig 3 The observation through electron microscope
2. 4 Masson 三色染色
大鼠结肠吻合口组织Masson染色(图4)显示,术后7 d,PA皮下注射组和皮下注射+腹腔喷洒组大鼠吻合口胶原纤维面积和密度明显增大,分布较有规律;5-Fu组胶原纤维面积明显减少,分布比较紊乱。

图4 大鼠结肠吻合口组织Masson染色 ×200Fig 4 The Masson stain of anastomosis ×200
2. 5 吻合口组织TGF-β和FN的表达
术后7 d,大鼠结肠吻合口组织TGF-β和FN的检测结果显示,PA皮下注射组和皮下注射+腹腔喷洒组之间TGF-β和FN的表达无差异(P>0.05),均高于模型对照组(P<0.05)和5-Fu组(P<0.01)。5-Fu组的TGF-β和FN的表达量最低,显著低于模型对照组(P <0.05)(表2)。
表2 吻合口组织TGF-β和FN %Table 2 Expression of anastomotic TGF-β、FN(x±s) %

表2 吻合口组织TGF-β和FN %Table 2 Expression of anastomotic TGF-β、FN(x±s) %
与 5-Fu组比较,a P<0.01;与模型对照组比较b P<0.05
组 别 n TGF-β 9 25.02 ±2.07 29.82 ±3.03 PA 皮下注射组 10 26.96 ±1.55ab 32.80 ±3.27ab PA皮下注射+ 腹腔喷洒组 10 27.40 ±1.85ab 33.32 ±3.32ab 5-Fu 组 7 22.74 ±1.63b 26.14 ±2.28 FN模型对照组b
免疫组织化学染色(图6)显示,TGF-β主要表达于巨噬细胞、成纤维细胞等,PA皮下注射组和皮下注射+腹腔喷洒组TGF-β表达相对较多,而5-Fu组的表达量明显较少(图5)。FN主要表达于各类增殖细胞,PA皮下注射组和PA皮下注射+术中腹腔喷洒组FN表达明显较多,巨噬细胞、成纤维细胞和上皮细胞等最明显,而5-Fu组FN表达也相对较少。
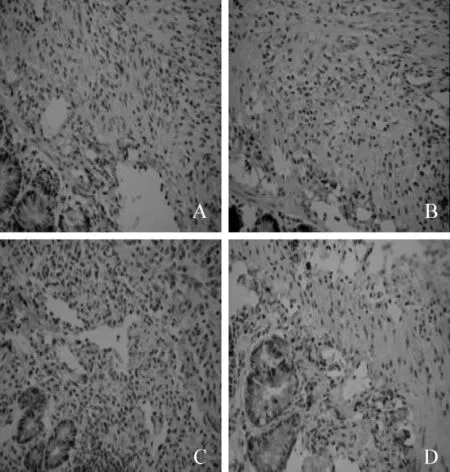
图5 大鼠肠吻合口组织中TGF-β的表达 ×200Fig 5 Expression of anastomotic TGF-β ×200

图6 大鼠肠吻合口组织中FN的表达 ×200Fig 6 Expression of anastomotic FN ×200
3 讨 论
创伤的修复和愈合是一个多因素参与的复杂过程。本研究发现,PA注射液对肠吻合口愈合的影响也是通过多方面的作用实现的。PA注射液属于非特异性免疫激活剂,具有激活补体、促进调理吞噬及调节炎症反应等功能,可激活巨噬细胞和T淋巴细胞等,调节免疫平衡、促进胶原及各种细胞因子的分泌。PA注射液激活机体的免疫系统后,明显地降低了术后感染的发生率,本身就降低了感染对伤口愈合的抑制,在一定程度上促进了愈合[1]。
Mossman等[2]研究表明,Ⅰ型菌毛可特异性激活细胞表面的Toll样受体,同样研究[3]显示,肠道黏膜表面,黏膜固有层的T淋巴细胞、B淋巴细胞、单核细胞、中性粒细胞、嗜酸粒细胞,黏膜下层的动静脉、纵形和环形肌层等处均有Toll样受体的表达。提示PA注射液中所含的Ⅰ型菌毛也能与血管内皮细胞和黏膜上皮细胞的Toll样受体结合,从而通过激活血管内皮细胞、黏膜上皮等促进血管增生及上皮的增殖移行。我们在光镜下可以看到,PA皮下注射组和皮下注射+腹腔喷洒组吻合口组织中炎性细胞较多,血管丰富,黏膜上皮较完整,而5-Fu组则相对较少,黏膜上皮有破坏现象。电镜下显示,PA皮下注射组和皮下注射+腹腔喷洒组吻合口组织中黏膜上皮的杯状细胞核明显增大、增深,线粒体增多,说明细胞被激活后染色质增多,增殖旺盛。
另外,激活巨噬细胞和T淋巴细胞等免疫细胞,不仅提高了机体的免疫功能,对创伤的修复过程起着非常关键的作用[4-5]。巨噬细胞和T淋巴细胞等免疫细胞表面也有Toll样受体,也可被PA注射液的Ⅰ型菌毛特异性激活。巨噬细胞被激活后,产生TGF-β、VEGF和PDGF等细胞因子以及FN等的功能也必然增强。本研究中,PA皮下注射组和皮下注射+腹腔喷洒组术后7 d TGF-β和FN的表达明显升高;Masson染色显示吻合口的胶原也增多,而且分布也更加规律;吻合口的破裂压也相应增高。
TGF-β是一种多功能生长因子,主要由巨噬细胞和成纤维细胞等分泌,反过来又进一步增强巨噬细胞和成纤维细胞的活性,促进成纤维细胞的增殖移行,还可调节胶原的沉积[6]。Migaly等[7]研究发现,结肠吻合术后皮下导管注射腺病毒携带的TGF-β1,能够增加吻合口破裂压,并促进结肠的愈合。FN是存在于细胞表面、细胞外液、结缔组织和大多数基底膜中的一组结构类似、免疫原性相同的糖蛋白,主要由增殖细胞合成,存在于巨噬细胞、血管内皮细胞、成纤维细胞、平滑肌细胞等的表面,是连接细胞与细胞外纤维和基质的介质。手术后,FN可增加血小板在吻合口的附着,促进吞噬细胞、纤维母细胞、内皮细胞和表皮细胞黏附、迁移及增生,参与吻合口早期和中期组织的修复和愈合[8]。
一方面,TGF-β和FN由激活的巨噬细胞、成纤维细胞和内皮细胞等增殖细胞合成,另一方面,TGF-β和FN又反过来激活这些细胞的活性,形成一个复杂机制。而5-FU作为常用的化疗用药,抑制DNA和RNA的合成,不仅降低了机体的免疫力,也抑制巨噬细胞和T淋巴细胞等免疫细胞的活性,抑制TGF-β等细胞生长因子的合成和分泌,阻碍了伤口的愈合。因此,在本研究中,5-FU组术后7 d组织炎性细胞明显减少,TGF-β和FN的表达也伴随减少,导致黏膜的坏死,胶原沉积的减少、分布不均匀及吻合口破裂压的降低。这也是实验中PA皮下注射组和皮下注射+腹腔喷洒组腹腔粘连无加重,而5-FU组却粘连却较重的原因。PA注射液能从总体上提高机体免疫水平,伴随各种细胞因子增加,如 TGF-β[9],一方面 TGF-β1 促进愈合,能增加瘢痕生成,另一方面TGF-β3则能下调TGF-β1抵抗瘢痕形成;此外,巨噬细胞分泌的PDGF[10]等也能促进愈合并降低瘢痕生成,减少粘连的发生。但具体的作用机制还有待于进一步的研究。
综上所述,PA注射液可提高机体的免疫状态,增加吻合口炎性细胞数量,从多方面促进吻合口的早期愈合,降低吻合口漏的发生,而且不会加重粘连程度。
[1]程然,牟心赤,牟希亚.绿脓杆菌-MSHA菌毛株菌苗对医院感染及肿瘤的治疗研究[J].中国微生态学杂志,2002,14(3):173-175.
[2]MOSSMAN K L,MIAN M F,LAUZON N M,et al.Cutting edge:FimH adhesin of type 1 fimbriae is a novel TLR4 ligand[J].J Immunol,2008,181:6702-6706.
[3]马继民,崔杰,杨志军.急性坏死性胰腺炎时肠道 Toll样受体4的表达及其意义[J].东南大学学报:医学版,2007,26(6):436-440.
[4]SHIRAFUJI T,OKA T,SAWADA T,et al.The importance of peripheral blood leukocytes and macrophage infiltration on bronchial wall wound healing inrats treated preoperatively with anticancer agents[J].Surg Today,2001,31(4):308-316.
[5]JAMESON M,UGARTE K,CHEN N,et al.A ral for skin gammadelta T cell in wound repair[J].Science,2002,296(5568):747-749.
[6]李曙光,李荣,张静.消化道吻合术及其愈合的研究进展[J].河北北方学院学报:医学版,2006,23(6):63-67.
[7]MIGALY J,LIEBERMAN J,LONG W,et al.Effect of adenoviral-mediated transfer of transforming growth factor-beta1 on colonic anastomotic healing[J].Dis Colon Rectum,2004,47(10):1699-1705.
[8]MIDWOOD K S,MAOY,HSIA H C,et al.Modulation of cellfibronectin matrix interactions during tissue repair[J].Investig Dermatol Symp Proc,2006,11(1):73-78.
[9]MARTIN P.Wound healing-aiming for perfect skin regeneration[J].Science,1997,276(5309):75-81.
[10]GOPE R.The effect of epidermal growth factor& platelet-derived growth factors on wound healing process[J].Indian J Med Res,2002,116:201-206.
