慢病毒载体介导IL-4基因修饰BMSCs内耳局部应用治疗免疫性感音神经性聋的实验研究
2011-01-06郭浪谭长强崔毓桂李王伟
郭浪,谭长强,崔毓桂,李王伟
(1.南京医科大学第一附属医院 耳鼻咽喉科,江苏 南京 210029;2.南京医科大学第一附属医院生殖中心实验室,江苏南京 210029)
免疫性内耳病(immune-mediated inner ear disease,IMIED)包括内耳局部的免疫炎性疾病和自身免疫性内耳疾病,可以造成内耳组织损伤和生理功能障碍(包括感音神经性聋和平衡功能障碍等)。免疫抑制剂(肾上腺皮质激素、细胞毒性免疫抑制剂)对内耳免疫炎性病变具有较为可靠的治疗效果,但其毒副作用明显,并存在停药后易复发等问题[1]。基因治疗具有一次给药、长期有效的特点,而内耳局部解剖特点(即存在诸多腔隙)非常适合实施局部基因治疗。
骨髓间充质干细胞(bone-marrow mesenchymal stem cells,BMSCs)由于具有多向分化潜能及在体内可向急性损伤部位迁移的特性,现已成为干细胞治疗研究的热点,也逐渐成为基因治疗的主要靶细胞之一。体外实验显示,基因转染的BMSCs能较长时间的表达外源基因,这使得基因修饰的BMSCs治疗疾病成为可能。利用慢病毒载体能高效感染BMSCs,使其成为基因治疗的载体再植入内耳的方法,与重组慢病毒载体直接注入转染内耳组织相比较,可准确了解和调控导入的基因量。通过体内该载体干细胞移植,使治疗基因更集中在病变部位,减少病毒载体的使用量从而减少不良事件的发生。而且BMSCs与自身免疫病的发生、发展有着密切的关系,即其本身具有免疫调节和治疗效能。现已有研究发现并证实,BMSCs对许多自身免疫性疾病的免疫炎性病理损伤有较好的调节和治疗作用[2]。
白细胞介素-4(IL-4)是Ⅱ型辅助T细胞(Th2细胞)分泌的细胞因子。IL-4能够刺激活化B细胞和T细胞增殖、CD4+T细胞分化成Ⅱ型辅助T细胞,它也在调节体液免疫和适应性免疫中起关键作用。有研究表明,IL-4具有与IL-10、FasL同样的抗炎作用,当炎性组织中Th2占优势时,IL-4、IL-10、IL-13等细胞因子大量分泌,拮抗炎症反应,疾病自发缓解。针对上述特点,目前在类风湿性关节炎(RA)的研究中,已有学者将免疫调节分子(如IL-4、IL-10)、可溶性肿瘤坏死因子受体、趋化因子拮抗剂、超氧化物歧化酶,反应性氧特异性清除酶等的基因转导入关节腔,用以拮抗炎症反应,诱发Th1向Th2的免疫偏移。IL-4质粒或腺相关病毒介导的IL-4基因经肌肉注射或关节腔内注射,可使RA病变得到缓解[3]。另有研究发现,IL-4与凋亡蛋白FasL联合作为免疫性损伤治疗均可达到抗炎目的[4]。基于上述情况,本研究选择IL-4基因作为治疗基因,利用其抗炎及免疫调节作用,探索其对免疫性内耳病的炎性损伤以及由此所造成的听觉功能障碍的影响及治疗作用。
1 材料与方法
1. 1 实验动物
健康6~8周龄白毛红目豚鼠44只,雌雄不拘,体重250~300 g,耳廓反射正常,耳镜检查排除中耳疾患,所有动物均由南京青龙山动物养殖场提供。
1. 2 抗原
钥孔嘁血蓝蛋白(keyhole limpet hemocyani,KLH)为一种深海软体动物体内提取的纯化蛋白,购自美国Sigma公司。
1. 3 免疫性感音神经性聋(immune-mediated sensorineural hearing loss,IMSNHL)动物模型制备及实验分组
1.3.1 动物模型制备 将500 μg KLH溶解于250 μl PBS(0.01 mol·L-1,pH 7.4)中,与等量完全弗氏佐剂混匀后,注射于豚鼠右后足垫。2周后,将500 μg KLH溶解于 250 μl PBS(0.01 mol·L-1,pH 7.4)中,与等量不完全弗氏佐剂混匀,于豚鼠背部多点皮下注射,加强免疫。2周后,再于圆窗龛局部免疫,具体步骤:1%的戊巴比妥钠(30 mg·kg-1)在豚鼠腹腔注射麻醉后,在耳廓后方作一弧形切口,分离并暴露听泡,用电钻钻一小孔,显露圆窗龛。在手术显微镜下将一小片吸附5.2 mg·ml-1KLH的明胶海绵放置于圆窗龛局部。最后一次加强免疫2周后,依据听觉诱发电位Ⅲ波的阈值升高(超过免疫前全部动物均值2倍标准差)和血清中抗KLH特异性抗体水平升高(ELISA法,A490nm值超过免疫前全部动物均值加2倍标准差),判断为免疫性内耳病模型动物[5]。本研究33只动物造模成功。
1.3.2 实验分组 将造模成功的33只IMSNHL模型动物按配对设计,分为3组。IL-4基因修饰BMSCs组(A组):内耳注入重组慢病毒感染成功的IL-4基因修饰BMSCs悬液;BMSCs空载对照组(B组):内耳注入慢病毒空载体感染成功的BMSCs悬液;模拟手术对照组(C组):内耳注入PBS溶液。注入的液体量均为20 μl(BMSCs悬液中含 BMSCs 1.5 ×106~2.0 ×106个)。
1. 4 BMSCs的获取、培养与标记
1.4.1 取股骨 将3~4周龄、体重250 g左右白毛红目豚鼠乙醚麻醉后,用75%酒精浸泡20 min消毒后,断颈处死。戴无菌手套用高压灭菌之手术剪剪开大腿部皮肤、肌肉,暴露股骨,分离出两侧股骨,置于培养皿中的灭菌PBS液中,浸泡5 min。
1.4.2 BMSCs的分离、培养 将含10%胎牛血清的DMEM低糖培养基5 ml置于培养皿中,剪断股骨两端,用5 ml注射器吸取无血清的培养基来反复吹出股骨中的骨髓组织,直到股骨颜色由红变白。将同一只大鼠两侧股骨骨髓吹在同一培养皿中,然后用注射器反复吹打均匀后,移入10 ml离心管,以1 000 r·min-1离心10 min,弃上清及脂肪层,细胞沉淀中加入含10%FBS和1%青、链霉素的L-DMEM培养基,细胞计数,调整细胞密度,按照1×106个·ml-1接种在25 cm2的培养瓶中。以上操作均在超净台中进行。
1.4.3 培养与传代 细胞在37℃、饱和湿度、5%CO2恒温培养箱中静置培养,48 h后弃去原培养基和未贴壁细胞,更换新的全培养基,以后每隔3~4 d细胞换液,待细胞密度达到80% ~90%基本融合后,用0.25%的胰蛋白酶消化,1∶2的比例继续传代培养。
1.4.4 BMSCs获取 利用改良直接贴壁法[6-7]获得豚鼠BMSCs,置于DMEM培养基中培养、传代。传代3次后,获得纯度较高的 BMSCs,备慢病毒感染使用。
1. 5 慢病毒载体的包装和重组慢病毒载体的鉴定
1.5.1 慢病毒载体的包装和标记 将慢病毒载体包括包膜质粒 pVSG、包装质粒 pHELPER、载体质粒pNL-IRES2.EGFP 3 种成分按1∶1∶1 的比例混匀,总量为8 mg,加入高糖DMEM培养基至0.5 ml,混合均匀。取20 μl Lipofectamine 2 000质体,加入高糖 DMEM 培养基0.5 ml,室温孵育5 min,轻柔加入至培养有293 T细胞的60 mm培养皿中,于37℃、5%的CO2孵箱中培养6 h后,小心吸弃上清,更换为高糖DMEM完全培养液继续培养。24 h后荧光显微镜观察转染情况。转染后48、72 h 收集含病毒上清,以 4 500 r·min-1离心20 min,收集上清,保存于-70℃备用。
1.5.2 重组慢病毒pll 3.7-IL-4鉴定 分别将pll 3.7-IL-4慢病毒液2 ml感染80%融合的293细胞,待单层细胞大部分变圆但尚未脱落时收集细胞,反复冻融3次,取少许提取慢病毒DNA,进行PCR鉴定。
1. 6 慢病毒载体感染BMSCs
体外培养的BMSCs扩增至第3代,细胞达80%融合,吸弃培养基,每个25 cm2细胞培养瓶加入1×108ml-1重组IL-4慢病毒15 μl,同时加入聚凝胺至终浓度为8 mg·L-1,8 h后更换为低糖DMEM完全培养液继续培养。24 h后荧光显微镜观察,并重复第1天感染步骤再次感染(复染)。48 h后在荧光显微镜下观察绿色荧光蛋白的表达,阳性呈明亮的黄绿色。当细胞融合达90%,可进行传代。以慢病毒感染BMSCs的cDNA为模板进行PCR检测慢病毒载体基因。空载BMSCs制取步骤同上述,但感染BMSCs的慢病毒为未重组IL-4基因的空载体。感染成功的BMSCs备用于内耳植入。
1. 7 BMSCs的内耳植入
将上述感染成功的BMSCs(G3)用胰酶消化,以1 000 r·min-1离心 10 min,无血清 DMEM 培养基重悬,并进行细胞计数,制备成(1.0 ~2.0)×1010L-1的细胞悬液。圆窗龛局部免疫后2周,豚鼠用1%的戊巴比妥钠(30 mg·kg-1)腹腔注射麻醉后,在耳廓后方作一长约2~3 cm弧形切口,分离皮下肌肉与筋膜,显露听泡,用微型电钻打开听泡,暴露耳蜗底转,在鼓阶侧壁的骨壁钻一针尖大小的孔(不穿透内骨膜)。用微推进器将小儿头皮针的针尖(针尖斜面已打磨变平)插入鼓阶,深度不超过1 mm,先抽取少量(约10 μl)的外淋巴液,再依据分组情况,用微量注射机将BMSC细胞悬液或PBS(1 μl·min-1)注入鼓阶。骨蜡封闭耳蜗底转的骨孔。抗生素冲洗中耳腔3次,骨蜡封闭听泡骨孔,逐层缝合切口(图1~3)。所有操作均在无菌条件下进行。

图1 鼓阶内注射的手术照片Fig 1 The figure after the injectin in scala tympani
1. 8 观察指标
1.8.1 特异性免疫反应测试 采用酶联免疫吸附试验(ELISA)测定特异性血清中抗KLH抗体水平。3次测试分别于免疫前、圆窗龛局部免疫后2周、鼓阶内植入术后1周(即末次听觉功能测试后)进行。心脏采血,分离血清。用100 μg·ml-1的 KLH 溶液包被 96孔酶联板,于4℃过夜并封闭,加入1∶10稀释的豚鼠血清,37℃下孵育2 h,洗板5次,加入1∶2 000稀释的辣根过氧化物酶标记的葡萄球菌蛋白A(staphylococcal protein A-HRP,SPA-HRP),37 ℃下孵育1 h,洗板5 次,加入3,3,5,5-四甲基联苯胺(3,3,5,5-tetramethyl benzidine,TMB)底物溶液,显色10 min后用H2SO4终止显色,在酶标仪下测定波长为490 nm的A值。
1.8.2 听性脑干诱发电位(auditory brain-stem response,ABR)测试 分别于免疫前、圆窗龛局部免疫后2周、鼓阶内植入术后1周采用TuckerDavisTechnology(TDT)BioSig SystemⅢ听觉研究系统(TDT system 3)(美国TDT公司)测定听觉功能。豚鼠头顶冠状缝与矢状缝交界处插入针形电极作为测试电极,参考电极置于被测耳的耳廓后方靠近乳突尖,接地电极置于鼻尖,刺激声信号采用Click,重复频率为11次·min-1,叠加2 048次,记录时程10 ms,测定Ⅲ波的阈值(dB,nHL)。
1.8.3 内耳光镜观察 各组分别于圆窗龛局部免疫后2周、鼓阶内植入术后1周,在听觉测试后每次各取2只豚鼠,麻醉后断头,立即取出颞骨,打开听泡,放置4%多聚甲醛固定液中,12 h后,放入10%乙二胺四乙酸钙钠盐(EDTA)中脱钙5~7 d,修剪后流水冲洗1~2 h,常规脱水、透明、浸蜡、定向包埋。耳蜗中轴切片,片厚5 μm,漂片、捞片、粘片,常规 HE染色,封片,光镜观察和照相。
1.8.4 免疫组织化学试验 (1)内耳石蜡包埋和切片制备:各组于鼓阶内植入术后1周,听觉测试后,将剩余豚鼠麻醉、断头,迅速取颞骨,打开听泡,放置4%多聚甲醛固定液中,用针挑开圆窗,在蜗尖钻一小孔,快速灌注数次,固定12 h,采用EDTA脱钙1周,修剪后流水冲洗1~2 h,常规脱水、透明、浸蜡、定向包埋。(2)免疫荧光化学试验:每组4只(8耳)的蜡块行耳蜗中轴切片,片厚4 μm,漂片、捞片、粘片后常规脱蜡至水,在荧光显微镜下行荧光自显影观察和照相。(3)酶免疫组织化学试验:每组3只(6耳)按上述方法获得耳蜗石蜡切片,用胰酶(0.2%)修复抗原,余具体步骤:正常山羊血清封闭10 min,加PBS稀释的第一抗体(兔抗鼠IL-4单克隆抗体),4℃过夜,PBS洗5 min×3次,加入HRP标记的羊抗兔单克隆抗体作为二抗,37℃孵育30 min,PBS洗5 min×3次,DAB(3,3'-diaminobenzidine)染色,树脂封片剂封片,光镜观察照相。
2 结 果
2. 1 BMSCS 培养情况
见图2。
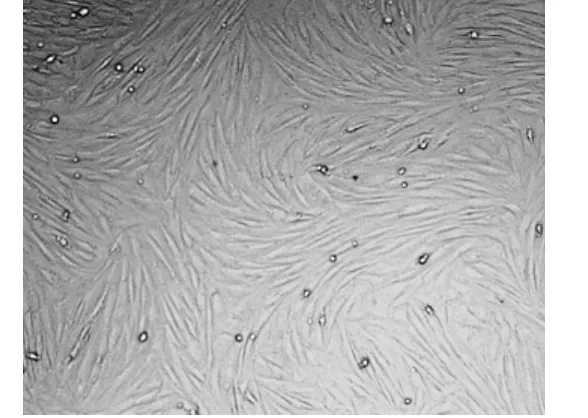
图2 倒置显微镜下的第三代BMSCS ×100 细胞呈均匀一致的纺锤形,融合成旋涡状Fig 2 The spectation of BMSCS in third generation under the inverted microscope
倒置显微镜观察到BMSCs原代细胞刚接种时呈圆形,传代3次后,获得了纯度较高的BMSCs,备慢病毒感染使用。
2. 2 重组慢病毒pll 3.7-IL-4鉴定
见图3、4。
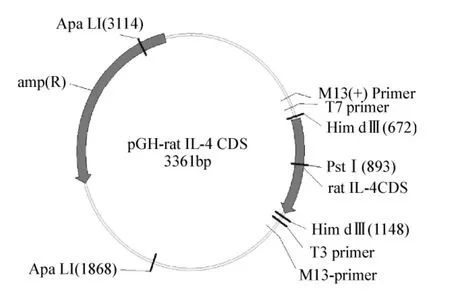
图3 重组慢病毒pll 3.7-IL-4结构图Fig 3 The structure of recombinant lent-ivirus pll 3.7-IL-4

图4 重组慢病毒pll 3.7-IL-4溶液的电泳图 左侧条带为重组慢病毒pll 3.7-IL-4鉴定结果,右侧条带为markerFig 4 Electorphoretogram of IL-4 recombinant lentivirus pll 3.7-solution.The left band is the identified result of recombinant lentivirus pll 3.7-IL-4,right band is the marker
2. 3 重组慢病毒pll 3.7-IL-4感染细胞能力鉴定
见图5。

图5 慢病毒感染BMSCs 48 h 荧光显微镜 ×200Fig 5 The fluorescence picture of BMSCs 48 h after the lentiviras infection ×200
2. 4 病毒载体质粒基因RT-PCR分析
见图6。
以慢病毒浓缩液以及慢病毒感染骨髓MSCs的DNA和cDNA为模板进行PCR检测慢病毒载体基因,均可见目的条带,条带大小为412 bp。
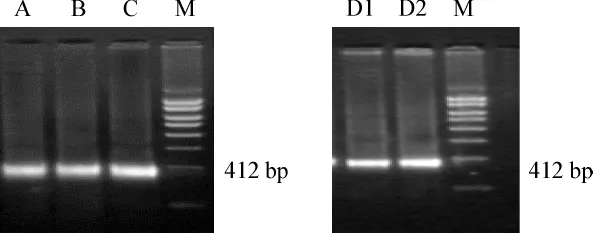
图6 病毒载体质粒基因RT-PCR(a、b)Fig 6 The RT-PCR of lentiviral vector plasmid gene(a、b)
2. 5 特异性免疫反应试验结果
见表1。
由表1可见,与免疫前相比,各实验组和对照组免疫后抗体水平均明显升高(配对t检验,P<0.05)。免疫前和免疫后的各组间抗体水平比较差异无统计学意义(配对t检验,P>0.05)。内耳注射后与免疫后结果相比差异无统计学意义(配对t检验,P>0.05)。
2. 6 听觉功能
以ABRⅢ波反应阈作为评定听力水平的指标,结果见表2。
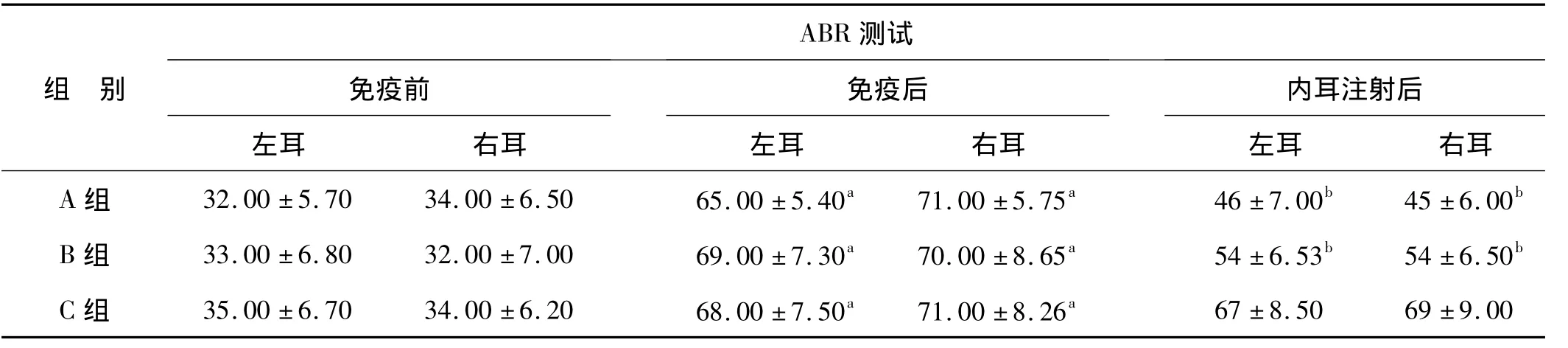
表2 免疫前后和内耳注射后各组ABR测试结果(dB,SPL)(x±s)Tab 2 Result of the auditory brainstem response(ABR)from each group before and after the immunization(dB,SPL)(x±s)
与免疫前相比,免疫后各组ABRⅢ波平均阈值升高,差异均有统计学意义(配对t检验,P<0.05)。与免疫后相比,内耳注射后A组和B组ABR平均阈值降低,差异均有统计学意义(配对t检验,P<0.05);A组平均阈值降低更为明显。C组内耳局部注射前后比较,差异无统计学意义。各组组内同期左右耳比较差异均无统计学意义(配对t检验,P>0.05)。A组和B组分别以其免疫后的ABR平均阈值减2倍标准差作为判断内耳局部注射后听觉功能改善标准,A组有7只(12耳)、B组有5只(9耳)听觉功能明显提高,治疗有效率分别为66.67%(12耳/18耳)和50.00%(9耳/18耳)。同样以C组免疫后的ABR平均阈值减2倍标准差作为其判断内耳局部注射后听觉功能改善标准,则未发现有明显听力功能提高耳。
2. 7 内耳光镜观察结果
见图7~9。免疫后各组内耳均出现较为显著的炎症反应,主要表现包括:Rosenthal's管中和螺旋神经节内出现炎症细胞(以单个核细胞为主)浸润,螺旋神经节细胞变性(主要表现为胞体肿胀)和螺旋神经节细胞数减少;蜗管及鼓阶或前庭阶可见絮状物,鼓阶内积(出)血,蜗管内出现“漂浮细胞”。Corti器及毛细胞形态未见明显异常。内耳局部细胞植入后,A组和B组的炎症反应明显较C组为轻,尤其是听觉功能改善耳,仅在蜗轴血管周围有部分单个核细胞浸润,但螺旋神经节细胞形态和数目基本正常,Corti器和血管纹未见明显异常。鼓阶内见部分絮状物,但未见“漂浮细胞”。
2. 8 免疫荧光组织化学试验结果
见图8。鼓阶内局部注射后,A组(图8a)和B组(图8b)可见鼓阶内和前庭阶内有显著荧光反应的细
胞团块,并在血管纹、前庭膜下、骨螺旋板唇部、Corti器等部位亦有荧光显示,C组(图8c)则未见有明显荧光显色。
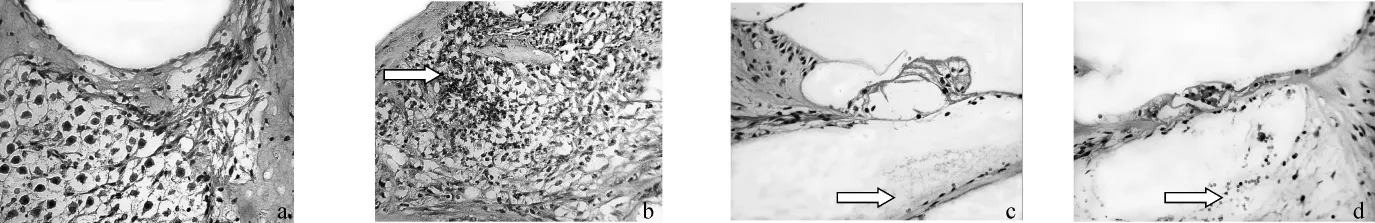
图7 内耳光镜观察 40×10
a.A组1只动物内耳局部细胞植入后耳蜗纵轴切片,见螺旋神经节结构基本正常;b.C组1只动物的免疫后耳蜗纵轴切片,见螺旋神经节内出现明显炎症细胞浸润;c.B组1只动物的内耳细胞植入后耳蜗纵轴切片,可见鼓阶内有絮状物;d.C组1只动物的免疫后耳蜗纵轴切片,见鼓阶内出现积(出)血
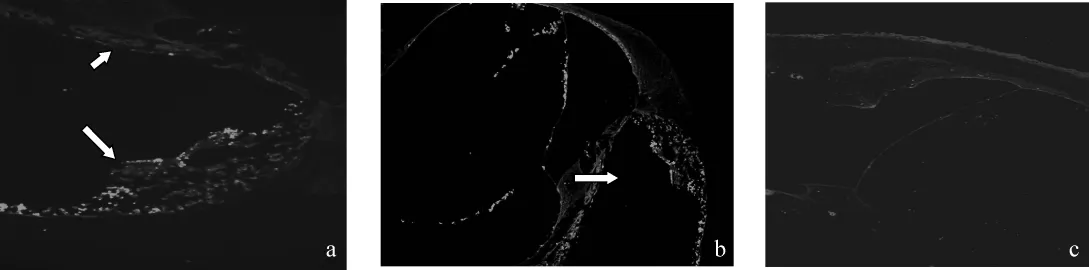
图8 各组内耳免疫荧光组织化学染色结果
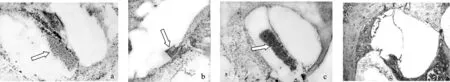
图9 各组酶免疫组织化学染色结果
2. 9 酶免疫组织化学试验结果
见图9。鼓阶内BMSCs植入内耳后,A组(图9a、b)可见鼓阶内干细胞团块和骨螺旋板的唇部有明显的褐色酶反应阳性显色,另外Corti器、螺旋神经节等部位亦有弱阳性酶反应阳性显色。B组(图9c)可见鼓阶内有干细胞团块,但无明显阳性显色反应,其他组织部位亦未见明显的阳性酶反应显色。C组(图9d)内耳各部位均未见有明显酶反应阳性显色。
3 讨 论
1979年McCabe首次报道了自身免疫性感音神经性聋(autoimmune sensorineural hearing loss,ASNHL)[8],此后,一类由免疫介导的内耳损害所致的疾病或症状群陆续被报道,统称为免疫介导的内耳病(immune-mediated inner ear disease,IMIED),包括自身免疫性内耳病(autoimmune inner ear disease,AIED)、特发性快速进展性双侧感音神经性聋、免疫介导的双侧梅尼埃病、以及系统性自身免疫病(非器官特异性,如韦格纳肉芽肿病、Cogan综合征、多发性结节性动脉炎、系统性红斑狼疮等)引起的内耳病。由于目前尚缺乏有效的、特异性和准确性较高的检测手段来确认免疫性相关内耳病,同时也不可能直接在人体上获取标本进行病理组织学观察和研究,因此,通过免疫动物建立模型便成为研究的主要手段。与免疫损伤相关的内耳病的病因和发病机制尚不十分清楚,临床缺乏特异性诊断方法,治疗方面目前主要是采用皮质激素或免疫抑制剂治疗,虽然在早期有肯定的疗效,但该类药物毒副作用多,而且还存在停药后易复发等问题。内耳存在腔隙可以局部注入药物,与全身给药相比,理论上有4大优点[9-11]:(1)目的性强,药物靶向性好;(2)可避开血-迷路屏障,直接进入内耳;(3)内耳的内、外淋巴液中药物浓度高;(4)可避免全身性的药物毒、副作用。
本项目组在先前的实验研究中已采用了内耳局部注射给药,并证实未造成明显的内耳生理功能障碍。直接将腺病毒及慢病毒携带治疗基因导入内耳治疗自身免疫性感音神经性耳聋,虽然在一定的程度上显示出了治疗效果,但其病毒转染量无法有效地控制,且关于腺病毒及慢病毒载体是否对内耳有损伤,以及其以后在临床上是否被接受,还存在一定的风险及争议。近年来已有报道基因转染细胞的移植是一种传递基因到内耳的有效治疗策略[12],另有研究观察发现,当BMSCs移植入病理损伤的内耳后,免疫组织化学显示,BMSCs源性细胞向有损伤部位迁移的现象,表明BMSCs不仅可以作为种子细胞发挥相应的治疗作用,我们还可以利用其具有载体功能和迁移能力,把拟导入的目的基因携带到病理损伤部位,进而起到治疗作用。
BMSC是一种具有多向分化潜能的干细胞,它具有低免疫原性免疫抑制功能。已有实验研究结果显示,BMSCs有助于内耳炎性损伤的修复,Sharifa等[13]通过观察BMSCs移植入正常C57BL/6小鼠耳蜗的分布特点和形态,来评估BMSCs作为在耳蜗细胞移植替代治疗的潜能。将携带增强型绿色荧光(EGFP)的BMSCs在注入耳蜗内后,免疫组织化学观察发现其迁移入耳蜗,主要分布在外淋巴隙,并在螺旋韧带和螺旋唇部位亦有荧光显色,这与本实验所观察到的荧光分布结果基本一致。鉴于其中一些移植细胞表达耳蜗连接蛋白 connexin 26,Sharifa等[13]认为,BMSCS 具有传递治疗分子以及修复耳蜗细胞的潜能,特别是在螺旋韧带(SL)和螺旋唇部附近(SLB)。
许多免疫相关性疾病(包括自身免疫性疾病)以B淋巴细胞的过度激活和产生大量自身抗体为主要特征。T细胞包括Th1和Th2,Th2细胞主要分泌IL-4、IL-6、IL-10等。IL-4既可刺激T细胞又可刺激B细胞增殖,即可循环不断地分泌IL-4而发挥其作用。研究表明[14],IL-4能诱导人单核细胞产生IL-1受体拮抗剂(IL-1Ra),抑制巨噬细胞克隆形成及巨噬细胞游走,在控制和消除炎症中起着非常重要的作用。作者采用深海软体动物提取的纯化KLH抗原加弗氏佐剂免疫和致敏豚鼠,再在其圆窗龛局部免疫,造成部分实验动物出现感音神经性耳聋和血清特异性抗体水平升高,即成功地制备了免疫原性内耳病动物模型。构建整合了IL-4基因的重组慢病毒载体,将该重组载体感染从豚鼠股骨干提取并培养的BMSCs,再将通过绿色荧光染色证实成功表达治疗基因IL-4的BMSCs采用鼓阶注射的方法植入豚鼠内耳。结果显示,重组IL-4基因的慢病毒载体可在体外成功转染BMSCs,并能产生IL-4基因产物。经鼓阶途径植入内耳后,BMSCs在内耳(主要是鼓阶和前庭阶腔隙,少量迁移至Corti器、血管纹、骨螺旋板的蜗管内唇部、螺旋神经节及耳蜗骨壁等部位)存活,提示BMSCs因具有低免疫原性,可有效地避免免疫排斥。B组和C组酶免疫组织化学结果证实:免疫炎症反应所造成的内耳局部产生IL-4(本底)极少;而A组显示鼓阶和前庭阶内有褐色酶反应阳性细胞(干细胞)团块,另外在骨螺旋板的唇部亦有明显的褐色酶反应阳性反应,Corti器、螺旋神经节等部位亦有弱阳性酶反应阳性显色。证明植入的IL-4基因修饰BMSCs可产生过量的基因产物(IL-4)。这些内耳免疫组织化学观察结果和病理形态学观察结果,结合听觉电生理测试结果(即与KLH抗原免疫后相比,内耳局部细胞植入后A组和B组ABRⅢ波平均阈值降低,A组平均阈值降低更为明显)证实,BMSCs可作为一种载体将重组IL-4基因迁移至组织病变部位,即有向病变部位迁移、聚集的作用,进而对IMIED所造成的免疫炎性损伤产生一定程度的免疫调节和治疗作用,A组导入内耳BMSCs产生的IL-4基因产物可增强这一作用。
本研究采用鼓阶内的一点注射,结果显示导入的BMSCs在内耳分布较为广泛,依据内耳解剖学和组织学特点,我们推测除了BMSCs有向病变部位迁移的可能外,可能还有3个途径使植入细胞从鼓阶分布到蜗管:(1)通过骨螺旋板下层中的小孔与鼓阶的外淋巴液相交通;(2)通过蜗神经纤维穿过的细孔与鼓阶的外淋巴液相交通;(3)鼓阶和前庭阶在顶回以蜗孔相交通,蜗管中的内淋巴液通过前庭膜与外淋巴液相交通。具体情况尚有待进一步研究探明。
[1]McDONOUGH A K,CURTIS J R,SAAG K G.The epidemiology of glucocorticoid-associated adverse events[J].Curr Opin Rheumatol,2008,20(2):131-137.
[2]SCHERER H U,van PEL M,TOES R E.Mesenchymal stem cells in autoimmune diseases:hype or hope?[J].Arthritis Res Ther,2010,12(3):126.
[3]HO S H,HAHN W,LEE H J,et al.Protection against collagen-induced arthritis by electrotransfer of an expression plasmid for the interleukin-4[J].Biechem Biophys Res Commun,2004,321(4):759-766.
[4]NAKAMURA K,AMAKAWA R,TAKEBAYASHI M,et al.IL-4 producing CD8(+)T cells may be an immunological hallmark of chronic GVHD[J].Bone Marrow Transplant,2005,36(7):639-647.
[5]张靖华,吴皓.免疫性内耳病模型的建立及地塞米松圆窗和全身给药的疗效[J].上海交通大学学报:医学版,2007,27(1):26-28.
[6]FRIEDENSTEIN A J,CHAILALDYAN R K,GERASIMOV U V.Bone marrow osteogenic stem cell:in vitro cultivation and transplantation in diffusion chambers[J].Cell Tissue Kinet,1987,20(3):263-272.
[7] LISIGNOLI G,REMIDDI G,CATTINI L,et al.An elevated number of differentiated osteoblast colonies can be obtained from rat bone marrow stromal cells using a gradient isolation procedure[J].Connect Tissue Res,2001,42(2):49-58.
[8]MCCABE B F.Autoimmune sensorineural hearing loss[J].Ann Otol Rhinol Laryngol,1979,88(5 Pt 1):585-589.
[9]XENELLIS J,PAPADIMITRIOU N,NIKOLOPOULOS T,et al.Intratympanie steroid treatment in idiopathic sudden sensorineural hearing loss:a control study[J].Otolaryngol Head Neck Surg,2006,134(6):940-945.
[10]陈文博,谭长强.IL-10基因重组慢病毒载体不同途径导入内耳局部治疗自身免疫性感音神经性聋的实验研究[J].东南大学学报:医学版,2010,29(3):262-267.
[11]蔡文君,谭长强.自身免疫性感音神经性聋基因治疗的实验研究[J].东南大学学报:医学版,2009,28(2):79-84.
[12]OKANO T,NAKAGAWA T,KITA T,et al.Cell-gene delivery of brain-derived neurotrophic factor to the mouse inner ear[J].Mol Ther,2006,14(6):866-871.
[13]SHARIFA S,NAKAGAWA T,OHNO T,et al.The potential use of bone marrow stromal cells for cochlear cell therapy[J].Neuroreport,2007,18(4):351-354.
[14]HO S H,HAHN W,LEE H J,et al.Protection against collagen-induced arthritis by eleetrotransfer of an expression plasmid for the interleukin-4[J].Biechem Biophys Res Commun,2004,321(4):759-766.
