p38、NF-κB、IL-6在长期大强度运动诱导大鼠骨骼肌发生中的作用
2010-12-29王今越丁树哲王小虹陈民盛杨海东
王今越,丁树哲,王小虹,陈民盛,杨海东
p38、NF-κB、IL-6在长期大强度运动诱导大鼠骨骼肌发生中的作用
王今越1,丁树哲2,王小虹3,陈民盛4,杨海东5
目的:研究p38、NF-κB、IL-6在长期大强度运动诱导肌肉发生过程中的作用。方法:18只雄性SD大鼠分为3组,C组(安静组)、E组(2周运动组)、I组(2周运动并施加NF-κB阻断剂 PDTC)。检测 C、E组大鼠腓肠肌的质量、p38、Phospho-p38、p65、Phosphop65、IL-6 mRNA、MRFs mRNA、MEF2c mRNA,I组检测腓肠肌的质量、IL-6 mRNA、MRFs mRNA、MEF2c mRNA。结果:与 C组相比,E组大鼠腓肠肌的质量、Phospho-p38、Phosphop65、MyoD mRNA、MyoGmRNA、Myf-5 mRNA、MEF2c mRNA 上升 ,但 p38、p65、IL-6 mRNA、MRF4 mRNA未变;与 E组相比,I组大鼠腓肠肌质量、MyoD mRNA、MyoGmRNA、Myf-5 mRNA、MEF2c mRNA 降低 ,但 IL-6 mRNA、MRF4 mRNA 未改变。结论:p38/NF-κB/MyoD、MyoG、Myf-5、MEF2c介导了长时间运动诱发的肌肉发生过程,但 IL-6可能没有参与其中。
长期大强度运动;p38;NF-κB;IL-6;肌肉发生;鼠;动物实验
前言
骨骼肌具有高度可塑性,长期的肌肉收缩、特别是大强度的肌肉收缩会有效引起肌肉代偿性生长,促进肌肉围度、肌肉质量的增长,改善肌肉运动能力。肌肉生长的核心机制是肌肉发生。狭义的肌肉发生仅指在胚胎发育过程中,体节细胞经过一系列增殖、迁移、分化,最终形成肌肉组织的过程,广义的肌肉发生还包括成体肌肉发育过程,它既包括成体肌肉干细胞的增殖、分化、融合、成熟,也包括肌纤维本身蛋白表达、合成的增强。多年来,生物界、医学界、体育界共同对成体肌肉发生机理展开了大量的研究,并取得累累硕果,但是其细胞内事件仍有很多未知问题。
在肌肉发生诸多调控因子中,p38、NF-κB、IL-6的作用尤为引人注目。p38是肌肉发生特别是分化过程的重要调节剂,阻断p38α、β后明显阻止了成肌细胞融入肌管及肌肉特异性基因的表达,通过激活MKK6的突变体,激活p38在抑制因子存在的情况下,仍会诱导分化标志物的表达和多核肌管的形成[11,22,36,39];NF-κB(仅指p50:p65复合体,下同)是被称作细胞生死开关的转录因子,它的激活对肌肉发生和肌肉降解都有作用[32];IL-6-/-小鼠卫星细胞的增殖和肌核的增加均被抑制,肌肉发育明显迟缓[30]。近年来,C2C12细胞培养发现,激活p38会诱导 NF-κB转录活性和 IL-6的上调,并且α-actin mRNA与MCK依赖性荧光酶活性也显著上升,应用NF-κB特异性抑制剂BAY11-7085降低 IL-6、α-actin mRNA及MCK依赖性荧光酶活性的水平 ,这提示 ,p38、NF-κB、IL-6三者构成肌肉发生通路[21]。目前,该通路已经引起关注,但活体研究中尚未见其相关报道[6]。p38、NF-κB、IL-6三者均对肌肉收缩敏感,长期运动对p38、NF-κB、IL-6的影响研究仍不多见 ,特别尚无专门研究涉及活体运动中三者的关系,本研究推测,p38/NF-κB/IL-6这条通路可能参与了长期运动诱导的肌肉发生过程。
在肌肉发生过程中,成肌因子 MRFs(MyoD、MyoG、MRF4、Myf-5),起着核心作用,它们在成肌辅助因子MEF2(主要是MEF2c)协同下启动肌肉特异性基因的表达。多数肌肉发生通路发挥作用需经 MRFs及 MEF2介导。目前,MRFs的研究多见于病理学研究,且多仅涉及MyoD、MyoG,运动,特别是长期运动对 MRFs的影响及其作用的研究仍不多见,MEF2的研究更是少见。
本研究采用2周大强度运动为介导,结合阻断剂,以MRFs与MEF2c及肌肉质量为肌肉发生的分子指标和生理指标,检验p38、NF-κB、IL-6三者在肌肉发生中的作用及它们之间的信号联系。本研究拟采用p38、NF-κB、IL-6逐级截断的方式检验三者联系和对肌肉发生作用,但由于实验条件所限,IL-6-/-转基因鼠难于获得和p38特异阻断剂 SB 203580非常昂贵,因此,本研究仅阻断 NF-κB,并据此展开讨论。
1 材料和方法
1.1 动物分组及运动方案
18只清洁级雄性9周龄、体重 240~280 g SD大鼠按体重分层后分为3组(尽量让各组体重波动范围相近)。自由进食,国家标准啮齿类动物常规饲料喂养。动物饲养环境温度23℃,湿度40%~60%,自然昼夜节律变化光照。C组直接执行表1方案,E、I组在正式运动前5天,进行3天适应性训练,休息2天后,执行表1方案。
1.2 取材
E、I组大鼠最后一次运动后48 h与C组一块以断颈椎方式处死,取腓肠肌,用4℃预冷的生理盐水清洗,去除血污,滤纸吸干水分,称重后切分成数段,锡箔纸包裹,做好标签,浸入液氮30 min后放入-80℃超低温冰箱冷冻待测。

表1 动物分组方案一览表Table 1 Animal Group
1.3 主要试剂及试剂盒
p38 MAPK多克隆抗体(小鼠来源,43 KD):Santa Cruz;Phospho-p38 MAPK多克隆抗体(Thr 180/Tyr 182、小鼠来源,43 KD):Santa Cruz;tubulin多克隆抗体(小鼠来源,50 KD):Cell Signal;Trizol总RNA提取试剂 :Tiangen;Biort RT-PCR assasy kit:博日生物公司 ;NF-κB assay kit:KCTM生物公司。
1.4 方法
1.4.1 Phospho-p38(Thr180/Tyr182)、p38
提取骨骼肌蛋白,BCA法定量。western blotting测定P-p38(Thr180/Tyr 182)和p38。一般步骤略。关键步骤条件:聚丙烯酰胺凝胶浓度10%;20 V稳压转移1.5 h;一抗 P-p38、p38为 1∶800、tubulin为 1∶1000;稀释 ,二抗为1∶1000。P-p38、p38蛋白表达值为条带的灰度值,以内参tubulin校正。
1.4.2 Phospho-p65(Ser237)、p65
严格按照 NF-κB elisa assay kit说明书测试 P-p65(Ser237)及p65水平(该kit通过目的/内参 GAPDH的OD比值对指标半定量)。
1.4.3 IL-6、MRFs、MEF2c mRNA
按照 Trizol Reagent液说明书提取总 RNA,总 RNA的质量和纯度检测采用变性琼脂糖凝胶电泳和紫外分光检测OD260/OD280比值,依据质量和纯度选取符合 RTPCR要求的 RNA进行逆转录反应。按照Biort RT-PCR kit说明书进行cDNA的逆转录,总 RNA经 RT反应后进行PCR扩增,采用25μl体系。PCR循环条件:1)95℃5 min;2)95℃30 s;3)(IL-6:58℃;MyoD:60℃;MyoG:62℃;Myf-5:60℃;MRF4:60℃;MEF2c:62℃)40 s;4)72℃1 min;5)go to 2,25 cycles;6)72℃10 min;7)4℃forever。PCR产物加样于 2%琼脂糖凝胶、电泳(上样量 12 μl,6×DNA loading buffer 2μl,电压 150 V,电泳 35 min)。mRNA含量为条带的OD值,以β-actin内参校正。
1.5 统计学处理
实验数据由SPSS 12.0统计软件处理,计算平均值和标准差(±S),t检验分析组间差异显著性,统计学显著性水平定为0.05。WB、PCR、ELISA结果均标准化处理。

表2 PCR引物一览表Table 2 PCR Primer Sequences and Amplicon Size
2 结果
2.1 体重、腓肠肌质量

图1 运动、NF-κB阻断对大鼠体重的影响直方图Figure 1. Effects of Trainning of NF-κB Inhibitor on Rats’Body Wet Weight

图2 运动、NF-κB阻断对大鼠腓肠肌质量的影响直方图Figure 2. Effects of Trainning of NF-κB Inhibitor on Wet Weight of Rats’Gastrocnemiuses
2.2 P-p38、p38、P-p65、p65

图3 运动对Phospho-p38、p38的影响直方图Figure 3. Effects of Trainning on Phospho-p38、p38
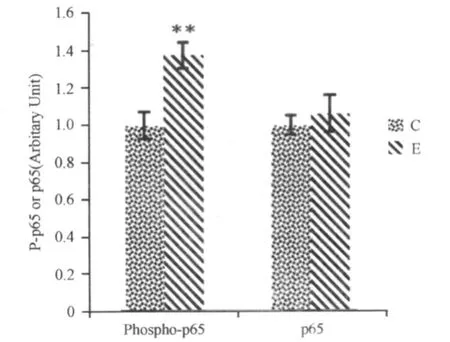
图4 运动对Phospho-p65、p65的影响直方图Figure 4. Effects of Trainning on Phospho-p65、p65
2.3 IL-6、MEF2c 、MRFs mRNA

图5 运动、NF-κB阻断对IL-6 mRNA影响直方图Figure 5. Effects of Trainning of NF-κB Inhilbtor on IL-6 mRNA

图6 运动、NF-κB阻断对MEF2c mRNA影响直方图Figure 6. Effects of Trainning and NF-κB Inhibitor on MEF2c mRNA
3 讨论
3.1 运动或NF-κB阻断对体重、腓肠肌质量的影响
本研究显示,C、E、I组大鼠体重无显著性差异,但 E、I组大鼠腓肠肌质量均高于C组,且 E组高于 I组。从能耗而言,运动大鼠体重应该较低,本研究运动没有改变体重应与运动后动物饥饿感加剧,摄食量自然增大有关。各组体重相同,而运动鼠腓肠肌质量增长,这说明腓肠肌变化不是体重变化引起的,而是机械收缩诱发局部肌肉明显发育所致,证明本运动模型符合肌肉发生的研究要求。I组腓肠肌质量低于 E组,表明NF-ΚB阻滞了肌肉发生(NFΚB作用在下文进一步讨论)。
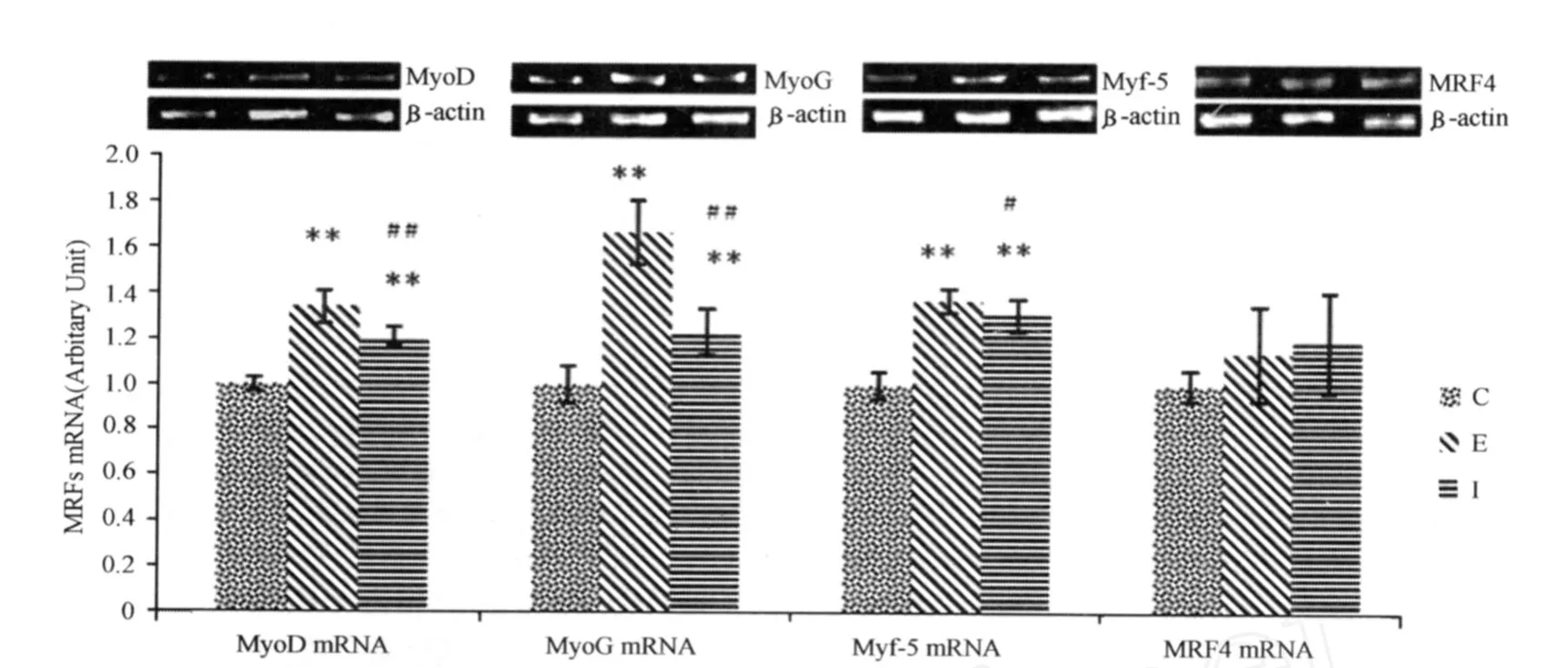
图7 运动、NF-κB阻断对MRFs mRNA影响直方图Figure 7. Effects of Trainning and NF-κB Inhibitor on MRFs mRNA
3.2 运动或 NF-κB 阻断对 P-p38、p38、P-p65、p65、IL-6 mRNA的影响
本研究显示,与 C组相比,E组 Phospho-p38(P-p38)显著性升高,但该组p38含量不变。P-p38是p38激活的标志。以往急性运动研究显示,运动后即刻或运动后较短时间内,p38一过性激活,通常24 h内完全恢复到正常水平[14,34],本研究中,P-p38在训练后48 h仍高于安静组,这说明,长期运动条件下,p38活性上调更为稳定,本研究与曹师承等(2007)[2]报道一致,该研究报道,大鼠7周游泳训练(1 h或 1.5 h/次/d、5次/周)后 48 h腓肠肌 P-p38仍然高于运动前。急性运动一般不影响p38总量[35,38],而长期运动对p38含量影响报道有差异,Ginneken(2006)[34]报道,4周游泳运动未影响大鼠肌肉p38含量,曹师承等(2007)[2]报道,两组大鼠分别以1h/次/d或1.5h/次/d游泳训练了7周,1.5h组大鼠腓肠肌p38下调,而1h组没有改变,该研究认为,p38下降可能是1.5h组的训练量过大造成了p38的分解。笔者赞同曹师承等(2007)[2]的观点,认为本研究 E组p38总量未变,可能正说明大鼠对于本运动方案可以较好适应,属于适宜训练范围,故而没有造成p38显著的分解加速。本研究p38与 P-p38变化的差异提示,运动对p38的激活与p38总体水平变化无关。
运动大鼠腓肠肌质量增加伴随着p38激活提示,p38可能参与了运动诱导的肌肉发生,这与本研究假设相符。细胞研究显示,p38促进肌肉发生可能主要通过三个途径:1)调节组蛋白重塑。p38能够磷酸化 E47(Ser140),继而促进E47-MyoD二聚体的形成,该二聚体能够靶向组蛋白重塑酶SWI/SNF及RNA聚合酶到肌肉特异性基因座,激活肌肉特异性基因转录[23];2)调控肌肉分化mRNA的更替速度[12]。成肌细胞中,p38能够磷酸化AU复函元件结合蛋白 KSRP,提高某些负责肌肉分化基因mRNA的稳定性[8,23];3)调节 MRFs及 MEF2活性或含量。p38可以直接磷酸化并增强MEF2a、2c的转录活性,也能促进Myf-5、MyoG等成肌因子及 MEF2的表达,但途径未知[8]。本研究假设,p38调控 MRFs、MEF2表达、调控肌肉发生是由 NF-κB、IL-6 介导的。
p38与NF-ΚB拥有很多共同的激活剂,如炎症因子、佛波酯、细菌、紫外线等。近年来,离体研究显示,p38激活能够加强 NF-κB的某些靶基因的表达,如 IL-6、IL-2、INOS、E-selectin等 ,p38抑制能够降低 NF-κB 活性[6,26]。这些研究结论提示,至少在某些情况下,p38是 NF-κB的上游。p38对p65的调控可能主要通过两条途径:1)诱导IκBa(NF-κB抑制剂)从NF-κB分离,允许NF-κB进入细胞核与DNA结合。2)通过CBP/P300间接的诱导p65的转激活[6]。功能上,与p38促进肌肉发生不同,NF-κB被称为生死开关,它的激活固然通常与组织炎症或损伤相联系,但是,内皮细胞发生、红细胞发生、肌细胞发生也都受它影响[25,28]。不同组织中,不同条件,NF-κB的作用都可能不同。有动物肝、肾研究显示,衰老引起 NF-κB活性上调,而长期规律运动能够逆转该趋势,其原因被认为是衰老组织的自由基及其脂质过氧化物的积累、抗氧化剂含量和功能降低使得 ROS增高,继而激活 NF-κB,NF-κB核转位诱导炎症相关基因的表达,引起了DNA突变、蛋白质变性,加速了细胞损伤、坏死或凋亡,而规律性的运动缓解了自由基的积累,改善了抗氧化剂功能,ROS水平降低,因此NF-κB活性下降[1,29]。在骨骼肌,NF-κB的变化和功能情况有所不同,Song(2006)[32]报道,衰老会降低大鼠腓肠肌质量、NF-κB活性和Bcl2/Bax比值,而规律的运动(12周跑台)缓解、逆转了上述指标变化趋势,该研究提示,骨骼肌中NF-κB的激活可通过某些途径,如抗凋亡基因Bcl2的转录,促进细胞的存活。为何不同组织中,NF-κB的变化和作用均有不同?Spangenburg(2006)[33]认为,肝、肾是有丝分裂组织,而骨骼肌是有丝分裂后组织,在有丝分裂组织中,细胞处于不断增殖、分化的活跃状态,NF-κB的职责主要是促进细胞的死亡,让细胞尽快更替,保证组织不过度发育,避免癌变,而衰老使得 NF-κB的活性不受控制的过分升高,造成细胞死伤过快,运动提高了对 NF-κB的控制能力,终末分化组织中(如骨骼肌),其本身能够用于补充、更新的干细胞库较小,而且转化效率也相对低下,因此,细胞自身要有较高存活能力来维护组织的完整性,否则组织很快会萎缩,因此,这类细胞 NF-κB激活的主要作用是促进细胞生存和发育,衰老使得 NF-κB活性降低,细胞促生存、发育的能力受损,而运动会缓解、逆转NF-κB下降趋势来尽量保持组织的完整性。
本研究显示,E组大鼠 Phospho-p65(P-p65)上调、p65不变。NF-κB与p38有所不同,作为转录因子,NF-κB的活性通常指NF-κB DNA结合活性,但 EMSA测试条件及成本要求较高,已知 NF-κB的激活伴随p65的磷酸化,因此也有不少研究以 P-p65来标志 NF-κB的活性。尽管两种指标变化并不完全一致,但整体趋势近似[7,9,15]。结果提示,长期运动提高 NF-κB的活性,但其活性变化并非由p65含量改变所致,这一点与p38情况相同。本研究中,NF-κB激活伴随肌肉质量的增长(E组大鼠腓肠肌质量上升),NF-κB阻断引起肌肉质量下降(I组腓肠肌质量小于E组)明确表明,NF-κB激活在长期运动介导下的作用是促进肌肉组织存活和生长的。可见,尽管研究角度不同(促肌肉发生VS降低细胞凋亡),但本研究在 NF-κB的促进肌肉组织生存、维持方面作用的认识与上述 Song(2006)[32]研究一致。然而,无可置疑的是,NF-κB激活是肌肉萎缩类疾病共同特征,并且也有一些运动研究显示,运动激活肌肉中NF-κB继而引起炎症的级联放大效应,加重肌肉损伤、引起肌肉降解、质量流失[17,18,20],这与我们提出的NF-κB促进肌肉生长、发育的作用似乎矛盾,但需要指出,这些运动研究采用的多是对肌肉组织损伤较大的离心运动模型[9,10],而众所周知的是,急性损伤与萎缩类疾病的肌肉组织处于炎症状态,本研究则不同,采用的是肌肉伤害较少、不会引起明显炎症反应的上坡跑台运动(向心运动为主),结果的差异提示,不同条件下,骨骼肌中NF-κB处于不同的信号通路中,向心运动中NF-κB承继生长信号(如p38等),并选择性启动促进细胞生长、维持的基因的转录,病理状态 NF-κB则承继的是炎症信号(如TNFα等),选择性启动促炎症、促凋亡的基因的转录,该问题有待进一步证实,如果确实如此,则 NF-κB靶基因的选择调节机制也是个重要问题。当然,p38、NF-κB在活体的关系研究仍需要通过p38激动剂或抑制剂来验证。
分子生物学研究已经确认,NF-κB本身并不能直接调控肌肉特异性蛋白或 MRFs表达,因此,它对肌肉生长的调节应该存在其他分子的介导,NF-κB的靶基因IL-6可能是介导分子之一。IL-6是一种组织中普遍存在的糖基化蛋白,安静时骨骼肌 IL-6含量很低,运动时,骨骼肌 IL-6迅速生成并释放入血,成为循环血IL-6的最大来源[4]。功能上,IL-6最初被认为是与IL-1等作用类似的炎症因子,但是近来已经证明,IL-6与炎症关联并不密切[5]。IL-6对多种细胞发生有影响,它可促进造血干细胞的增殖、B细胞的分化与成熟、T细胞的增殖与分化、肝细胞分化、神经细胞的分化、神经胶质细胞的增生,肌肉发生中,它的作用也很重要,IL-6-/-小鼠肌肉发育迟缓[30],施加 IL-6的小鼠成肌细胞C2C12的α-actin mRNA、MCK依赖性荧光酶活性明显上调[6],但是它调控肌肉发生的机制仍不得而知,笔者推测可能与MRFs、MEF2有关。
与p38或 NF-κB相比,IL-6对肌肉收缩刺激更为敏感,有报道,高强度急性运动后,大鼠肌肉中 IL-6 mRNA上调100倍[27],长期运动对 IL-6报道极少,仅见 Fischer(2004)[13]曾报道“10周耐力训练没有改变人体骨骼肌 IL-6 mRNA水平”,本研究与此结果一致,即 E组、I组的 IL-6 mRNA水平均未改变,这说明长期运动与NF-κB阻断都未影响IL-6的基因表达,显然,该结果与我们最初假设相悖,提示,IL-6未参与长期运动诱导的肌肉发生过程,也不是p38/NF-κB的信号的下游。当然,IL-6 mRNA与 IL-6的动力学关系可能不完全一致,且本研究结果也不能代表所有运动类型,因而此结论仍需要谨慎对待。
3.3 运动或 NF-κB阻断对 MEF2c、MRFs mRNA的影响
MRFs是肌肉发生的核心调控因子,有 MyoD、MyoG、Myf-5、MRF4四个成员。它们在 MEF2(主要是 MEF2c)和 E蛋白协同下激活肌肉特异性基因(如α-actin、烟碱乙酰胆碱受体、β-原肌球蛋白、MHC、结蛋白、肌钙蛋白 C、CK、MCK等)转录,促进肌肉组织生长和更替。MRFs总体水平低下是多种慢性肌肉萎缩类症状的共同特征,肌肉肥大也通常伴随某些MRFs的上调[16]。MRFs表达具有一定时空特征,时间上,Myf-5、MyoD在卫星细胞激活、增殖生成成肌细胞过程中开始上调,而MRF4与MyoG在成肌细胞分化为肌管期开始上调,分布上,MyoD高表达于快肌,MyoG高表达于慢肌。功能上,MRFs成员各自特点和差异目前并未完全研究透彻,特别是相对于 MyoD、MyoG而言,人们对 Myf-5、MRF4特点的认识还不够,很多研究提出,MyoD、Myf-5引导肌肉干细胞增殖,而 MRF4、MyoG则引导分化[24];也有一些意见认为,MyoD与MRF4均参与肌肉干细胞的增殖与分化[16,37],此外,MyoD与MyoG被认为是肌肉表型塑造的关键因子——MyoD促进 MHC IIb、X及某些酵解酶基因转录,促进快肌发育,MyoG促进MHC I、IIa和某些氧化酶基因转录,促进慢肌生长,二者变化分别与快、慢肌量变化一致,二者比例变化也被认为是快慢肌相互转化的有效指标[3]。
本研究显示,与C组相比,E组MRF4(不变)外的所有MRFs成员及 MEF2c mRNA均上调。显然,不论上述对MRFs成员功能的哪种看法正确,本结果都可以说明,长期运动诱导下,肌肉干细胞增殖和分化均处于活跃期。MRF4 mRNA没有上调迹象可能是因为功能与它近似的MyoG上调已经可以满足细胞分化需求,此外,MRF4上调能够加速 MyoD的分解[19],因此 MRF4的不变也能保证MyoD功能顺利的发挥。MEF2c mRNA的上调与MRFs mRNA上调匹配,辅助 MRFs调节基因的转录。MyoG、MyoD mRNA的共同上调提示快、慢肌均有所增长,此特征与本研究采用的运动方式一致,因为本研究采用的长期大强度方案,确切来说是长期(2周)、长时间(1 h/次)、大强度(27 m/min)的训练方式,大强度肌肉收缩主要刺激快肌发育,长时间运动主要发展慢肌,长期训练作用一般是稳定指标变化趋势。
进一步对指标变化幅度进行观察,可以发现,E组MyoGmRNA上调幅度大于 MyoD,表明慢肌可能增长较快,这意味着本训练模式导致肌肉类型整体上发生快-慢的转换(MyoD mRNA/MyoGmRNA降低)。与本研究不同,8周大强度跑台训练后,大鼠肌肉中MyoGmRNA和蛋白水平的升高伴随着CS,COX II和COX VI mRNA的升高,但MyoD mRNA和蛋白水平均没有变化[31]。笔者认为,MyoD变化差异可能是所在训练不同阶段所致,本研究采用2周训练,对于大鼠而言,这个时段可能处于训练初期的肌肉发育的快速增长期,因此,MyoG和MyoD均上调来满足快、慢肌生长的需要。而8周训练使大鼠机体逐渐适应了负荷后,无氧阈提高,无氧性质刺激反应降低,有氧刺激比例加大,因此,MyoD的上调及快肌生长逐渐停滞,而MyoG仍然处于高水平,这符合长期耐力训练主要发展慢肌纤维工作能力的规律。
苏艳红(2007)[3]报道,大鼠低强度耐力训练28天后,后浅层胫前肌MyoD、MyoGmRNA均显著下降。一般而言,这类中小强度运动对利于动物肌肉量的保持,起码对于慢肌的生存、发育是有益的,因此至少MyoGmRNA不应下调,笔者尚不能解释此问题,这有待进一步调查,这也说明,MRFs的控制非常复杂。
本研究发现,NF-κB的阻断对 MRFs及 MEF2c mRNA表达均有作用,即与 E组相比,I组 MyoD、MyoG、Myf-5、MEF2c mRNA均降低。这些指标降低与 I组肌肉增长阻滞一致。本研究也发现,MRF4 mRNA不变。结果提示,MyoD、MyoG、Myf-5、MEF2c基因表达可能是 NF-κB 依赖性的。由于NF-κB不能直接影响 MRFs或 MEF2基因表达,下一步需要研究的是沟通 NF-κB与 MRFs、MEF2c的基因表达的中介分子为何。对MRFs变化幅度进一步分析发现,与 E组相比,I组 MyoGmRNA下降幅度高于MyoD,提示 I组大鼠肌肉发生程度的降低及慢-快肌的转化(MyoD mRNA/MyoGmRNA升高),此特征与我们已知的“肌肉发育障碍、萎缩时,慢肌将向快肌转化,最大限度保证肌肉维持一定活动能力”一致,也提示 NF-κB对MyoG影响可能大于MyoD。
4 结论
长期大强度运动后,腓肠肌的质量、p38活性、NF-κB活性、MyoD mRNA、MyoD mRNA、Myf-5 mRNA、MEF2c mRNA上升,且MyoD mRNA上升幅度小于 MyoG,而 IL-6 mRNA、MRF4 mRNA未变。NF-κB阻断降低了腓肠肌的质量、MyoD、MyoG、Myf-5、MEF2c mRNA,且 MyoD 下降幅度小于MyoG,而 IL-6 mRNA、MRF4 mRNA未受影响。本研究提示 ,p38/NF-κB/MyoD、MyoG、Myf-5、MEF2c介导了运动诱发的肌肉发生,但 IL-6可能没有参与其中;长期、长时间、大强度刺激下,快、慢肌均有增长,慢肌增长幅度较大,肌肉总体类型仍将发生快-慢的转化;NF-κB阻断后,快、慢肌生长均受抑制,但慢肌受影响更大,肌肉类型发生慢-快的转化。
限于本研究的条件,一些问题仍难于避免,笔者认为有些问题需要注意:1)活体中,特别是运动条件下,p38对NF-κB作用需要进一步证实;2)谨慎看待“IL-6不是p38/NF-κB/下游,及它没有参与长期运动诱导肌肉发生的过程”的结论,未来研究需要确认长期运动对 IL-6水平的影响;3)调查 NF-κB如何调控 MRFs、MEF2c基因表达;4)转录因子MRFs、MEF2c的mRNA或蛋白水平均非最佳衡量其功能最佳指标,未来应该考虑检测它们的DNA结合活性。
[1]鲍国强,章扬培.NF-κB的生物学功能[J].国外医学:分子生物学分册,2003,25(6):345-348.
[2]曹师承,孙黎光,叶丽平.运动对大鼠骨骼肌p38活性的影响[J].中国医科大学学报,2007,36(2):131-132.
[3]苏艳红,王瑞元,林华.耐力训练对肌球蛋白重链的影响及MyoD,Myogenin的调控作用[J].体育学刊,2007,29(2):106-112.
[4]唐晖,谢敏豪.运动引起肌源性 IL-6分泌的研究进展[J].中国运动医学杂志,2006,25(1):60-64.
[5]王今越,丁树哲,刘伟,等.运动与 IL-6的研究进展[J].体育科学,2007,27(6):60-69.
[6]BAEZA RAJA B,MUNOZ CANOVES P.p38 MAPK-induced nuclear factor-κB activity is required for skeletal muscle differentiation:role of interleukin-6[J].Mol Biol Cell,2004,15(4):2013-2026.
[7]BAR SHAI M,CARMELI E,REZNICKAZ.The role of nF-kappaB in protein breakdown in immobilization,aging,and exercise:from basic processes to promotion of health[J].Ann N Y Acad Sci,2005,1057(5):431-447.
[8]BRIATA P,FORCALES S,PONASSI M,et al.p38-dependent phosphorylation of the mRNA decay-promoting factor KSRP controls the stability of select myogenic transcripts[J].Mol Cell,2005,20(6):891-903.
[9]CAI D,FRANTZ J D,TAWA N E,et al.IKKbeta/NF-kappaB activation causes severe muscle wasting in mice[J].Cell,2004,119(2):285-298.
[10]CHIANGJ,SHEN Y C,WANGY H,et al.Honokiol protects rats against eccentric exercise-induced skeletal muscle damage by inhibiting NF-kappaB induced oxidative stress and inflammation[J].Eur J Pharmacol,2009,154(2):182-199.
[11]CUENDA A,COHEN P.Stress-activated protein kinase-2/p38 and a rapamycin-sensitive pathway are required for C2C12 myogenesis[J].J Biol Chem,1999,274(7):4341-4346.
[12]CUENDA A,ROUSSEAU S.p 38 MAP-Kinases pathway regulation,function and role in human diseases.Biochimica et biophysica acta[J].Mol Cell Res,2007,1773(8):1358-1375.
[13]FISCHER C P,PLOMGAARD P,HANSEN A K,et al.Endurance training reduces the contraction-induced interleukin-6 mRNA expression in human skeletal muscle[J].Am J Physiol Endocrinol Metab,2004,287(6):1189-1194.
[14]GIBALAM,MCGEE S,GARNHAM A,et al.Brief intense interval exercise activates AMPKand p38 MAPKsignaling and increases the expression of PGC-1{alpha}in human skeletal muscle[J].J Appl Physiol,2009,106(3):929-942.
[15]HAYDEN M.NF-kB and the immune response[J].Oncogene,2006,51(12):6758-6788.
[16]HENNEBRY A,BERRY C,SIRIETT V,et al.Myostatin regulates fiber-type composition of skeletal muscle by regulating MEF2 and MyoD gene expression[J].AmJ Physiol Cell Physiol,2009,296(3):525-541.
[17]J I L L,GOMEZ CABRERAM C,STEINHAFEL N,et al.A-cute exercise activates nuclear factor(NF)-kappaB signaling pathway in rat skeletal muscle[J].FASEB J,2004,18(13):1499-1506.
[18]J IMENEZJIMENEZ R,CUEVAS M J,ALMAR M,et al.Eccentric training impairs NF-kappaB activation and over-expression of inflammation-related genes induced by acute eccentric exercise in the elderly[J].Mech Ageing Dev,2008,129(6):313-321.
[19]J IN X,KIM J G,OH M J,et al.Opposite roles of MRF4 and MyoD in cell proliferation and myogenic differentiation[J].Biochem Biophys Res Commun,2007,364(3):476-482.
[20]KRAMER H F,GOODYEAR L J.Exercise,MAPK,and NF-kappaB signaling in skeletal muscle[J].J Appl Physiol,2007,103(1):388-395.
[21]LE GRAND F,RUDNICKI M A.Skeletal muscle satellite cells and adult myogenesis[J].Curr Opin Cell Biol,2007,19(6):628-633.
[22]LI Y,J IANGB,ENSIGN W Y,et al.Myogenic differentiation requires signalling through both phosphatidylinositol 3-kinase and p38 MAP kinase[J].Cell Signal,2000,12(11):751-757.
[23]LLUÍS F,PERDIGUERO E,NEBREDA A,et al.Regulation of skeletal muscle gene expression by p38 MAP kinases[J].Trends Cell Biol,2006,16(1):36-44.
[24]MCCARTHYJ J,ESSER KA.Counterpoint:Satellite cell addition is not obligatory for skeletal muscle hypertrophy[J].Am Physiol Soc,2007,181(2):36-44.
[25]MOURKIOTI F,ROSENTHAL.NF-kappaB signaling in skeletal muscle:prospects for intervention in muscle diseases[J].J Mol Med,2008,86(7):747-759.
[26]OSAWA Y,IHO S,TAKAUJI R,et al.Collaborative action of NF-B and p38 MAPKis involved in CpGDNA-induced IFN-and chemokine production in human plasmacytoid dendritic cells[J].Immunol,2006,177(19):350-366.
[27]PEDERSEN B K,STEENSBERGA,FISCHER C,et al.The metabolic role of IL-6 produced during exercise:is IL-6 an exercise factor[J].Proc Nutr Soc,2004,63(2):263-267.
[28]PETERSON J M,GUTTRIDGE D C.Skeletal muscle diseases,inflammation,and NF-kappaB signaling:insights and opportunities for therapeutic intervention[J].Int Rev Immunol,2008,27(5):375-387.
[29]RADAKZ,CHUNGH Y,NAITO H,et al.Age-associated increase in oxidative stress and nuclear factor kappaB activation are attenuated in rat liver by regular exercise[J].Faseb J,2004,18(6):749-750.
[30]SERRANO A,BAEZA RAJA B,PERDIGUERO E,et al.Interleukin-6 is an essential regulator of satellite cell-mediated skeletal muscle hypertrophy[J].Cell Metabolism,2008,7(1):33-44.
[31]SIU P M,DONLEY D A,BRYNER R W,et al.Myogenin and oxidative enzyme gene expression levels are elevated in rat soleus muscles after endurance training[J].J Appl Physiol,2004,97(1):277-285.
[32]SONGW,KWAKH B,LAWLER J M.Exercise training attenuates age-induced changes in apoptotic signaling in rat skeletal muscle[J].Antioxid Redox Signal,2006,8(3):517-528.
[33]SPANGENBURGE,MCBRIDE T.Distinct roles of lkappaB proteins in regulating constitutive NF-kappaB activity[J].J Appl Physiol,2006,100(1):129-135.
[34]VAN GINNEKEN M,DE GRAAF ROELFSEMA E,KEIZER H,et al.Effect of exercise on activation of the p38 mitogen-activated protein kinase pathway,c-Jun NH2 terminal kinase,and heat shock protein 27 in equine skeletal muscle[J].Am J Vet Res,2006,67(5):837-844.
[35]WIDEGREN U,JIANGX J,KROOKA,et al.Divergent effects of exercise on metabolic and mitogenic signaling pathways in human skeletal muscle[J].Faseb J,1998,12(13):1379-1389.
[36]WU Z,WOODRINGP J,BHAKTA KS,et al.p38 and extracellular signal-regulated kinases regulate the myogenic program at multiple steps[J].Mol Cell Biol,2000,20(11):3951-3964.
[37]YOSHIDA T.MCAT elements and the TEF-1 family of transcription factors in muscle development and disease[J].Arterioscler Thromb Vasc Biol,2008,28(1):806-827.
[38]YU M,BLOMSTRAND E,CHIBALIN A,et al.Marathon running increases ERK1/2 and p38 MAP kinase signalling to downstream targets in human skeletal muscle[J].J Physiol,2001,536(1):273-282.
[39]ZETSER A,GREDINGER E,BENGAL E.p38 mitogen-activated protein kinase pathway promotes skeletal muscle differentiation.Participation of the Mef2c transcription factor[J].J Biol Chem,1999,274(8):5193-5200.
Effect of p38,NF-κB,IL-6 on Long-term High Intensity Exercise Induced Myogenesis
WANGJin-yue1,DIN GShu-zhe2,WANGXiao-hong3,CHEN Min-sheng4,YANGHai-dong5
Objective:To explore the function of p38,NF-κB,IL-6 in exercise induced myogenesis.Methods:18 male SD rats were divided into 3 groups,C group(quiet group),E group(2 wk exercise),and I group(2 wk exercise with PDTC).Detect weight,p38,Phospho-p38,p65,Phospho-p65,IL-6 mRNA,MRFs mRNA,MEF2c mRNA of C and E group rats’gastrocnemiuses,and weight,IL-6 mRNA,MRFs mRNA,MEF2c mRNA of I group rats’gastrocnemiuses.Results:Compared with C group,gastrocnemius,weight,Phospho-p38,Phosphop65,MyoD mRNA,MyoGmRNA,Myf-5 mRNA,and MEF2c mRNA increased but p38,NF-κB,IL-6 mRNA,MRF4 mRNA unchanged in E group.Compared with E group,gastrocnemius weight,MyoD mRNA,Myo GmRNA,Myf-5 mRNA,MEF2c mRNA decreased but IL-6 mRNA and MRF4 mRNA unchanged in I group.Conclutions:p38/NF-κB/MyoD,MyoG,Myf-5,MEF2c may facilitate exercise-induced myogenesis but IL-6 doesn’t involve in.
Long-term high intensity exercise;p38;N F-κB;IL-6;Myogenesis
G804.7
A
1000-677X(2010)02-0075-08
2009-09-09;
2010-01-10
上海市2007年度浦江人才计划(44038470);教育部2007年度新世纪优秀人才支持计划(790013P8);吉林省2007年体育局课题(2007D11)。
王今越(1978-),男,满族,吉林长春人,讲师,博士,主要研究方向为运动适应和机能评定,E-mail:wjytnt@tom.com。
1.佛山大学体育学院,广东佛山528000;2.华东师范大学体育与健康学院,上海 200062;3.东北师范大学体育学院,吉林长春130026;4.深圳大学 体育部,广东深圳518060;5.东北大学体育部,辽宁沈阳110819
1.Foshan University,Foshan 528000,China;2.East ChinaNormalUniversity,Shanghai200062,China;3.Northeast Normal University,Changchun 130026,China;4.Shenzhen University,Shenzhen 518060,China;5.Northeastern University,Shenyang 110819,China.
