金葡菌对高糖状态下THP-1人单核细胞表达iNOS和IL-1β的影响*
2010-11-28王宝利邓为民
陈 樱 孟 东 孙 培 王宝利 邓为民 姚 智
糖尿病细菌感染一直是困扰糖尿病患者和广大医生的难题,虽然有大量广谱抗生素应用于临床,但感染的发生率仍呈增高的趋势,感染引起的糖尿病患者死亡仍占较高比例[1]。研究表明,糖尿病高血糖可以影响单核细胞的趋化、黏附作用[2-3],促进细胞调亡。本研究旨在探讨高糖状态下,金黄色葡萄球菌(金葡菌)对THP-1人单核细胞表达诱导型一氧化氮合酶(iNOS)和白细胞介素(IL)-1β的影响,以期从细胞免疫学角度了解糖尿病患者感染的发病机制。
1 材料与方法
1.1 材料 (1)单核细胞和培养试剂:人单核细胞株THP-1购自北京协和医学院。RPMI1640培养液为美国GIBCO公司产品,胎牛血清(FBS)为美国Hyclone公司产品。(2)菌种和调理素:金葡菌标准菌26001株(天津市金章科技发展有限公司),普通培养基37℃培养18 h。挑取单个菌落,用生理盐水将标准菌株制成约1.5×108CFU/mL(CFU:集落形成单位)细菌悬液,使用新鲜人混合血清调理1.5 h备用。(3)iNOS、IL-1β表达测定用试剂:TRIzol总RNA分离试剂购自美国Promega公司;RT-PCR试剂盒为美国LIFE TECHNOLOGIES公司产品。
1.2 方法
1.2.1 实验分组 PRMI1640培基体外培养单核细胞株THP-1,采用 2×2析因分析实验设计,以高糖(A)、细菌(B)2个因素,每个因素2个水平交叉分为4组,分别为对照组(5.5 mmol/L葡萄糖)、高糖组(25.0 mmol/L葡萄糖)、细菌组(1.5×107CFU/mL金葡菌+5.5 mmol/L葡萄糖)和高糖细菌组(1.5×107CFU/mL金葡菌+25.0 mmol/L葡萄糖)。分组细胞首先以上述2种浓度的葡萄糖培养72 h,再移至六孔培养板,同时细菌组和高糖细菌组加入金葡菌,调整细胞/细菌比例为1∶15,置37℃,270 r/min振荡孵育1.5 h。测定iNOS和IL-1β的表达情况。
1.2.2 iNOS表达测定 用TRIzol总RNA分离试剂提取细胞RNA,用半定量逆转录聚合酶链反应(SQ-RT-PCR)法检测iNOS表达。引物:上游5′-CCAGCTAGCCAAAGTCACCA T-3′,下游 5′-GTCTCGGAGCCATACAGGATT-3′,扩增片段长 354 bp;GAPDH: 上游 5′-AGTCCACTGGCGTCTTCAC-3′,下游 5′-TGATCTTGAGGCTGTTGTC-3′,扩增片段长 240 bp。iNOS表达产物电泳结果采用GeneSnap凝胶图像采集分析系统(SynGene公司产品)拍照,对凝胶中的特异性条带进行扫描,用凝胶图像分析软件分析,测定其相对光密度,计算各因子与GAPDH的光密度比值作为半定量指标。iNOS基因的PCR扩增条件:94℃预变性5 min,94℃变性30 s,62℃退火30 s,72℃延伸30 s,共35个循环,72℃10 min。
1.2.3 IL-1β 表达测定 IL-1β 引物:上游5′-CATCCAGCT TCAAATCTCAC-3′,下游 5′-ACCACTTGTTGGCTTATGTT-3′,扩增片段长333 bp。IL-1β基因PCR扩增条件:94℃预变性 5 min,94℃变性 30 s,50℃退火 30 s,72℃延伸 30 s,共35个循环,72℃10 min。GAPDH和反应产物分析同1.2.2。
2 结果
2.1 单变量多因素方差分析结果 高糖和细菌及两者交互效应均影响THP-1人单核细胞表达iNOS和 IL-1β,见表1、2。
2.2 单因素方差分析结果 4组组间iNOS、IL-1β表达水平比较差异均有统计学意义(F分别为49.87、44.63,均P<0.01)。组间的多重比较结果显示,高糖组与对照组相比细胞表达iNOS和IL-1β均减弱;细菌组与对照组比较iNOS和IL-1β表达均增高;与高糖组比较,高糖细菌组IL-1β表达增高,iNOS表达变化不明显,见表1、3。
表1 金葡菌对高糖状态下THP-1人单核细胞表达iNOS和 IL-1β 的影响 (n=5,±s)

表1 金葡菌对高糖状态下THP-1人单核细胞表达iNOS和 IL-1β 的影响 (n=5,±s)
分组对照组高糖组细菌组高糖细菌组iNOS mRNA/GAPDH 0.645±0.157 0.295±0.085 1.328±0.216 0.377±0.089 IL-1β mRNA/GAPDH 1.154±0.150 0.450±0.082 1.358±0.161 1.048±0.147

表2 多因素方差分析结果
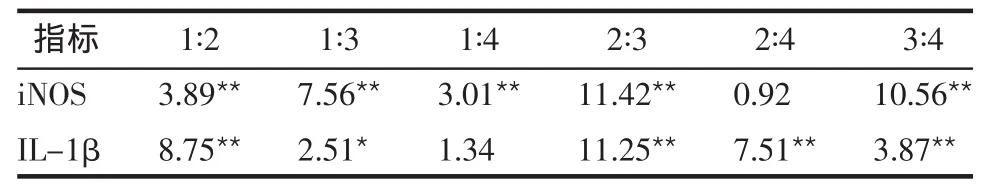
表3 单因素方差分析组间多重比较的q值
3 讨论
严重感染是糖尿病患者死亡的重要原因之一[4]。糖尿病患者由于血糖升高,蛋白代谢紊乱,免疫功能低下,抵抗力降低等因素,极易造成各类感染,其中呼吸系统、泌尿系统、胆道及皮肤软组织的感染率分别是非糖尿病患者的2~5倍[1]。且糖尿病患者在高血糖状态下,感染往往不易控制[5]。因此,研究高糖状态下免疫细胞的功能有助于了解糖尿病感染的机制。
iNOS是单核细胞产生一氧化氮(NO)的主要限速酶。NO是体内重要的生物活性分子和信号分子。正常情况下,单核细胞释放的NO具有重要的保护机体的作用。笔者先前研究表明,高糖可以抑制内皮细胞表达内皮型一氧化氮合酶(eNOS)[6]。IL-1β是一个多效性促炎细胞因子,可由巨噬细胞、内皮细胞、平滑肌细胞和成纤维细胞等产生,能促进内皮细胞合成、表达细胞间黏附分子(ICAM)-1和血管细胞黏附分子(VCAM)-1,诱导内皮细胞释放血小板衍生生长因子(PDGF)、碱性成纤维细胞生长因子(bFGF)等促有丝分裂素,同时促进多形核白细胞与内皮细胞黏附并协同其刺激内皮细胞合成和释放PDGF和bFGF,诱导细胞外基质蛋白及基质金属蛋白酶的产生,调节干扰素(IFN)γ产量等[7]。IL-1β的表达在感染损伤后的炎症反应和平滑肌细胞激活、移行、增殖的各个阶段都起着很重要的作用。
细菌能够刺激细胞产生促炎反应因子IL-1β和TNF-α,并减弱吞噬细胞活性[8]。细菌脂多糖可以通过激活caspase-1诱导THP-1细胞释放IL-1β[9]。金黄色葡萄球菌是糖尿病感染常见致病菌,金葡溶血素α和杀白细胞素可损伤或杀死单核巨噬细胞和粒细胞。本研究显示,高糖和金葡菌及二者交互效应均可影响THP-1人单核细胞表达iNOS和IL-1β。高糖使iNOS和IL-1β表达减弱,细菌感染作为独立因素可使两指标表达增强;但高糖和细菌感染同时存在时,仅IL-1β表达增强,iNOS表达变化不显著,提示糖尿病感染患者免疫功能降低与高糖状态下免疫细胞表达iNOS和IL-1β减弱有关。因此,从改善糖尿病患者细胞免疫功能的角度来讲,控制患者的血糖就显得尤为重要。同时,改善患者免疫细胞功能在一定程度上能控制和减少糖尿病感染的发生。
[1]许曼音.糖尿病学[M].上海:上海科学技术出版社,2003:533-541.
[2]Cipollone F,Chiarelli F,Iezzi A,et al.Relationship between reduced BCL-2 expression in circulating mononuclear cells and early nephropathy in type 1 diabetes[J].Int J Immunopathol Pharmacol,2005,18(4):625.
[3]Vogl-Willis CA,Edwards IJ.High glucose-induced alterations in subendothelial matrix perlecan leads to increased monocyte binding[J].Arterioscler Thromb Vasc Biol,2004,24(5):858.
[4]贺东风,吴松华.糖尿病感染因素分析[J].上海预防医学杂志,2003,15(8):406.
[5]张华平,曾奕明,叶虹虹.糖尿病并发感染及其危险因素分析[J].中国综合临床,2002,18(9):809.
[6]孟东,陈樱,刘德敏,等.高糖对人脐静脉内皮细胞凋亡及bclx、bax 和 eNOS 表达的影响[J].天津医药,2005,33(6):335-337.
[7]Raices RM,Kannan Y,Sarkar A.A synergistic role for IL-1beta and TNFalpha in monocyte-derived IFNgamma inducing activity[J].Cytokine,2008,44(2):234-241.
[8]Ciabattini A,Cuppone AM,Pulimeno R,et al.Stimulation of human monocytes with the gram-positive vaccine vector Streptococcus gordonii[J].Clin Vaccine Immunol,2006,13(9):1037.
[9]Kuijk LM,Mandey SH,Schellens I,et al.Statin synergizes with LPS to induce IL-1beta release by THP-1 cells through activation of caspase-1[J].Mol Immunol,2008,45(8):2158-2165.
