人绒毛膜促性腺激素对人PBMC产生MIF的影响*
2010-11-28邢冬红赵谨莹肖振霞李会强
邢冬红 赵谨莹 肖振霞 李会强 白 虹
人绒毛膜促性腺激素(hCG)是妊娠期间由胎盘滋养层细胞分泌的一种糖蛋白激素。除了具有刺激黄体分泌孕酮以维持妊娠的功能外,hCG还具有一定的免疫调节功能。巨噬细胞移动抑制因子(MIF)属于促炎症细胞因子,它是一个多效性分子,有很多分子参与并介导其功能的表达。目前已知MIF参与多种生理生化过程,如:炎症、免疫应答、细胞增殖、血管生成和肿瘤形成等过程[1]。但有关MIF在妊娠期间的合成、分泌、分布以及功能表达还鲜有报道。hCG影响多种细胞因子的转录和表达[2]。本文利用荧光定量PCR方法,探讨hCG对外周血单核细胞(PBMC)中MIF mRNA转录的影响,为阐明hCG对细胞因子调节作用的机制,解释hCG在生理及某些病理过程中的调节作用提供实验依据。
1 材料与方法
1.1 材料 于2007年1月采自天津市血液中心健康献血者新鲜外周血,用淋巴细胞分离液(购自中国医学科学院血液病学研究所)分离获得人PBMC,细胞计数后悬浮于含15%小牛血清RPMI 1640(Gibco)的培养液中。ABI 7000荧光定量PCR 仪(ABI公司,美国),重组hCG(r-hCG)(10 000 U/mL)购自天津鼎天生物技术有限公司,细胞培养液RPMI 1640(Gibco公司),细菌脂多糖(LPS)购自Sigma公司,反转录系统试剂盒(PROMEGA公司,美国),荧光定量PCR试剂盒(TaKaRa生物工程有限公司)。
1.2 方法
1.2.1 引物的设计与合成 MIF引物:上游5′-GCCCGGACAG GGTCTACA-3′,下游 3′-CTTAGGCGAAGGTGGAGTTGTT-5′;合成产物322 bp。β-actin 引物:上游 5′-CCCAAGGCCAA CCGCGAGAAGAT-3′,下游 3′-GTCCCGGCCAGCCAGGTCCA G-5′;合成产物219 bp。均由上海生工生物技术服务有限公司设计并合成。
1.2.2 人PBMC的分离 参考文献[3]分离人PBMC。
1.2.3 不同浓度r-hCG对MIF mRNA转录的影响 将上述PBMC悬液分成5组,每组分别加入100 IU/mL、10 IU/mL、1 IU/mL、0.1 IU/mL和0 IU/mL的r-hCG,每组3孔,每孔细胞浓度1×106/mL,每孔再加入2 μg/mL LPS激活细胞,混匀后于37℃,5%CO2条件下培养2 h,取出后1 500 r/min离心10 min,并提取沉淀细胞RNA。
1.2.4 r-hCG作用不同时间对MIFmRNA转录的影响 将上述PBMC悬液分成7组,每组3孔,每孔1 mL含1×106细胞,每孔分别加入 LPS(2 μg/mL)和 r-hCG(100 IU/mL)刺激细胞,混匀后 37 ℃,5%CO2条件下培养,分别于 0、0.5、1、2、4、8、16 h收获细胞并提取RNA。
1.2.5 RNA提取 严格按试剂盒说明书进行。提取的RNA经电泳证实呈现两条清晰锐利的18 S和28 S条带,紫外分光光度计测定其260/280 nm比值为1.7~2.0。
1.2.6 逆转录(RT)合成cDNA 逆转录体系总体积20 μL:总RNA1 μL,dNTP(10 mmol)2 μL,AMV1 μL,Oligo dT(2.5×10-6mol/L)1 μL,RNA 酶抑制剂 0.5 μL,MgCl2(25 mmol)4 μL,10×Buffer2 μL,去 RNA 酶水 8.5 μL.RT 条件为 55 ℃30 min,99℃ 5 min,5℃ 5 min。保存cDNA于-20℃ 冰箱,以备后续荧光定量PCR用。
1.2.7 荧光定量PCR检测 PBMC中MIF mRNA转录水平按试剂盒说明书配制25 μL PCR扩增反应体系:12.5 μL SYBR Green 混合物(×2),0.2 μL cDNA,1 μL 引物混合物(5 ×10-6mol/L),11.3 μL H2O。PCR 反应条件:50 ℃ 2 min,95 ℃10 min,95℃15s,60℃30s,72℃30s,40个循环后再以 72℃10 min,1循环。反应结束后,采用ABI prism 7000 sds荧光定量PCR分析系统分析裂解曲线。
1.3 统计学分析 采用SPSS 15.0统计软件分析所得数据,数据用均数±标准差(±s)表示,数据用t检验进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度r-hCG对LPS诱导人PBMC中MIF mRNA转录的影响 在实验浓度范围内,含有一定浓度r-hCG的实验组与不含r-hCG的对照组相比,MIF mRNA的转录水平差异有统计学意义(均P<0.05),见表1。 拟合回归方程Y赞=e(1.005+0.669x),(Y赞:MIF/β-actin,x:r-hCG 浓度)。
2.2 100 IU/mL r-hCG作用不同时间对LPS诱导人PBMC中MIF mRNA转录的影响 在100 IU/mL的r-hCG作用下,在刺激后2 h后,MIF基因转录水平达到峰值,与对照组差异有统计学意义(P<0.05)。随后MIF的mRNA水平开始回落,到第8h和第16h时,MIF基因转录水平基本回到刺激前的水平,与对照组差异无统计学意义,见表2。拟合回归方程x:时间)。
表1 不同浓度r-hCG对PBMC中MIFmRNA转录的影响(n=3,±s)
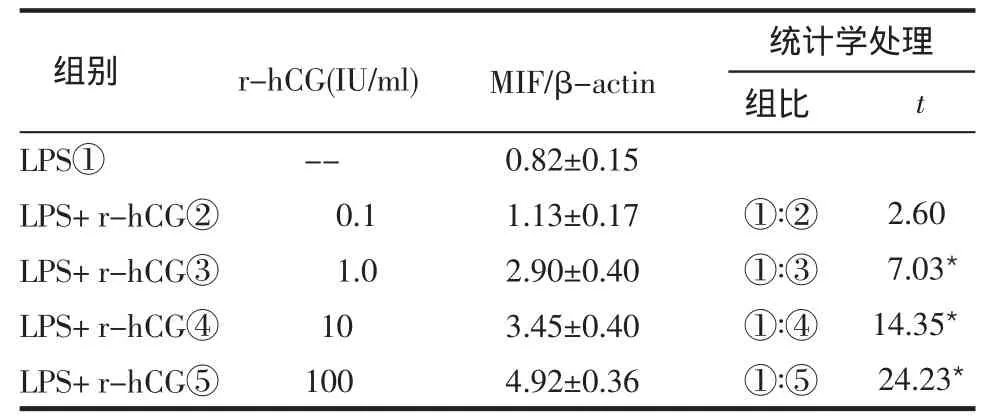
表1 不同浓度r-hCG对PBMC中MIFmRNA转录的影响(n=3,±s)
*P<0.05
组别统计学处理r-hCG(IU/ml) MIF/β-actin 组比t LPS①LPS+r-hCG②LPS+r-hCG③LPS+r-hCG④LPS+r-hCG⑤--0.1 1.0 10 100 0.82±0.15 1.13±0.17 2.90±0.40 3.45±0.40 4.92±0.36①∶②①∶③①∶④①∶⑤2.60 7.03*14.35*24.23*
表2 100 IU/mL r-hCG作用不同时间对PBMC中MIF mRNA转录的影响 (n=3,±s)

表2 100 IU/mL r-hCG作用不同时间对PBMC中MIF mRNA转录的影响 (n=3,±s)
*P<0.05
r-hCG作用时间(h)统计学处理MIF/β-actin 组比t 0①0.5②1③2④4⑤8⑥16⑦0.70±0.11 7.83±1.30 12.28±1.62 12.40±0.45 7.00±0.41 1.01±0.21 0.67±0.14①∶②①∶③①∶④①∶⑤①∶⑥①∶⑦9.47*12.08*38.95*20.93*1.68 0.31
3 讨论
MIF是一个由115个氨基酸残基组成的分子质量为12.5 ku的蛋白,属于炎症诱发细胞因子,可直接抑制巨噬细胞的移动,参与多种生理生化过程。已有研究发现,MIF参与了整个妊娠过程,且hCG可以诱导和调控MIF的表达和分泌[4]。如Akoum等[5]报道hCG可以诱导子宫内膜基质细胞合成并分泌MIF,怀孕前3个月,子宫内膜细胞及滋养层细胞都能表达MIF。表明在植入期及胚胎发育早期,该因子起了某种作用。hCG并没有影响MIF mRNA在细胞中的稳定性,而主要是通过提高MIF基因的转录水平来发挥作用。由于MIF可以促进早期血管形成并参与免疫修饰,并且有抑制自然杀伤细胞(NK)活化等特性,可能在胚胎植入及生长发育的过程中,MIF作为一种可引起子宫内膜变化的重要影响因子的细胞介导物,并受hCG诱导。而hCG作为人类激素中碳水化合物含量最高的糖蛋白激素,其主要生物学活性是刺激母体黄体分泌孕酮,在维持早期妊娠中发挥着重要作用。正常妊娠时,胚胎种植后第1天即可在母体血清中检测到hCG,至妊娠的60~90 d hCG血清水平达高峰,于妊娠中期降至较低水平。研究发现,不仅hCG,妊娠早期妇女的PBMC也有促进黄体分泌孕酮的作用[6],提示PBMC在妊娠早期的内分泌系统中具有重要作用。本实验将不同剂量的hCG作用于体外培养的PBMC,发现一定剂量的hCG可逐渐增加PBMC产生MIF。采用RT-PCR方法分析PBMC中MIF mRNA的转录水平,发现hCG对MIF表达的调控是发生在基因转录水平上的,且在一定浓度范围内与hCG的浓度呈正相关。另外,笔者进行了hCG作用不同时间对PBMC中MIF mRNA转录水平的影响实验,发现在一定浓度hCG的作用下,hCG在很短时间内即可增强MIF基因转录水平,在1~2 h就可达到峰值,随后开始回落,在第8小时基本回到刺激前的水平,表明hCG对MIF的调控是一种短时的效应。hCG可能是通过调控MIF的表达而参与巨噬细胞趋化及炎症反应,但MIF是否在hCG诱导下参与了妊娠的发生和发展,还有待于进一步研究。
[1]Nishihira J.Macrophage migration inhibitory factor(MIF):its essential role in the immune system and cell growth[J].J Interferon Cytokine Res,2000,20(9):751-762.
[2]Davies S,Byrn F,Cole LA.Human chorionic gonadotropin testing for early pregnancy viability and complications[J].Clin Lab Med,2003,23(2):257-264.
[3]张玉环,陈保疆,焦振山,等.特应性皮炎患者单个核细胞Th1/Th2和IFN-γ及IL-4 mRNA表达[J].天津医药,2006,34(12):833-835.
[4]Wada S,Kudo T,Kudo M,et al.Induction of macrophage migration inhibitory factor in human ovary by human chorionic gonadotrophin[J].Hum Reprod,1999,14(2):395-399.
[5]Akoum A,Metz CN,Morin M.Marked increase in macrophage migration inhibitory factor synthesis and secretion in human endometrial cells in response to human chorionic gonadotropin hormone[J].J Clin Endocrinol Metab,2005,90(5):2904-2910.
[6]Nakayama T,Fujiwara H,Maeda M,et al.Human peripheral blood mononuclear cells (PBMC)in early pregnancy promote embryo invasion in vitro:HCG enhances the effects of PBMC[J].Hum Reprod,2002,17(1):207-212.
