Fe2O3的制备及其电化学性能研究*
2010-11-26陈召勇张建利朱华丽李杉杉
陈召勇, 张建利, 朱华丽, 朱 伟, 李杉杉
(长沙理工大学 物理与电子科学学院,湖南 长沙 410114)
锂离子电池负极材料的研究目前主要集中在两类:一是碳材料,包括石墨与无定形碳。石墨作为负极材料已经成功商品化;由于碳材料结构和形貌的多样性[1],碳材料成为负极材料的一个热点。另一类是非碳材料,主要包括合金和金属氧化物,如Si, Li-Al, SnO2[2], MnO2[3]等。与其它负极材料相比,Fe2O3具有资源丰富、环境友好、理论比容量高[4]等优点,是一种潜在的锂离子电池负极材料。M M Thackeray等[5,6]研究表明,Fe2O3在电化学充放电过程中发生尖晶石到盐相结构的晶体转变,导致其循环性能差,这极大地限制了Fe2O3的广泛应用。Bui Thi Hang等[7]采用不同形式的碳材料对Fe2O3进行了修饰,但并未明显提高其循环性能。Sho Kanzaki等[8]通过化学氧化,Yanna NuLi等[9,10]通过控制Fe2O3的颗粒尺寸和形貌在一定程度上改善了其循环性能,但仍然满足不了实际使用要求。虽然科研人员对Fe2O3进行了广泛研究,但较少文献直接研究Fe2O3在充放电过程中的结构变化。
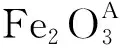
1 实验部分
1.1 仪器与试剂
Netzsch STA409PC型综合热分析仪;日本理学Rigaku D/MAX-2000/PC型X-射线衍射仪(XRD); Philips quanta 200型扫描电镜(SEM); Land电池测试仪(电压范围2.5 V~3.9 V, 0.1 C倍率); CHI 660B型电化学工作站。
所用试剂均为分析纯。
1.2 Fe2O3的制备
(1) A法

(2) B法

1.3 负极材料的制备
以Fe2O3为负极活性物质,乙炔黑为导电剂,PVDF乳液为粘结剂,其质量比为8 ∶1 ∶1,以铜箔为集电极进行涂膜,打片烘干后作为负极片,然后以金属锂片为对电极,美国Celgard2400为隔膜, 1 mol·L-1LiPF6/[碳酸乙烯酯+碳酸二甲酯(体积比1 ∶1)]为电解液,在真空手套箱内装配出模拟电池。
2 结果与讨论
2.1 反应机理
图1为FeC2O4·2H2O(a,对应A法)和添加KCl的FeC2O4·2H2O(b,对应B法)在空气中的TG-DSC曲线。

图 1 样品的TG-DSC曲线*Figure 1 TG-DSC curves of samples*空气, 升温速率10 ℃·min-1; a: FeC2O4·2H2O(对应A法); b: 添加KCl的FeC2O4·2H2O(对应B法)
由图1可见,a和b在200 ℃附近都存在一定失重和明显的吸热峰,失重主要是由于草酸亚铁的吸附水和结晶水引起的; 在200 ℃~300 ℃呈现较强的放热峰,并伴随明显的失重,这说明此阶段为草酸亚铁分解为Fe2O3的主要阶段。温度高于400 ℃以后两者重量基本保持不变,却存在一些较小的吸热峰存在,这可能主要是Fe2O3晶胞参数调整或晶型转变引起的。由此可以得出草酸亚铁分解过程的反应机理如式(1)所示。
(1)
从图1还可以看出,A法(a)在200 ℃之前失重20.0%, 200 ℃~300 ℃失重36.3%,与式(1)的理论失重20%和34.52%基本吻合。而B法(b)在200 ℃以前和200 ℃~300 ℃分别失重6.5%和11.5%,也与式(1)理论失重吻合。这说明以草酸亚铁为原料采用两种方法制备Fe2O3的反应机理基本一致。
2.2 Fe2O3的结构与形貌

2θ/(°)图和的XRD谱图Figure 2 XRD spectra of and
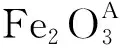

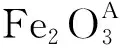

表 1 Fe2O3的晶胞参数修正结果Table 1 Amendment result of Fe2O3 cell parameters
图3为F550A和 F550B的SEM照片。从图3可以发现,F550A形貌比较规则,呈类球形,由片状结构团聚而成;F550B中也能发现少量片状结构存在,但大部分由无规则纳米颗粒团聚而成。
2.3 Fe2O3的电化学性能
(1) 放电容量
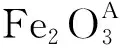

图 3 F550A和 F550B的SEM照片Figure 3 SEM image of F550A and F550B

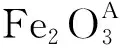

Capacity/mAh·g-1 Capacity/mAh·g-1图 4 Fe2O3的首次和第二次(插图)放电容量-电压曲线Figure 4 The initial and the second(insert) discharge capacity against voltage curves of Fe2O3
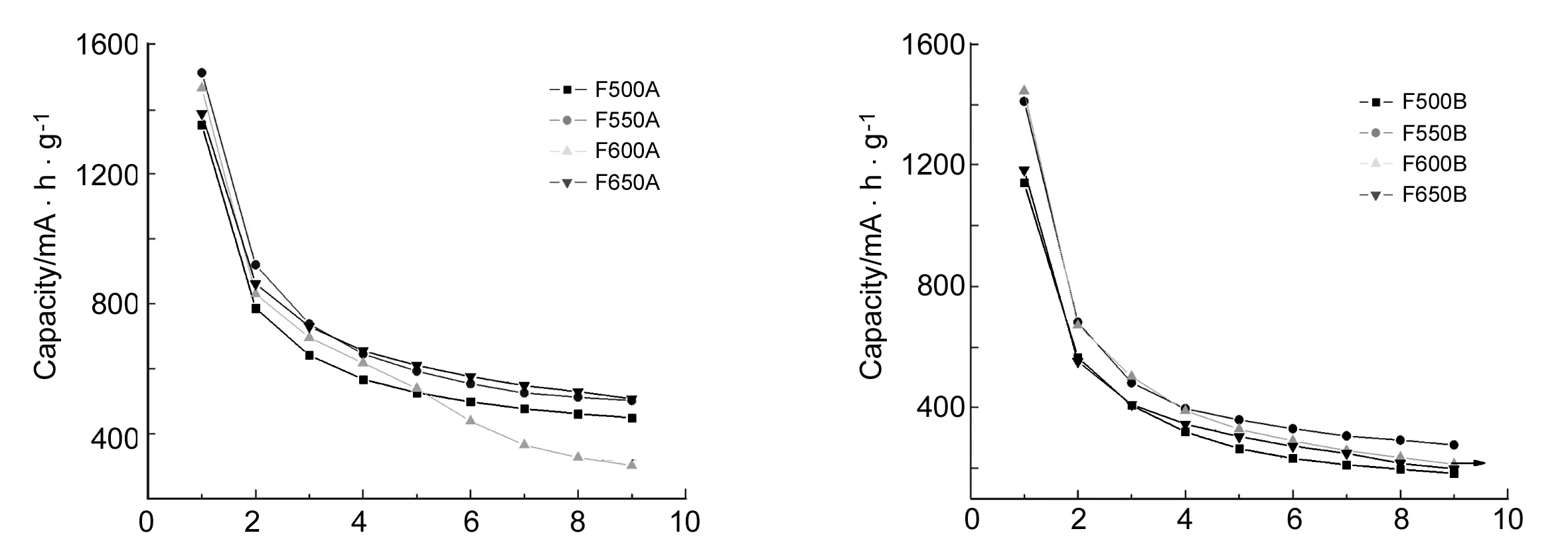
Cycle number Cycle number图 5 Fe2O3的首次放电容量-循环次数曲线Figure 5 The initial discharge capacity against cycle number curves of Fe2O3

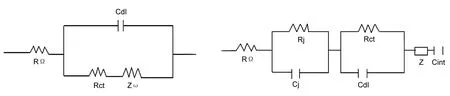
Ⅰ Ⅱ图 6 Fe2O3的EIS谱图*Figure 6 EIS spectra of Fe2O3*扫描频率1 mHZ ~10 kHZ,正弦波振幅5 mV;在充放电过程中的平台位置选取5个点进行EIS表征,其中01表示未嵌锂,02表示第一次嵌锂过程中(0.60 V), 03表示第一次脱锂过程中(1.4 V),04表示第二次嵌锂过程(1.0 V), 05表示第二次脱锂完毕(0 V);Ⅰ中RΩ为溶液电阻,Cdl为材料固液界面双电层电容,Rct为异相电荷转移电阻,Zω为Warburg电阻; Ⅱ中RΩ为溶液电阻,Cdl为材料固液界面双电层电容,Rct为异相电荷转移电阻,Zω为Warburg电阻,Rj, Cj分别为SEI处电阻和电容
(2) 循环寿命
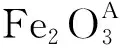
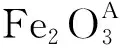
(3) EIS谱图
F550A和F550B在不同脱嵌锂阶段的EIS谱图[Nyquist和phase-log(freq)]见图6。phase-log(freq)图反应材料表面的弛豫效应,一般认为图谱中的“峰”和“谷”的个数与材料的时间常数相对应。而每个时间常数在Nyquist图中也有相应图形体现。在phase-log(freq)图中,材料表面的时间常数由原来的两个增加到三个,与之相对应的Nyquist图也从一个半圆与一条倾斜直线的组合增加到两个半圆与一条倾斜直线组合。对于03阶段中高频区两个时间常数而未出现对应两个半圆,可能是由于时间常数接近而导致半圆重叠的结果。
Nyquist图由半圆和倾斜直线可以由等效电路进行近似模拟。未经过锂离子脱嵌的材料可以用Randles等效电路[12~14](图6-Ⅰ)进行模拟。高频区此时体现为半圆,而低频区表现为一条直线为45°的倾斜直线。而经过锂离子脱嵌过程之后图形呈现两个半圆和一条直线,采用Voigt-FMG[12~14]电路(图6-Ⅱ)进行模拟比较适宜。
结合phase-log(freq)图,Nyquist图和等效电路我们发现,随着锂离子脱嵌的进行,Fe2O3时间常数和Nyquist图半圆个数增加,加上两种电路的模拟解释为高频区的半圆与锂离子在SEI膜扩散相关,中高频区半圆与电荷在膜与活性物质的转移相关,这表明伴随着首次锂离子的脱嵌过程,Fe2O3表面产生了化学变化,即SEI膜逐渐生成。对于低频区直线的解释一般认为与锂离子在材料中的扩散紧密联系。而直线已经偏离45°的现象,可能是由于锂离子的脱嵌过程产生容抗效应[15]。也有研究表明倾角大的直线表现出较小阻抗。
(4) 循环伏安
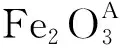

Potential/V 2θ/(°)图 7 F550A的循环伏安(CV)曲线及其XRD谱图*Figure 7 The cyclic voltammeter curves and XRD spectra of F550A*a为未经过电化学处理的F550A电极片; b为仅经过CV测试的F550A电极片; c为经过一次放电过程的F550A电极片; d为经过一次充放电和CV测试的F550A电极片

2Fe3O4+ Li2O(Fe2O3)5
(2)
3 结论
本文采用高温分解法和盐熔法制备了锂离子电池负极材料Fe2O3,通过对其进行XRD分析以及充放电测试和CV, EIS研究,可以得到以下结论:(1) 通过高温热分解法和熔盐法可以制备三方晶相的Fe2O3,形貌呈类球形,由片状结构堆积而成; (2) 熔盐法制备的Fe2O3具有更高的首次嵌锂容量; (3) Fe2O3在锂离子首次脱嵌过程中发生相变,逐步转化为Fe3O4,并形成SEI膜。
[1] Michio Inagaki. Carbon materials Structure,texture and intercalation[J].Solid State Ionics,1996,86-88:833-839.
[2] L Yuan, Z P Guo, K Konstantinov,etal. Nano-structured spherical porous SnO2anodes for lithium-ion batteries[J].Journal of Power Sources,2006,159:345-348.
[3] M S Park, W Y Yoon. Characteristics of Li/MnO2battery using a lithium powder anode at high-rate discharge[J].Journal of Power Sources,2003,114:237-243.
[4] Michel Rosso, Claire Brissot, Anna Teyssot,etal. Dendrite short-circuit and fuse effect on Li/polymer/Li cells[J].Electrochimica Acta,2006,51:5334-5340.
[5] Thackeray M M, Coetzer a preliminary investigation of the electrochemical performance of e-Fe2O3and Fe3O4cathodes in high temperature cells[J].Mat Res Bull,1981,16:591-597.
[6] M M Thackeray, W I F David, J B Goodenough. High-temperature lithiation ofα-Fe2O3:A mechanistic study[J].Solid State Chemistry,1984,55:80-286.
[7] Bui Thi Hang, Takayuki Doi, Shigeto Okada,etal. Effect of carbonaceous materials on electrochemical properties of nano-sized Fe2O3-loaded carbon as a lithium battery negative electrode[J].Journal of Power Sources,2007,174:493-500.
[8] Sho Kanzaki, Atsuo Yamada, Ryoji Kanno. Effect of chemical oxidation for nano-sizeγ-Fe2O3as lithium battery cathode[J].Journal of Power Sources,2007,165:403-407.
[9] Yanna NuLi, Rong Zenga, Peng Zhanga,etal. Controlled synthesis ofα-Fe2O3nanostructures and their size-dependent electrochemical properties for lithium-ion batteries[J].Journal of Power Sources,2008,184:456-461.
[10] P C Wang, H P Ding, Tursun Bark,etal. Nanosizedα-Fe2O3and Li-Fe composite oxide electrodes for lithium-ion batteries[J].Electrochimica Acta,2007,52:6650-6655.
[11] 唐万军,陈栋华. 二水草酸亚铁热分解反应动力学[J].物理化学学报,2007,23(4):605-608.
[12] Bernard A BOUKAM. A package for impedance/admittance data analysis[J].Solid State lonics,1986,18-19:136-140.
[13] 王连亮,孙志中,伊文涛,等. 电化学阻抗谱在锂离子电池正极材料LiFePO4研究中的应用[J].盐湖研究,2008,16(4):21-26.
[14] Doron Aurbach, Mikhail D. Levi,etal. Common electroanalytical behavior of Li intercalation processes into graphite and transition metal oxides[J].J Electrochem Soc,1998,145(9):3024-3034.
[15] Doron Aurbach, Boris Markovsky,etal. Review on electrode-electrolyte solution interactions,related to cathode materials for Li-ion batteries[J].Journal of Power Sources,2007,165:491-499.
