有机小分子催化不对称Henry反应的研究进展*
2010-11-26付记亚徐小英黄青春王立新
付记亚, 徐小英, 王 文, 黄青春, 王立新
(1. 中国科学院 成都有机化学研究所 手性技术与不对称合成四川省重点实验室,四川 成都 610041; 2. 中国科学院 研究生院, 北京 100039)
Henry反应是Louis Henry[1,2]于1895年最早发现并命名的,是一类形成C-C键非常重要的有机反应。它是基于羰基和含有α-活泼氢的硝基烷烃类化合物之间的碳碳键形成反应,该反应可以得到β-硝基醇的双官能团化合物。β-硝基醇可以进一步转化为β-氨基醇、硝基烯烃、硝基羰基化合物。因而Henry反应被广泛地应用于各类医药中间体和天然产物的合成中[3]。不对称催化的Henry反应,可以很方便地得到手性硝基醇、氨基醇、羟基酸等。近年来,不对称Henry反应的研究引起了国内外化学工作者广泛的兴趣,发展了各类手性催化剂,主要有金属催化剂与有机小分子催化剂。金属催化剂毒性大,对环境污染严重。而与过渡金属类催化剂相比,有机小分子催化剂有许多优点:毒性小,易从产物中分离,后处理简单等。有些有机小分子催化剂还可以重复使用。用于催化不对称Henry反应的有机小分子催化剂主要有金鸡纳碱衍生物、手性(硫)脲、二级胺、金鸡纳碱-硫脲双功能催化剂、胍-硫脲双功能催化剂等。
本文就近年来有机小分子催化不对称Henry反应的研究进展、手性有机小分子催化剂的结构与催化效能和立体选择性之间的关系作简要评述。
1 硫脲类催化剂
史敏等[4]报道了硫脲催化的硝基甲烷与醛的不对称Henry反应(Scheme 1)。通过对脲和硫脲类催化剂的筛选发现硫脲类催化剂比脲类催化剂的催化效果好,因为硫脲与底物形成的氢键比脲与底物形成的氢键强;手性骨架对对映选择性的影响不明显;以i-Pr2EtN为碱,THF为溶剂,1(Chart 1)的催化效果最好。对底物进行筛选后发现当芳环上有不同取代基时都能取得不错的产率和对映选择性,并且缺电子的芳香醛的反应速率比富电子芳香醛的反应速率快。
1
Chart1

Scheme1


Scheme 2

Scheme 3
2 金鸡纳碱衍生物催化剂
文献[5]报道了金鸡纳碱类衍生物催化的α-酮酯与硝基甲烷的不对称Henry反应(Scheme 2)。对催化剂的筛选发现2的催化效果最好;底物扩展实验发现不仅烯基的α-酮酯,而且其他烷基的α-酮酯及芳基的α-酮酯都能取得很高的产率和对映选择性。
Bandini[6]报道了不对称催化的三氟甲基酮与硝基甲烷的Henry反应(Scheme 3)。在没有催化剂的条件下三氟甲基酮就易于和亲核试剂反应,由于其羰基两边取代基的空间位阻差异不大,很难实现不对称催化反应。金鸡纳碱衍生物3为催化剂时,不仅烷基酮,其他的芳香基酮也能取得很高的产率和对映选择性。
3 二级胺酰胺类催化剂
冯小明等[7]报道α-酮膦酸酯和硝基甲烷的不对称Henry反应(Scheme 4)。作者对一系列二级胺酰胺类催化剂进行了研究,发现4有较好的催化活性,与之前的研究不同,以2,4-二硝基苯酚为添加剂时,产物的ee值可以高达96%。


Scheme 4
4 金鸡纳碱-硫脲类双功能催化剂
Johnston[8]报道了手性二胺催化的缺电子的N-Boc亚胺的不对称Henry反应。Hiemstra等[9]在此基础上结合硫脲与金鸡纳碱,设计了新型的金鸡纳碱-硫脲类双功能催化剂5,用于催化芳香醛与硝基甲烷的不对称Henry反应(Scheme 5),反应取得很好的收率及对映选择性。作者认为催化剂中金鸡纳碱起碱的作用,活化硝基甲烷,硫脲与羰基形成氢键,活化芳香醛,该催化剂为双活化的双功能催化剂。作者对反应底物进行了筛选,发现该类催化剂的使用范围广,不论芳环上有给电子取代还是吸电子取代都有很好的催化效果。

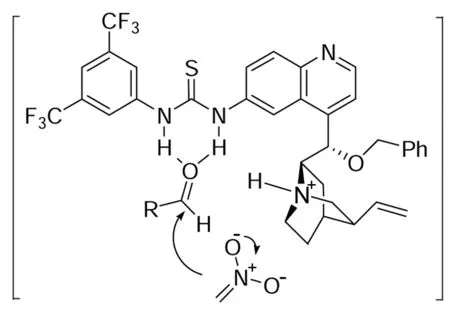
5 in transition state
P Hammar[2]对金鸡纳碱-硫脲类催化的不对称Henry反应的反应机理进行了深入的研究,通过理论计算作者对可能的两种反应途径进行了研究(Scheme 6)。这类催化剂的催化途径有两种,途径A:金鸡纳碱活化硝基甲烷,硫脲活化芳基甲醛,从而形成中间体M1;途径B:金鸡纳碱活化芳基甲醛,硫脲活化硝基甲烷,形成中间体M2。在反应过程中用GC未检测出M2,因此其催化机理是途径A。

Scheme 6
5 胍-硫脲类双功能催化剂
Chinchilla等[11]报道手性胍6(Chart 2)催化硝基甲烷与醛的不对称Henry反应,只得到了中等的对映选择性(≤54%ee)。

Chart2
马大为等[12]合成了一系列手性胍,发现7催化的不对称Henry反应(Scheme 7)效果较好,得到了很高的非对映选择性。
Murphy等[13]报道了C2对称性的环状胍化合物8催化硝基甲烷与异戊醛的不对称Henry反应(Scheme 8),只得到了中等的收率及低的对映选择性。
Nagasawa等[14]报道了胍-硫脲类双功能催化剂催化脂肪醛与硝基甲烷的不对称Henry反应[Scheme 9(a)],在含水的溶剂中获得了较好的ee值。作者通过对催化剂的筛选发现9有较好的催化活性,在混合溶剂[V(甲苯) ∶V(水)=1 ∶1]中,添加KI和KOH(50 mo1%),催化环己醛与硝基甲烷的不对称Henry反应时ee值达74%。对底物进行筛选发现9对α-位有支链的醛有较好的催化效果,ee值高达88%。醛与硝基甲烷反应时主要得到(R)-构型的产物,主要是由于位阻的作用使得硝基甲烷从Si面进攻[Scheme 9(b)]。

Yield 85%~95%, 32%~91%deScheme 7

Scheme 8



9
该课题组[15]用9催化了一系列脂肪醛与硝基乙烷的不对称Henry反应[Scheme 9(c)]。作者对催化剂底物的适用性进行了研究,发现脂肪醛不论是支链的还是直链的都有很高的非对映选择性和高的对映选择性(>84%ee)。反应形成两个手性中心,空间位阻作用对过渡态的优势构象起了重要作用,主要得到(S)-构型的产物。
Nagasawa课题组[16]用9催化了环己基甲醛和硝基甲烷的不对称Henry反应,研究发现9的用量对催化效果影响不大,溶剂中水的比例明显影响对映选择性。当V(甲苯) ∶V(水)=1 ∶5, KOH为10 mol%时有较好的催化效果。通过研究发现添加剂对催化效果有很大影响,因为阴离子与胍形成离子对,当阴离子较软时有利于催化剂发挥作用,添加KI可提高9的催化效果。
6 结束语
有机小分子催化剂(金鸡纳碱衍生物、硫脲、二级胺的酰胺、金鸡纳碱-硫脲类双功能催化剂和胍-硫脲类催化剂等)用于催化不对称Henry反应,为不对称催化反应开辟了新的领域——由有机金属催化过渡到模拟酶的小分子催化。开发高效、廉价易得的小分子催化剂应是下一步研究的一个重点。金鸡纳,硫脲都是双功能催化剂,可同时活化亲核试剂和亲电试剂,可期望获得更高效的催化剂。在此基础上设计出更加高效的催化剂是有机化学家们研究的重点。
[1] L Henry, C R Hebd. Formation synthétique dátkool nitzés[J].C R Hebd Seances Acad Sci,1895,120:1265-1268.
[2] Henry L. Formation synthétique dátkool nitzés[J].Bull Sci Chim Pails,1895,13:999-1003.
[3] F A Luzzio. The Henry reaction:Recent examples[J].Tetrahedron,2001,7:915-945.
[4] X G Liu, M Shi. Development of axially chiral bis(arylthiourea)-based organocatalysts and their application in the enantioselective Henry reaction[J].Tetrahedron:Asymmetry,2007,18:2773-2781.
[5] H M Li, B M Wang, L Deng. Enantioselective nitroaldol reaction ofc-ketoesters catalyzed by cinchona alkaloids[J].J Am Chem Soc,2006,128:732-733.
[6] M Bandini, Enantioselective organocatalyzed Henry reaction with fluoromethyl ketones[J].Chem Commun,2008:4360-4362.
[7] X H Chen, X M Feng. A Secondary amine amide organocatalyst for the asymmetric nitroaldol reaction ofα-ketophosphonates[J].Chem Eur J,2008,14:10896-10899.
[8] B M Nugent, R A Yoder, J N Johnston. Chiral proton catalysis:A catalytic enantioselective cirect AzaúHenry reaction[J].J Am Chem Soc,2004,126:3418-3419.
[9] T Marcelli, R N S V Haas, H Hiemstra. Asymmetric organocatalytic Henry reaction[J]. Angew Chem Int Ed,2006,45:929-931.
[10] P Hammar. Density functional theory study of the cinchona thioureaúcatalyzed Henry reaction:Mechanism and enantioselectivity[J].Adv Synth Catal,2007,349:2537-2548.
[11] R Chinchilla, C Najera, P Sanchez Agullo. Enantiomerically pure guanidine-catalysed asymmetric nitroaldol reaction[J].Tetrahedron:Asymmetry,1994,5:l393-1402.
[12] D W Ma, Q B Pan, E S Han. Diastereoselective Henry reactions ofN,N-dibenzylα-amino aldehydes with nitromethane catalyzed by enantiopure guanidines[J].Tetrahedron Lett,2002,43:9401-9403.
[13] M T Allingham, A Howard Jones. Synthesis and applications ofC2-symmetric guanidine bases[J].Tetrahedron Lett,2003,44:8677-8680.
[14] K Nagasawaa. Guanidine-thiourea bifunctional organocatalyst for the asymmetric Henry(nitroaldol) reaction[J].Adv Synth Catal,2005,347:1643-1648.
[15] K Nagasawaa. Diastereoselective and enantioselective Henry(nitroaldol) reaction utilizing a guanidine-thiourea Bifunctional organocatalyst[J].Eur J Org Chem,2006:2894-2897.
[16] K Nagasawaa. Organocatalytic asymmetric nitroaldol reaction:Cooperative effects of guanidine and thiourea functional groups[J].Chem Asian J,2007,2:1150-1160.
[17] C Palomo, M Oiarbide, A Laso. Recent advances in the catalytic asymmetric nitroaldol(Henry) reaction[J].Eur J Org Chem,2007:2561-2574.
[18] M S Taylor, E N Jacobsen. Asymmetric catalysis by chiral hydrogen-bond donors[J]. Angew Chem Int Ed,2006,45:1520-1543.
