1,2-二[3-(6-甲基-8-叔丁基-3,4-二氢-1,3-苯并噁嗪)基]乙烷与新型双氮桥联四酚化合物的合成*
2010-11-26徐小平姚英明纪顺俊
王 英, 徐小平, 姚英明, 纪顺俊
(1. 连云港师范高等专科学校 化学系,江苏 连云港 222006; 2. 苏州大学 材料与化学化工学院,江苏 苏州 215123)
N-取代的3,4-二氢-1,3-苯并噁嗪具有生物活性,是潜在的安定剂和镇静剂,还是制备酚醛树脂和酚类衍生物的潜在中间体[1~3]。一般以酚、伯胺和甲醛为原料,通过Mannish缩合反应来制备[4~6]。
本文报道以2-叔丁基-4-甲基苯酚、甲醛和乙二胺为原料,在甲醇中回流反应2 h,高产率地合成1,2-二[3-(6-甲基-8-叔丁基-3,4-二氢-1,3-苯并噁嗪)基]乙烷(1); 1与2-萘酚在甲苯中回流反应3 d制得新型双氮桥联四酚化合物(2, Scheme 1),其结构经1H NMR, IR, MS和元素分析表征,并测定了1的晶体结构。

Scheme1
1 实验部分
1.1 仪器与试剂
XT-4型显微熔点仪(温度计未校正);NMRatatem 300 MHz型核磁共振仪(CDC13或DMSO-d6为溶剂,TMS为内标);Varian 1000 FT-IR型红外光谱仪(KBr压片);TOF-MS型质谱仪;CARLO-ERBA EA-1110型自动元素分析仪。
所用试剂均为市售商品,使用前未经纯化处理。
1.2 合成
(1) 1的合成
在反应瓶中加入2-叔丁基-4-甲基苯酚3.28 g(20 mmol)的甲醇(20 mL)溶液,乙二胺0.67 mL(10 mmol)和37%甲醛4.07 g(50 mmol),搅拌下回流(油浴温度90 ℃)反应2 h。冷却,抽滤,滤饼用冷甲醇洗涤两次,干燥得白色固体1,产率72%, m.p.154 ℃~154.5 ℃;1H NMRδ: 1.35(s, 18H, CH3in Bu), 2.23(s, 6H, CH3), 2.95(s, 4H, CH2), 4.01(s, 4H, CH2), 4.89(s, 4H, CH2), 6.61(s, 2H, ArH), 6.92(s, 2H, ArH); IRν: 3 025, 2 960, 2 877, 1 607, 1 481, 1 032, 951 cm-1; HR-MSm/z: Calcd for C28H40N2O2(M+) 436.309 0, found 436.308 4; Anal.calcd for C28H40N2O2: C 77.02, H 9.23, N 6.42; found C 76.89, H 9.17, N 6.35。
(2) 2的合成
在反应瓶中加入1 0.18 g(0.5 mmol), 2-萘酚0.14 g(1 mmol)和甲苯2 mL,搅拌下回流反应3 d。冷却,抽滤,滤饼用乙酸乙酯洗涤两次,干燥得白色固体2,产率56%, m.p.191 ℃~192℃;1H NMRδ: 1.16(s, 18H, CH3in Bu), 2.05(s, 6H, CH3), 2.75(s, 4H, CH2), 3.55(s, 4H, CH2), 3.96(s, 4H, CH2), 6.46(s, 2H, ArH), 6.63(s, 2H, ArH), 7.13~7.16(d,J=9 Hz, 2H, ArH), 7.24~7.29(t,J=7.5 Hz, 2H, ArH), 7.38~7.43(t,J=7.5 Hz, 2H, ArH), 7.70~7.81(m, 6H, ArH), 10.01(s, 4H, OH); IRν: 3 436, 3 045, 2 962, 2 868, 1 627, 1 562, 1 480, 1 383 cm-1; HR-MSm/z: Calcd for C48H56N2O4(M+) 724.424 0, found 724.423 6; Anal.calcd for C48H56N2O4: C 79.52, H 7.79, N 3.86; found C 79.41, H 7.70, N 3.81。
1.3 1的晶体结构测定
1在乙酸乙酯中重结晶,两天后得到无色单晶。置于带有石墨单色器MoKα辐射(λ=0.071 075 nm)的Rigaku Saturn CCD衍射仪上收集数据。数据经Lorentz和极化效应校正。晶体结构采用Fourier技术由直接法解出,用全矩阵最小二乘法基于FZ对结构进行修正。非氢原子经各向异性修正,氢原子按理论加氢的方法产生,并参加最后一轮修正。
2 结果与讨论
2.1 1的合成
2-叔丁基-4-甲基苯酚、乙二胺和甲醛在甲醇中回流反应2 h,可以以很高的产率得到1。为了得到其精确结构,培养了1的单晶,X-衍射结果进一步证实了1结构的正确性。虽然文献[7]报道该反应可以得到N,N′-二(2-羟基-5-甲基-3-二叔丁基苯基甲基)乙二胺(A),但在实验中却没有发现A。可能是A比较活泼,一旦生成就可以与过量的甲醛继续反应生成1。同样,也没有发现类似咪唑啉桥联双酚结构的化合物,可能是由于温度差异导致的结果[8]。
在3,4-二氢-1,3-苯并噁嗪的结构中,2-位碳由于受到相邻杂原子的吸电子作用而略带正电荷,容易接受中性亲核试剂的进攻,过程中C─O键发生断裂而导致开环生成相应的酚类化合物。目前,文献中常见的亲核试剂有(取代)苯酚、吲哚、二级胺、2-萘酚等[4,5,9~11],而对于3,4-二氢-1,3-苯并噁嗪类底物,结构比较单一,一个分子中只含有一个苯并噁嗪骨架,对于双苯并噁嗪或桥联的苯并噁嗪类骨架的反应报道很少,而桥联的双酚或多酚类骨架是用途广泛的优良配体。鉴于此,我们尝试了1与2-萘酚的反应,中等收率制得新四酚化合物2。相对于1, 2的IR吸收峰有若干处明显的变化:在3 440 cm-1左右有一中等偏强的宽吸收峰,这反映2存在羟基(1无明显吸收);由于引入了两个2-萘酚骨架以及噁嗪环的开环,所以2的芳环骨架振动峰变得非常明显(1 627 cm-1, 1 562 cm-1, 1 480 cm-1),这也直接促使了C─O伸缩振动峰的加强。
2.2 1的晶体结构
1的分子结构图见图1;晶体结构数据和修正参数见表1,选择的键长和键角见表2。由图1和表2可见,整个分子的对称中心处于C(9)-C(9A)的中点处,相对于间隔基团-CH2-CH2-,两个噁嗪环处于最稳定的反式构象。C(8)-O(1), N(1)-C(8), C(7)-N(1)和C(6)-C(7)的键长显示它们为典型的单键,而C(1)-O(1)键长为0.138 1(2) nm,介于C-O单和C=O双键的键长之间,具有部分双键性质,这可能是由于氧原子上的孤对电子向苯环离域引起的。
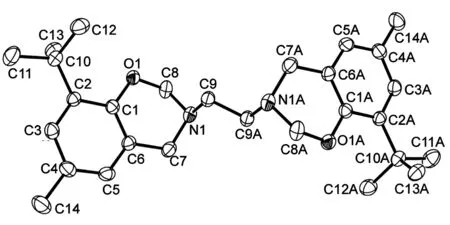
图 1 1的分子结构图Figure 1 Molecular structure of 1

Comp1Formula(Weight)C28H40N2O2(436.62)Temperature/K293(2)Crystal system(Space group)monoclinic(C 2/c)a, b, c/Å16.145 5(17), 9.120 6(7), 17.822 8(18)β/(°)110.831(2)Volume/Å32 453.0(4)Z4Calculated density/g·cm-31.182F(000)952Crystal size/mm0.40×0.30×0.24Data/restraints/parameters2 785/0/150Range/(°)3.08/27.48Goodness of fit on F21.058R1, ωR2[I>2σ(I)](all data)0.071 8, 0.163 80.091 5, 0.176 9
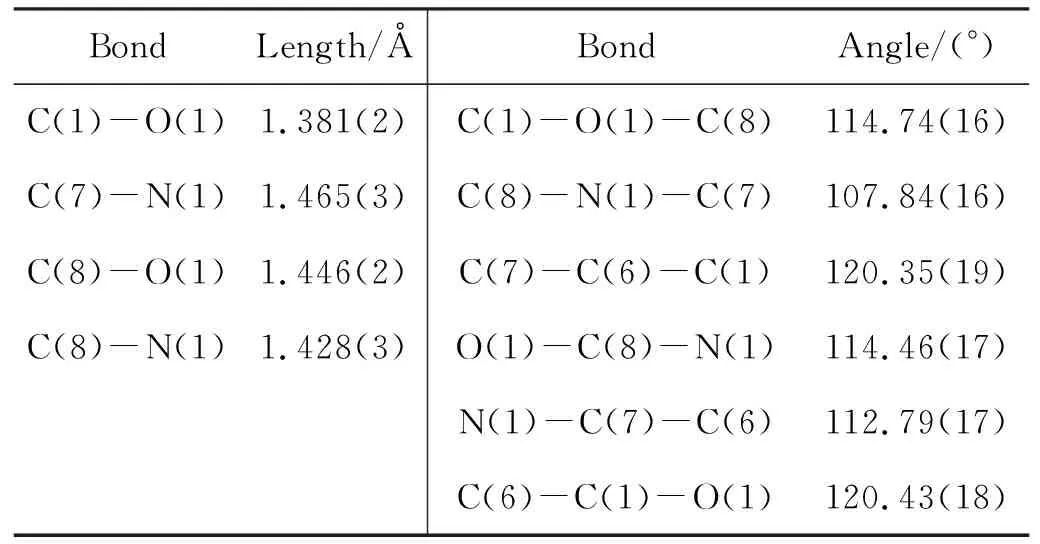
表 2 1的部分键长和键角Table 2 Selection bond lenghts and angles of 1
[1] Ishida H, Yee Low H. A study on the volumetric expansion of benzoxazine-based phenolic resin[J].Macromolecules,1997,30(4):1099-1106.
[2] Wang Y X, Ishida H. Synthesis and properties of new thermoplastic polymers from substituted 3,4-dihydro-2H-1,3-benzoxazines[J].Macromolecules,2000,33(8):2839-2847.
[3] Wang Y X, Ishida H. Cationic ring-opening polymerization of benzoxazines[J].Polymer ,1999,40(16):4563-4570.
[4] Woodgate P D, Horner G M. Synthesis of dioxazaborocines fromN-substituted-bis(2-hydroxyaryl)aminomethylamines[J].J Organomet Chem,1999,592:180-193.
[5] Higham C S, Farrell J R. Multidentate aminophenol ligands prepared with Mannich condensations[J].Tetrahedron Lett,2006,47:4419-4423.
[6] Kiskan B, Koz B, Yagci Y. Synthesis and characterization of fluid 1,3-benzoxazine monomers and their thermally activated curing[J].J Polym Chem,Part A,Polym Chem,2009,47:6955-6961.
[7] Tshuva E Y, Gendeziuk N, Kol M. Single-step synthesis of salans and substituted salans by Mannich condensation[J].Tetrahedron Lett,2001,42(36):6405-6408.
[8] Xiaoping Xu, Yingming Yao, Yong Zhang,etal. Synthesis,reactivity and structural characterization of sodium and ytterbium complexes containing new imidazolidine-bridged bis(phenolato) ligands[J].Inorg Chem,2007,46:3743-3751.
[9] Goward G R, Spiess H W. Benzoxazine oligomers:Evidence for a helical structure from solid-state NMR spectroscopy and DFT-based dynamics and chemical shift calculations[J].J Am Chem Soc,2003,125:5792-5800.
[10] Bulman Page P C, Heaney H. Retro-Mannich reactions of 3-alkyl-3,4-dihydro-2H-1,3-benz[e]oxazines and the synthesis of axially chiral resorcinarenes[J].Tetrahedron Lett,2003,44:2965-2970.
[11] Bulman Page P C, Heaney H, Sampler E P. The first enantioselective syntheses of axially chiral enantiomerically pure calix[4]resorcinarene derivatives[J].J Am Chem Soc,1999,121:6751-6752.
