合成(R)-(+)-N,N-二甲基-1-二茂铁基乙胺的方法改进*
2010-11-26聂慧芳陈卫平李晓晔宋江庆张生勇
聂慧芳, 陈卫平, 李晓晔, 宋江庆, 张生勇
(第四军医大学 药学院,陕西 西安 710032)
二茂铁(FcH, Chart 1)独特的‘三明治’式结构在金属有机化学、材料化学和催化领域展现出优异的性能[1]。以二茂铁为骨架的手性配体因其高对映体选择性和良好的催化活性,已经成为不对称催化反应中非常重要的一类手性配体。二茂铁膦配体[2~5]的过渡金属配合物催化剂在C=C, C=O和C=N双键的不对称还原反应中均表现出很高的立体选择性。
光学活性的(R)-(+)-N,N-二甲基-1-二茂铁基乙胺(5)是合成二茂铁骨架手性配体的重要中间体,当在其C2引入取代基团时,由于铁原子的作用,二甲胺基在SN1亲核取代反应中构型保持[6],因此5可以用于制备结构不同的对映体配体。

Fc-2 Chart 1
Scheme1
合成5的常用方法有两种:一是用经典的方法合成外消旋体,再进行拆分[7];另一种方法的关键步骤是在手性催化剂的存在下还原乙酰基二茂铁(1)[5],该方法所用催化剂用量大,总产率低(仅25.7%),而且在4步反应中都需要柱层析分离,消耗大量的有机溶剂。
本文在文献[5,10~12]方法的基础上改进合成5的方法。采用催化活性好、立体选择性高且成本低廉的过渡金属配合物Ru(Ⅱ)-(R,R)-TsDPEN(2, Chart 1)作催化剂,1经不对称氢转移反应制得3[9];3不经分离提纯,直接酯化,再与二甲胺通过亲核取代反应合成5(Scheme 1),总产率54.5%,其结构经1H NMR和IR确证。
1 实验部分
1.1 仪器与试剂
X-5型显微熔点仪(温度计未经校正);PE 343型自动旋光仪;VARIAN INOVA-400型核磁共振波谱仪(CDCl3为溶剂,TMS为内标);NRCOLET IR-750型红外光谱仪(KBr压片)。
(R,R)-TsDPEN,成都丽凯手性技术有限公司;[RuCl2(η6-benzene)]2,浙江省冶金研究院贵金属有限公司;其余试剂均为市售分析纯。
1.2 合成
(1) 1的合成[11]
在单口圆底烧瓶依次加入无水氯化铝8 g(60 mmol),二氯甲烷60 mL,乙酰氯4.32 g(55 mmol),在冰水浴中搅拌至完全溶解得溶液A。在三口烧瓶中依次加入FcH 9.3 g(50 mmol),二氯甲烷60 mL,置于-5 ℃低温反应器中搅拌使其完全溶解,滴加溶液A,滴毕,缓慢升至0 ℃反应5 h。加冰水100 mL,过滤,滤液静置分层,水层用二氯甲烷(2×60 mL)萃取,合并有机层,依次用饱和碳酸钾溶液、蒸馏水和饱和食盐水洗涤,无水硫酸镁干燥过夜,旋蒸脱溶得紫红色固体1 10.1 g,产率88.6%, m.p.85.1 ℃~86.0 ℃; IRν: 3 436, 3 115, 1 655, 1 456, 1 398, 1 376, 1 360, 1 281, 1 115, 1 101, 1 007 cm-1。
(2) 5的合成[5,10,12]
在三口圆底烧瓶依次加入[RuCl2(η6-benzene)]20.245 g(0.4 mmol), (R,R)-TsDPEN 0.33 g(0.9 mmol)[RuCl2(η6-benzene)]2+(R,R)-TsDPEN形成2],三乙胺0.5 mL,异丙醇100 mL,搅拌下回流反应1 h。冷却至室温,减压除去溶剂,依次加入1 9.12 g(40 mmol),二氯甲烷100 mL,甲酸-三乙胺(V∶V=5 ∶2)40 mL,搅拌下回流反应4 d。减压除去溶剂,加乙酸乙酯100 mL,过滤,滤液减压旋蒸除去溶剂得3粗品(不纯化直接用于下一步反应)。
在3粗品中依次加入吡啶40 mL和醋酐16 mL(21.2 mmol),搅拌下于室温反应过夜[10]。减压脱溶,残余物用乙醚(100 mL)溶解,依次用冰水和饱和食盐水洗涤,无水硫酸镁干燥,减压蒸干得4粗品(不纯化直接用于下一步反应)。
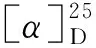
2 结果与讨论
利用经典的拆分方法合成5时,需要消耗化学量的手性拆分剂,成本往往较高,加之为了利用另一半对映体,还得进行消旋化,再继续拆分,所以,合成路线长,产率低。用不对称反应合成5的关键步骤是1的对应选择性还原。在手性恶唑硼烷的存在下,用硼烷(BH3)还原,即Correy-Bakshi-Shibata还原(简称CBS还原)[13]。该方法立体选择性尚好,但手性催化剂价格昂贵。Noyori[14]报道的还原剂联萘酚-LAH在芳香酮和α,β-不饱和酮的不对称还原中都能给出很高的对应选择性,但反应是化学量的。本文采用的催化剂为价格较低的Ru(Ⅱ)-(R,R)-TsDPEN,不仅催化剂用量较少,而且省去了反应过程中繁琐的柱层析步骤,同时节省了溶剂和成本,对环境友好。更为重要的是,在将1和3的混合物直接进行后续的反应时,1的存在并不影响3的酯化,而且在最后一步反应的处理过程中可以回收1。
本方法的四步反应,产物单一,后处理简单,反应总产率高达54.5%。
[1] R G Arrayas, J Adrio, J C Carretero,etal. Recent spplications of chiral ferrocene ligands in asymmetric catalysis[J].Angew Chem Int Ed,2006,45:7674-7715.
[2] N W Boaz, S D Debenham, E B Mackenzie,etal. Phosphinoferrocenylaminophosphines as novel and practical ligands for asymmetric catalysis[J].Org Lett,2002,4:2421-2424.
[3] Weiping Chen, P J McCormack, K Mohammed,etal. Stereoselective synthesis of ferrocene-basedC2-symmetric diphosphine ligands:Application to the highly enantioselective hydrogenation ofα-substituted cinnamic acids[J].Angew Chem Int Ed,2007,46:4141-4144.
[4] Chen W, Spindler F. Ferrocenediphosphines[P].WO 116 081,2007.
[5] K Tappe, P Knochel. New efficient synthesis of Taniaphos ligands:Application in ruthenium- and rhodium-catalyzed enantioselective hydrogenations[J].Tetrahedron:Asymmetry,2004,15:91-102.
[6] T J Colacot. A concise update on the applications of chiral ferrocenyl phosphines in homogeneous catalysis leading to organic synthesis[J].Chem Rev,2003,103:3101-3118.
[7] N W Roaz. Enzymatic esterification of 1-ferrocenylethanol:An alternate approach to chiral ferrocenyl bis-phosphines[J].Tetrahedron Letters,1989,16:2061-2064.
[8] K J Haack, S Hashiguchi, R Noyori,etal. Kinetic resolution of racemic secondary alcohols by Ru(Ⅱ)-catalyzed hydrogen transfer[J].Angew Chem Int Ed,1997,3:285-288.
[9] C V Ursini, F Mazzeo, R Rodrigues,etal. Asymmetric transfer hydrogenation of ferrocenyl ketones:A new simple route to chiral ferrocenyl alcohols[J].Tetrahedron:Asymmetry,2006,17:3335-3340.
[10] G W Gokel, D Marquarding, I K Ugi. The retentive nucleophilic displacements ofα-substituted alkylferrocenes[J].J Org Chem,1972,20:3052-3058.
[11] 李保国,张海波. 乙酰基二茂铁的合成[J].化学试剂,2001,5:292-293.
[12] Yinuo Wu, Chuanjun Lu, Xingshu Li,etal. A practical process to chiral ferrocenyl alcohols via asymmetric transfer hydrogenation catalyzed with a PEG-bound Ru catalyst in water and its application in preparing Ugi’s amine[J].Tetrahedron:Asymmetry,2009,20:584-587.
[13] Xiao-yong Fu, T L McAllister, T K Thiruvengadam,etal. Process for preparing Ezetimibe intermediate by an acid enhanced chemo- and enantioselective CBS catalyzed ketone reduction[J].Tetrahedron Letters,2003,4:801-804.
[14] R Noyori. Asymmetric synthesis via Axially dissymmetric molecules.A binaphthol-modified complex aluminum hydride reagent prossessing extremely high ability of chiral recognition[J].Pure Appl Chem,1981,12:2315-2322.
