多元醇还原法合成锂离子电池正极材料LiFePO4
2010-11-10曹雁冰胡国荣彭忠东张罗虎
曹雁冰 胡国荣 杜 柯 彭忠东 唐 春 张罗虎
(中南大学冶金科学与工程学院,长沙 410083)
多元醇还原法合成锂离子电池正极材料LiFePO4
曹雁冰 胡国荣*杜 柯 彭忠东 唐 春 张罗虎
(中南大学冶金科学与工程学院,长沙 410083)
以三甘醇为还原剂,Li2CO3和三价铁源FePO4为原料,通过多元醇还原法在低于300℃下直接制备了结晶良好的纯相LiFePO4,无须后续热处理。0.1C首次放电比容量为140.5 mAh·g-1。为了进一步改善纯相LiFePO4的电导率,以聚乙烯醇为碳源,在700℃下热处理进行了碳包覆改性,获得了LiFePO4/C复合正极材料。合成的LiFePO4/C在0.1C下放电容量为155 mAh·g-1,5C倍率下放电比容量保持在125 mAh·g-1,具有很好的倍率性能和循环稳定性。
LiFePO4;锂离子电池;多元醇还原法;碳包覆
自从1997年Padhi等[1]对橄榄石型LiFePO4首次报道以来掀起了该新型正极材料研究的热潮[2-5]。与其他常见的正极材料相比,LiFePO4具有资源丰富、成本低、热稳定性好和无污染的优点,使其成为在动力电池应用方面最有潜力的正极材料。但LiFePO4存在电子电导率低和离子扩散速率低的问题,解决该问题的方法主要有降低LiFePO4的粒径以提高锂离子的扩散系数[6-7];对LiFePO4进行体相掺杂[8-9],即在锂位或铁位掺杂金属离子形成固溶体,或者制备LiFePO4与电子良导体碳[10-11]、金属颗粒[12]的复合材料。其中,合成尺寸均匀、粒径较小的LiFePO4是提高材料电化学性能的关键途径,这可以通过溶胶-凝胶法[13]、共沉淀[14]、水热法[15]等液相合成方法得到实现。
目前以三价铁源为原料采用液相化学还原法制备LiFePO4材料的报道很少。Prosini等[16]以FePO4为原料,在乙腈溶液中用LiI还原FePO4制备LiFePO4,经过550℃热处理制得结晶相LiFePO4材料。邱亚丽等[17]以抗坏血酸为还原剂,在乙醇相中将FePO4中的三价铁还原成二价铁,同时化学插锂生成无定形态LiFePO4沉淀,烧结后得到结晶良好的LiFePO4。 郑俊超等[18]以 FePO4·xH2O 与 Li2CO3混合,以草酸为还原剂,在常温机械活化作用下还原嵌锂合成无定形态LiFePO4,然后600℃热处理合成晶态的LiFePO4。上述方法制备的LiFePO4都为无定形态,必须进行高温热处理方可获得结晶良好的材料。多元醇法为在常压较低温度下制备结晶良好的超细材料提供了一个有效途径。近来Kim等[19-20]将多元醇法引入LiFePO4的制备中,以Fe(CH3COO)2、NH4H2PO4与LiCH3COO为原料,在四甘醇溶剂中回流制备了结晶良好的纯相LiFePO4材料,无须后续热处理。但该方法使用的原料为价格较贵的有机盐,而且反应物转化为生成物的制备过程中原子利用率较低。
多元醇在沸点状态下具有强还原性,已被用来制备高结晶度的金属、合金及氧化物粉末[21]。本文利用此特点采用多元醇还原法制备LiFePO4材料,以三甘醇为还原剂和溶剂,Li2CO3和FePO4为原料,在低于300℃下通过还原嵌锂直接获得结晶良好的LiFePO4。为了进一步改善纯相LiFePO4的电导率,以聚乙烯醇为碳源,在700℃下热处理进行了碳包覆改性,获得了倍率性能良好、循环稳定的LiFePO4/C复合正极材料。
1 实验部分
1.1 材料的制备
所用试剂为无水 FePO4、Li2CO3(99.5%,四川射洪锂业公司)和三甘醇(A.R.,国药集团化学试剂有限公司,沸点290℃)。其中无水FePO4由FePO4·2H2O(广西比莫比)在空气中450℃脱水2 h获得。为了促使固液相反应体系中原料的充分混合和均匀分散,对反应原料进行了机械球磨预处理。按最终产物为0.1 mol LiFePO4的量将 Li2CO3、 无水 FePO4和三甘醇按照物质的量比为0.5∶1∶1在无水乙醇中进行高能球磨4 h,120℃真空干燥后获得浅绿色的样品(编号为S1)。将干燥后样品分散在250 mL三甘醇中,转移至装有回流冷凝管和搅拌装置的三口烧瓶中。将烧瓶固定在加热套里,在持续搅拌下三甘醇悬浮液被加热至沸腾后再保持回流10 h。获得的产物用丙酮反复清洗,直到获得的洗液为无色为止以确保三甘醇和其他有机物被完全除去。然后在120℃真空干燥得到样品(编号为S2)。将样品S2与占其5%质量比的聚乙烯醇粉末球磨1 h混合均匀后,在Ar气氛下处理获得LiFePO4/C复合正极材料 (编号S3)。为了使聚乙烯醇充分碳化,提高碳包覆层中有序结构碳的含量,提升其导电性[22-23],同时考虑到样品S2已结晶良好,为防止LiFePO4/C材料颗粒在高温下聚集生长为大颗粒,碳化工艺选择为700℃处理1 h。
1.2 材料的表征
采用日本Rigaku公司生产Minflex型的X射线自动衍射仪(XRD,D/max-r A type Cu Kα1,40 kV,300 mA,10°~70°,Japan) 进行晶体结构分析; 采用Shimadzu-FTIR-8400红外光谱仪分析样品的红外光谱,测试范围为400~1200 cm-1。样品的微观形貌研究采用日本JEOL公司JSM-5600LV型扫描电子显微镜。LiFePO4/C的碳含量分析,采用HW2000型红外碳硫分析仪。
1.3 电池组装与电化学测试
将材料制作成CR2025型扣式电池进行充放电循环测试。采用涂膜法制备电极,以N-甲基-2-吡咯烷酮(NMP)为溶剂,按质量比 80∶10∶10 分别称取活性物质、乙炔黑和PVDF,混合均匀后,涂在预处理过的铝箔上,放入真空干燥箱中在120℃干燥得到正极片。在充满氩气的手套箱中,以金属锂片为负极,1 mol·L-1LiPF6溶解于碳酸乙烯酯(EC)+二甲基碳酸酯(DMC)+乙基甲基碳酸酯(EMC)(体积比为1∶1∶1)为电解液,Celgard2400多孔聚乙烯膜为隔膜,组装成扣式电池。在Land电化学仪上进行电化学测试,充电终止电压为4.1 V,放电终止电压为2.5 V。
2 结果与讨论
图1所示为不同条件下获得的LiFePO4正极材料的XRD图。从图1a中可以看出,高能球磨后的样品S1仅出现了LiFePO4材料的一些微弱特征峰,衍射峰宽化,结晶很差。可见机械球磨预处理不仅使反应物充分混合,实现反应物晶粒的细化,而且促使反应物产生了晶格缺陷,提高了反应活性,诱发了多相化学反应[24]。在强机械力作用下,三甘醇通过固液相反应将FePO4中的三价铁还原成二价铁,同时在机械化学活化作用下还原嵌锂形成了LiFePO4晶核。图1b和图1c则表明经过多元醇沸腾回流得到的样品S2和碳包覆后样品S3的衍射峰与LiFePO4材料的标准衍射峰一致,均为正交晶系橄榄石结构,属于Pnma空间群。特征峰较为明显,没有发现杂质峰,且2个样品的衍射峰都较为尖锐,说明所合成的产物结晶良好。图1c中并没有观察到晶态碳材料的衍射峰,经碳硫分析仪检测样品S3的碳含量为1.02%。说明PVA无氧分解所形成的碳是以无定型的形式存在的,而且包覆碳不会影响LiFePO4的内部晶体结构。
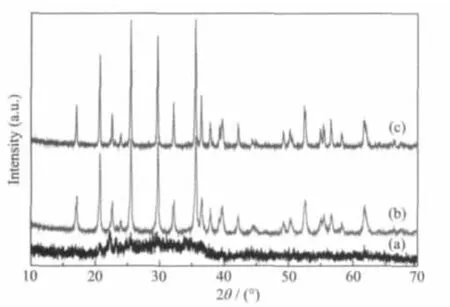
图1 不同条件下获得的LiFePO4材料的XRD图Fig.1 XRD patterns of LiFePO4samples prepared at different conditions
同时对晶态的LiFePO4样品S2和S3进行了红外光谱的分析,如图2所示。图2显示2个样品的红外光谱基本一致,都表现出橄榄石结构的红外吸收峰,表明材料结晶良好[25]。具体为1139、1096和1057 cm-1处的吸收峰对应于PO43-四面体不对称伸缩振动;971 cm-1处的吸收峰对应于P-O对称伸缩振动;636和468 cm-1处的吸收峰对应于P-O不对称弯曲振动;501、551、578 和 647 cm-1的吸收峰对应于P-O对称和不对称弯曲振动。
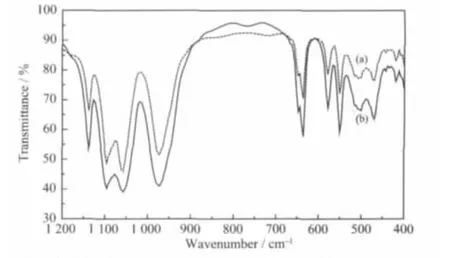
图2 多元醇还原合成的样品S2与碳包覆样品S1的红外光谱图Fig.2 FTIR transmittance spectra of LiFePO4
结合图1和图2可以看出,多元醇还原法中采用的三甘醇既是溶剂又是还原剂,在沸腾回流状态下产生的还原性条件促使FePO4中的三价铁还原成二价铁,同时化学插锂形成LiFePO4晶核,不必添加额外的还原剂或者还原气体保护;而且高温溶剂提供一个常压下特殊的物理化学环境[21],有利于液相中LiFePO4的生长,无须后续热处理,制备出晶粒发育完整、结晶良好的纯相材料,多元醇还原法合成LiFePO4的反应可用下式表示:

图3所示为多元醇还原的样品S2与碳包覆样品S3的SEM图。图3a可以看出,多元醇还原得到的LiFePO4材料颗粒细小,尺寸在100~200 nm,分散均匀;具有较光滑的表面和规整的形貌,颗粒之间界面明显,表明晶粒形态生长完整。图3b显示为碳包覆后LiFePO4/C复合材料的微观形貌,PVA热解后的无定形碳沉积在LiFePO4表面使得颗粒表面较粗糙,同时700℃高温热处理并未明显改变LiFePO4颗粒尺寸和形状,颗粒与颗粒之间的界限明显,并没有聚集生长为大颗粒。主要是由于PVA在烧结过程分解出较为细小的碳颗粒,分布在LiFePO4晶粒边缘,会产生空间阻隔,在一定程度上避免了粒子间融合异常生长,使颗粒粒径仍保持细小。可见多元醇还原法利于获得粒径分布均匀、颗粒细小的LiFePO4材料,这样可缩短Li离子的固相扩散路程,提高Li离子扩散速率,这有助于改善材料的电化学动力学特性。

图3 多元醇还原的样品S2与碳包覆样品S3的SEM图Fig.3 SEM images of LiFePO4materials
图4比较了晶态LiFePO4样品S2和S3在0.1C倍率首次充放电性能。从充放曲线来看,多元醇还原得到的纯相LiFePO4样品S2首次放电容量为140.5 mAh·g-1,而且充放电压平台的差值较大。主要是由于颗粒之间缺乏充足的导电连接,电子电导率较低而产生了极化。通过碳包覆后的LiFePO4/C材料首次放电容量为155 mAh·g-1,充放电平台更平坦,而且充放电平台电位差更小,说明碳包覆有效提高了LiFePO4颗粒间的导电性,从而减少了电化学反应极化,利于提高LiFePO4活性物质的利用率。

图4 多元醇还原的样品S2与碳包覆样品S3的0.1C倍率首次充放曲线Fig.4 Initial charge/discharge curves of LiFePO4at 0.1C rate
图5为多元醇还原合成的纯相LiFePO4样品在不同倍率下的放电曲线,在0.2C、0.5C、1C、2C下放电容量分别为 137.4、130.4、123.9、117.4 mAh·g-1,保持了0.1C容量的97.8%、92.8%、88.2%和83.6%,并且放电电压平台保持较好。考虑到未进行碳包覆处理,采用多元醇还原合成的纯相LiFePO4材料颗粒细小均匀且结晶良好,表现出了较好的倍率性能。但是由于电子电导率较低,在大电流放电下可逆容量较低。图6所示为碳包覆后的LiFePO4/C材料在不同倍率下的放电性能。在0.2C、0.5C、1C、2C下放电容量分别为 151.3、148.3、143.8、135.5 mAh·g-1,保持了0.1C容量的97.6%、95.7%、92.8%和87.4%,并且放电电压平台保持很好。与纯相LiFePO4相比,LiFePO4/C材料具有更好的倍率性能。主要是有机高聚物在高温下分解的碳使得颗粒表面及颗粒之间分散着导电连接,提高了材料的导电性能,降低了电荷转移阻抗,从而在较大的放电电流下仍能达到较高的放电容量。可见,在高倍率放电下电子导电和Li离子的固相扩散都是控制LiFePO4性能的关键因素。

图5 多元醇还原合成的纯相LiFePO4样品在不同倍率下的放电曲线Fig.5 Discharge curves of LiFePO4sample S2 by polyol processing at different rates
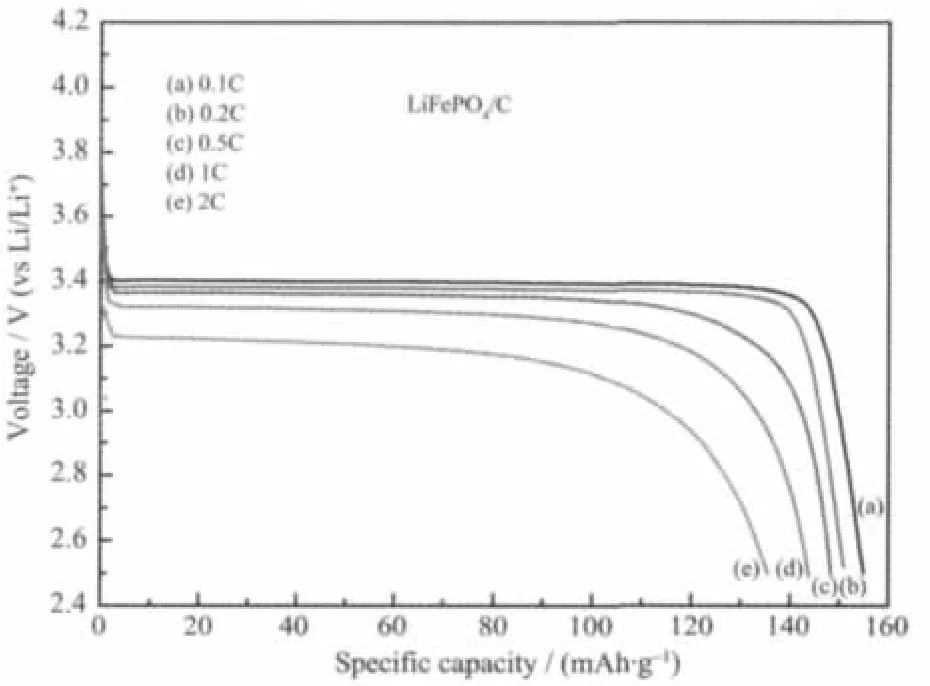
图6 碳包覆后的LiFePO4/C材料在不同倍率下的放电曲线Fig.6 Discharge curves of LiFePO4/C sample S3 at different rates
进一步检测了LiFePO4/C材料的倍率循环性能。LiFePO4/C不仅具有较好的倍率放电性能,同时保持了较好的循环稳定性,如图7所示。LiFePO4/C材料在各个倍率下循环放电比容量都没明显的衰减,5C倍率下放电比容量保持在125 mAh·g-1。倍率测试后,LiFePO4电池在0.2C的倍率下进行恢复,容量仍保持很好,说明材料具有很好的结构稳定性。LiFePO4/C良好的倍率循环性能得益于样品结晶良好、颗粒细小均匀以及碳包覆改性。良好的结晶性能保证了材料在循环过程中结构的稳定性;制备的材料颗粒粒径较小,缩短了锂离子扩散路径,提高了Li离子扩散速率;PVA裂解的碳提供了良好的导电通路,提高了材料的电子电导率;改善的Li离子扩散速率和电子电导率有利于LiFePO4材料电化学动力学性能的提高,使得合成的LiFePO4/C材料具有良好的电化学性能。

图7 碳包覆后的LiFePO4/C样品S3在不同倍率下的循环性能Fig.7 Cycle performance of prepared LiFePO4/C sample S3 at different rates
3 结 论
以三甘醇为溶剂和还原剂,采用多元醇还原法通过FePO4的还原嵌锂在常压低于300℃下制备了颗粒细小均匀、结晶良好的纯相LiFePO4,0.1C首次放电比容量为140.5 mAh·g-1。为了提高纯相LiFePO4的电子电导率,通过700℃碳化处理获得了LiFePO4/C材料。碳包覆工艺未影响LiFePO4材料的结构和形貌,而大大改善了其电化学性能。合成的LiFePO4/C在 0.1C下放电容量为 155 mAh·g-1,5C倍率下放电比容量保持在125 mAh·g-1,具有很好的倍率性能和循环稳定性。
[1]Padhi A K,Najundaswamy K S,Goodenough J B.J.Electrochem.Soc.,1997,144(4):1188-1194
[2]PadhiAK,NanjundaswamyKS,MasquelierC.J.Electrochem.Soc.,1997,144(5):1609-1613
[3]Swoyer J L,Barker J,Saidi M Y.Electrochem.Solid-State Lett.,2003,6(3):A53-A55
[4]TONG Hui(童 汇),HU Guo-Hua(胡国华),HU Guo-Rong(胡国荣),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2006,22(12):2159-2164
[5]Kang B,Ceder G.Nature,2009,458:190-193
[6]Park K S,Son J T,Chung H T,et al.Electrochem.Commun.,2003,5(10):839-842
[7]Wang L N,Zhang Z G,Zhang K L.J.Power Sources,2007,167(1):200-205
[8]Chung S Y,Bloking J T,Chiang Y M.Nat.Mater.,2002,1(2):123-128
[9]NI Jiang-Feng(倪江锋),ZHOU Heng-Hui(周恒辉),CHEN Ji-Tao(陈继涛),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2005,21(4):472-476
[10]Shin H C,Cho W,Jang H.Electrochim.Acta,2006,52(4):1472-1476
[11]Liu H,Xie J Y,Wang K.Solid State Ionics,2008,179(27/28/29/30/31/32):1768-1771
[12]Park K S,Son J T,Chung H T,et al.Solid State Commun.,2004,129(5):311-314
[13]Dominko R,Goupil J M,Bele M,et al.J.Electrochem.Soc.,2005,152(5):858-863
[14]Park K S,Kang K T,Lee S B,et al.Mater.Res.Bull.,2004,39(12):1803-1810
[15]ZHANG Jing(张 静),LIU Su-Qin(刘素琴),HUANG Ke-Long(黄可龙),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2005,21(3):433-436
[16]Prosini P P,Carewska M,Scaccia S,et al.J.Electrochem.Soc.,2002,149(7):886-890
[17]Wang B F,Qiu,Y L,Ni S Y.Solid State Ionics,2007,178(11/12):843-847
[18]ZHENG Jun-Chao(郑俊超),LI Xin-Hai(李新海),WANG Zhi-Xing(王志兴),et al.Chin.J.Funct.Mater.(Gongneng Cailiao),2008,39(11):1843-1846
[19]Kim D H,Kim J.Electrochem.Solid-State Lett.,2006,9(9):A439-A442
[20]Kim D H,Kim J.J.Phys.Chem.Solids,2007,68(5/6):734-737
[21]LI Qi-Hou(李启厚),BI Dan-Dan(毕丹丹),LIU Zhi-Hong(刘志宏),et al.Chin.Mater.Sci.Eng.Powder Metal(Fenmo Yejin Cailiao Kexue Yu Gongcheng),2008,13(2):79-83
[22]Yuna N J,Haa H W,Jeong K H,et al.J.Power Sources,2006,160(2):1361-1368
[23]Murugan A V,Muraliganth T,Manthiram A.J.Phys.Chem.C,2008,112(37):14665-14671
[24]Liao X Z,Ma Z F.Wang L,et al.Electrochem.Solid-State Lett.,2004,7(12):522-525
[25]Ravet N,Gauthier M,Zaghib K,et al.Chem.Mater.,2007,19(10):2595-2602
Synthesis of LiFePO4Cathode Materials by Polyol Reduction Processing
CAO Yan-Bing HU Guo-Rong*DU Ke PENG Zhong-DongTANG Chun ZHANG Luo-Hu
(School of Metallurgical Science and Engineering,Central South University,Changsha 410083)
Highly crystalline LiFePO4have been synthesized by a polyol reduction processing at temperatures as low as 300℃without post annealing in reducing gas atmospheres,using FePO4and Li2CO3as the starting material.In order to improve the electrical conductivity of the as-prepared pure LiFePO4,carbon-coating LiFePO4/C composite is obtained by calcining the mixture of as-prepared LiFePO4and polyvinyl alcohol(PVA).The products have been characterized by X-ray diffraction,scanning electron microscopy(SEM),IR spectroscopy,and galvanostatic chargedischarge test.The results show that carbon coating improves the electrochemical performance significantly without much particle growth of the as-prepared LiFePO4.The as-prepared pure LiFePO4delivers discharge capacity of 140.5 mAh·g-1at 0.1C rate.And the LiFePO4/C composite delivers discharge capacity of 155 mAh·g-1at 0.1C rate and 125 mAh·g-1at 5C rate,displaying good electrochemical capacity and rate capability.
LiFePO4;Li-ion battery;polyol reduction processing;carbon coating
O614.111;TM912
A
1001-4861(2010)06-1061-05
2009-12-23。收修改稿日期:2010-01-31。
国家科技支撑计划资助项目(No.2007BAE12B01-1),湖南省科技计划资助项目(No.2009GK3150)资助。*
。 E-mail:hgrhsj@263.net,Tel:0731-88830474
曹雁冰,男,27岁,博士研究生;研究方向:新能源材料化学。
