苦参碱对心肌成纤维细胞增殖、胶原代谢及转化生长因子-β1蛋白表达的影响
2010-11-06周艳芳胡迎春杨海鹭欧阳静萍
周艳芳,胡迎春,杨海鹭,徐 怡,欧阳静萍
(1.广东医学院病理生理教研室,广东 东莞 523808;2.武汉大学病理生理教研室,湖北 武汉 430071)
心肌成纤维细胞的异常增殖、过度合成和分泌大量的胶原蛋白是心肌纤维化形成的细胞学本质[1]。因此,深入研究间质重构与心肌成纤维细胞增殖、胶原合成的关系,寻找合适的药物抑制间质重构,对于逆转心肌纤维化、提高心血管功能具有重要的理论意义和临床价值。笔者采用容量负荷因子醛固酮诱导体外培养的新生大鼠心肌成纤维细胞增殖及胶原合成,观察苦参碱对心肌成纤维细胞增殖及胶原合成的影响并探讨转化生长因子-β1(TGF-β1)蛋白在苦参碱抗心肌纤维化中的作用机制,为临床使用有效药物预防和逆转心肌纤维化提供理论和实验依据。
1 材料与方法
1.1 仪器与试药
Bio-Rad 450型酶标仪(美国伯乐Bio-Rad公司);UV 1601分光光度计(日本岛津);PCR仪(华美生物工程公司);DY-8A型电泳仪(上海西巴斯生物技术开发公司);DMBRI倒置相差荧光显微镜(德国LEICA);FACSort型流式细胞仪(美国Becton-Dickinson公司)。DMEM培养基(Gibco公司);新生小牛血清(Gibco公司);醛固酮(Sigma公司);胰蛋白酶(Difco);小鼠抗波形蛋白单克隆抗体(Biogenes公司);TGF-β1单抗(Biogenes公司);FITC-羊抗兔IgG(武汉博士德生物工程有限公司);羟脯氨酸测定试剂盒(南京建成生物工程研究所);四甲基偶氮唑盐(MTT,Sigma公司)。其他常用生化试剂均为国产分析纯。
1.2 差速贴壁法体外培养心肌成纤维细胞
取日龄1~3d的Wistar大鼠,在无菌条件下开胸取出心脏,置4℃ 0.01%磷酸盐缓冲液中,剪取心室肌至1mm3大小的碎块,弃去0.01%磷酸盐缓冲液,加入0.125%胰蛋白酶8~10mL反复消化10min,直至组织块消失,分别收集每次消化悬液,离心弃上清液,加入含10%新生牛血清的DMEM培养液制成细胞悬液,置37℃含5%CO2的培养箱中。根据心肌细胞和成纤维细胞贴壁时间的不同,采用差速贴壁1~1.5h,弃上清液,获得心肌成纤维细胞。待细胞长满瓶壁后用0.25%胰酶消化传代。抗波形蛋白单克隆抗体免疫细胞化学染色对鉴定为所需的心肌成纤维细胞纯度达98%。试验采用2~3代的成纤维细胞。各组处理因素作用24h后,光学倒置相差显微镜下观察细胞生长状况。
1.3 试验分组
对照组:不加任何处理因素;醛固酮组:培养液中加入醛固酮1.0×10-7mol/L;醛固酮+不同浓度苦参碱组:培养液中同时加入1.0×10-7mol/L的醛固酮和浓度分别为0.125,0.25,0.5mmol/L的苦参碱。将上述各组依次标记为A,B,C,D,E组。
1.4 测定指标
加处理因素24h后,在已培养细胞的96孔板每孔中加入0.5%MTT10μL,置37℃下4h后,弃上清液,加入100μL二甲基亚砜(DMSO)振荡15min,置酶标仪上测光密度 (OD)值,测定波长为490nm。
用流式细胞仪双标法测定细胞周期及TGF-β1蛋白表达。处理因素作用24h后收集细胞,加70%冷乙醇4℃过夜。离心,磷酸盐缓冲液冲洗,加入一抗4℃孵育过夜,用磷酸盐缓冲液冲洗,加入异硫氰酸荧光束(FITC)标记的二抗37℃孵育30min。RNA酶200μL37℃水浴30min。碘化丙啶暗处冰浴30min。
用免疫荧光细胞化学染色法检测TGF-β1蛋白表达。处理因素作用24h后,磷酸盐缓冲液冲洗,纯甲醇固定10min,1%TritonX-100室温孵育20min。正常山羊血清室温封闭10min;滴加一抗置湿盒4℃过夜;磷酸盐缓冲液洗3次;滴加FITC标记二抗,置37℃湿盒中1h,磷酸盐缓冲液洗3次,每次5min;观察,照相。
取各组细胞上清液0.5mL,加无水乙醇1.2mL,旋涡混匀器充分混匀2次,每次2min,3500r/min离心10min,取上清液约1.5mL,烘干,加0.5mL双蒸水复溶,制成稀释1倍的检测液,加试剂一、二、三(具体操作按羟脯氨酸检测试剂盒说明书)混匀,65℃水浴15min,冷却后在酶标仪上测 OD值,测定波长为550nm,光径1cm,双蒸水调零,比色。按照下式计算羟脯氨酸含量。
羟脯氨酸=(测定管吸光度-空白管吸光度)/(标准管吸光度-空白管吸光度)×标准管浓度(5μg/mL)×稀释倍数。
1.5 统计学处理
所有数据以均值±标准差(X±s)表示,使用SPSS统计软件分析,组间比较采用 t检验和方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 倒置显微镜下心肌成纤维细胞生长形态的改变
对照组细胞较大,胞浆丰富,呈梭形,细胞间连接丰富;醛固酮组细胞增生活跃,呈编织状,胞体增大,细胞生长密集。与醛固酮组比较,加入不同浓度苦参碱后,细胞生长受到不同程度的抑制,体积缩小,细胞数目明显减少,且随苦参碱浓度增大,生长抑制更加明显,部分细胞变圆,透光度减低(图1)。
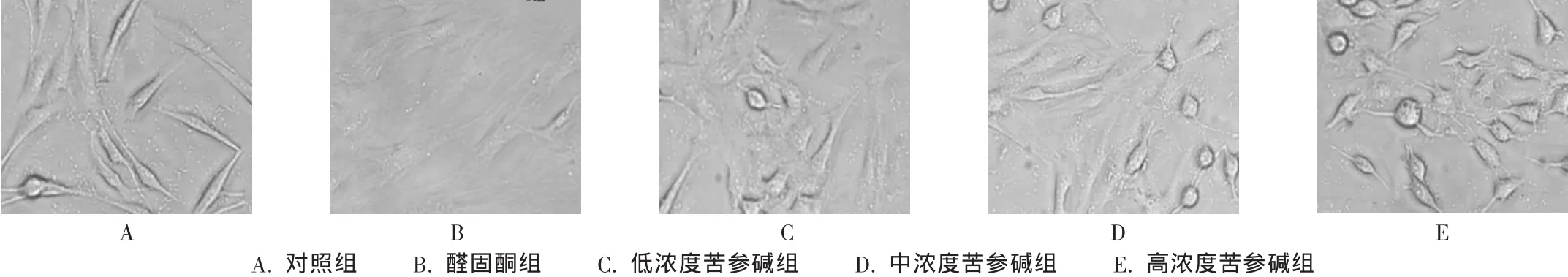
图1 各组心肌成纤维细胞生长形态(×200)
2.2 各组细胞增殖情况
A组MTT-OD值为0.2104±0.0221,B组为0.3696±0.0304,C组为0.3328±0.0304,D组为0.2718±0.0252,E组为0.1974±0.0152。可见,与对照组比较,醛固酮组MTT-OD值明显升高,提示醛固酮能明显促进心肌成纤维细胞增殖(P<0.01)。加入不同浓度的苦参碱后,MTT-OD值显著低于醛固酮组,且呈剂量依赖性,与醛固酮组比较差异有显著性意义(P<0.05)。
2.3 FCM分析心肌成纤维细胞的细胞周期改变
苦参碱对细胞周期的影响见表1和图2。加入醛固酮后,G0/G1期细胞百分比下降,S期、G2/M期细胞百分比升高(P<0.05),提示醛固酮促进了细胞由G0期向S期的转化。与醛固酮组比较,加入苦参碱后,G0/G1期细胞百分比升高,S期、G2/M期细胞百分比下降(P<0.01),表明细胞由G0期向S期的转化受到抑制。
2.4 苦参碱对心肌成纤维细胞羟脯氨酸含量的影响
羟脯氨酸含量可表示胶原合成情况,通过测定,羟脯氨酸含量A组为0.0445±0.0025,B组为0.0635±0.0045,C组为0.0385±0.0045,D 组为 0.0375±0.0005,E 组为 0.0225±0.0105。可见,醛固酮组细胞上清液中的羟脯氨酸含量明显高于对照组(P<0.05),表明醛固酮可显著提高心肌成纤维细胞的胶原分泌总量。与醛固酮组比较,苦参碱组细胞上清液中的羟脯氨酸含量都明显减少(P<0.01),并随着浓度的增高,羟脯氨酸含量减少更明显,呈剂量依赖效应。
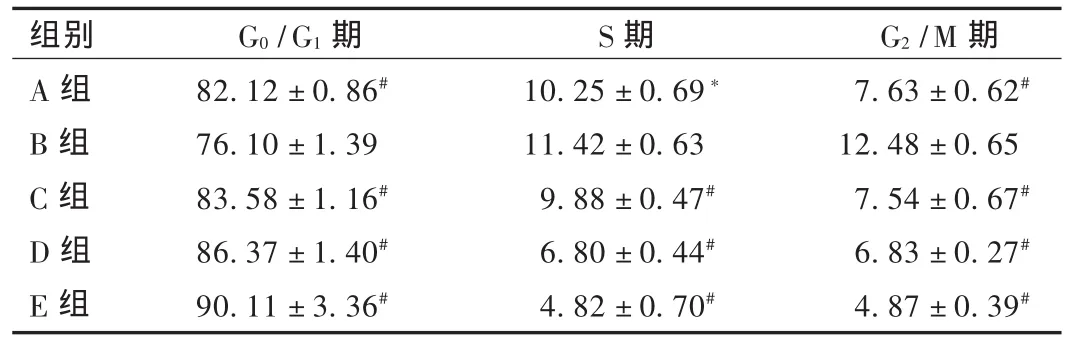
表1 各组心肌成纤维细胞的细胞周期分布(%)
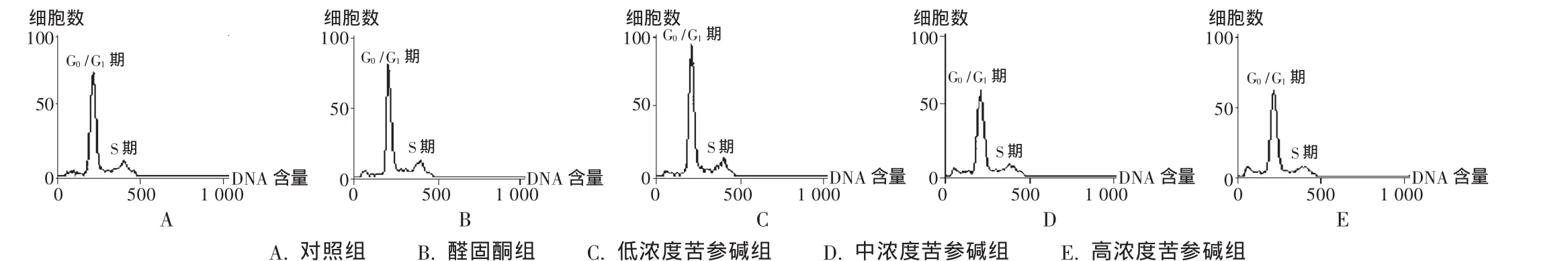
图2 FCM分析各组心肌成纤维细胞的细胞周期改变
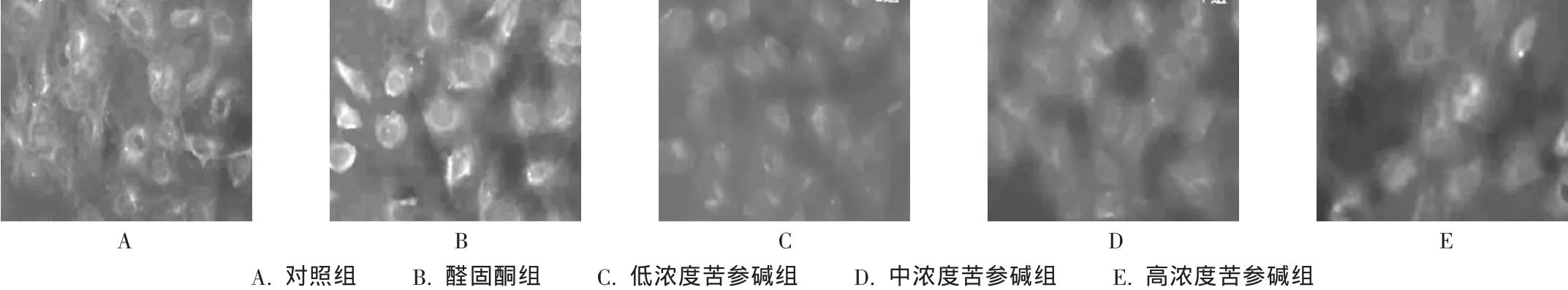
图3 细胞免疫荧光染色法检测TGF-β1蛋白表达(×400)
2.5 TGF-β1表达情况
采用细胞免疫荧光染色法,TGF-β1蛋白阳性信号染色呈绿色荧光,位于胞浆(图3)。醛固酮组的TGF-β1蛋白表达较对照组显著增加(P<0.01),且表达量随苦参碱剂量的增大而降低。流式细胞仪双标法的测定结果与细胞免疫荧光染色法一致(表2)。
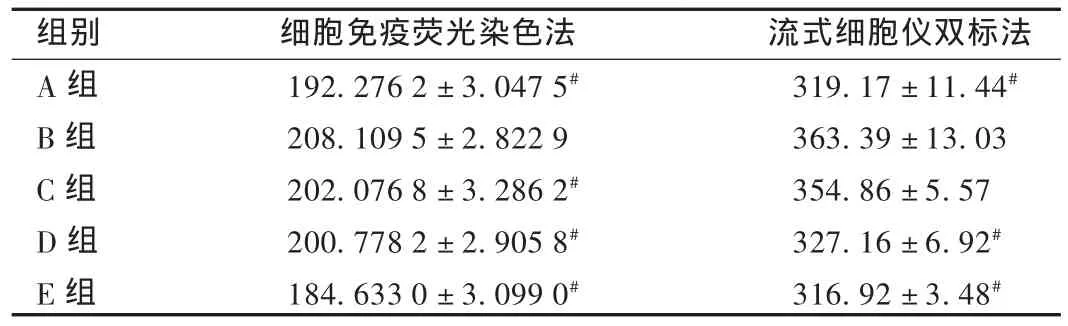
表2 苦参碱对心肌成纤维细胞TGF-β1蛋白表达的影响
3 讨论
苦参为豆科槐属植物,主要成分为苦参碱、氧化苦参碱等多种生物碱类,以及苦参醇、苦参丁醇等多种黄酮类。苦参中的生物碱成分能够抑制和逆转早期肝纤维化病变,并已取得了确切的临床疗效。苦参碱可拮抗血小板衍生生长因子和血管紧张素Ⅱ的作用而抑制心肌成纤维细胞、皮肤成纤维细胞、血管平滑肌增殖[2-3],还可通过调节多种与增殖、周期和凋亡相关基因的表达来抑制肿瘤细胞增殖或诱导分化与凋亡[4-6]。
本课题组既往的体外实验研究发现,苦参碱能剂量依赖性地抑制压力负荷因子血管紧张素Ⅱ诱导的离体心肌成纤维细胞的增殖,且与周期蛋白P27蛋白表达增强有关[7]。这提示苦参碱能抑制心肌间质纤维化,具有一定的抗心室重构作用。此外,高红宇等[8]发现,苦参素可下调TGF-β1和Ⅰ型胶原的表达,抑制肾小管上皮细胞转分化及肌成纤维细胞的活化与增殖,作用途径可能是通过下调Smad3的表达,干预Smad3介导的细胞内信号转导,最终减轻肾间质纤维化。但苦参碱对容量负荷醛固酮诱导的心肌成纤维细胞增殖及胶原代谢影响如何,TGF-β1在其中的作用还未见报道。
本试验结果显示,经醛固酮诱导心肌成纤维细胞增殖及胶原合成,苦参碱进行干预后,MTT-OD值、S期细胞百分比、羟脯氨酸含量均显著低于醛固酮组(P<0.01)。表明苦参碱具有很强的抑制容量负荷醛固酮诱导的心肌成纤维细胞增殖和胶原合成作用,并与浓度呈剂量效应关系,即具良好的抗心肌纤维化作用。
心脏中的TGF-β1主要由心肌细胞和心肌成纤维细胞产生,可促进多种基质成分合成,是多种生长因子诱导的心肌细胞及心肌成纤维细胞增殖的信号通路中的一个重要环节。TGF-β1作为成纤维细胞的强趋化因子,还可直接刺激其细胞外基质蛋白合成,促进心肌纤维化过程[9]。TGF-β1介导的信号通路主要有TGF-β1/Smad信号通路和非Smad信号通路。非Smad信号通路可活化Erk、JNK MAPK及RhoA,而TGF-β1/Smad信号通路是TGF-β促细胞增殖或分化的主要通路。本试验结果显示,苦参碱的抗纤维化作用可能与其下调TGF-β1蛋白表达有关。但具体的信号转导通路机制尚需进一步的研究。
[1]陆小龙,赵连友,郑强荪,等.拉西地平对AVP诱导的大鼠心脏成纤维细胞增殖的影响及其与ERK1/2的关系[J].心脏杂志,2008,20(2):32.
[2]伍严安,高春芳.苦参碱抑制血小板衍生生长因子诱导的小鼠皮肤成纤维细胞增殖[J].第二军医大学学报,2000,21(8):724-726.
[3]何立人.苦参碱对血管紧张素Ⅱ诱导的血管平滑肌增殖及超微结构的影响[J].上海中医药大学学报,1999,13(4):47.
[4]黄 建,陈康杰,张 卧,等.苦参碱抑制人大肠癌HT29细胞增殖及诱导凋亡作用与机制[J].中草药,2007,38(8):1 210.
[5]陆丽华,童锦禄,冉志华.氧化苦参碱对人结肠癌细胞株SW1116细胞周期通路相关调控因子的影响[J].胃肠病学,2008,13(7):398.
[6]陆丽华,冉志华.氧化苦参碱对人结肠癌细胞P21、P27、Cyclin E1及CDK2表达的影响[J].世界华人消化杂志,2007,15(12):1 353-1 357.
[7]周艳芳,黄培春,鲍 波,等.血管紧张素Ⅱ对心肌成纤维细胞增殖及p21,p27表达的影响[J].实用医学杂志,2005,21(11):1 129.
[8]高红宇,何晓峰,邵菊芳,等.苦参素对肾间质纤维化大鼠肾小管上皮细胞-间质转分化的影响[J].中国中西医结合杂志,2007,27(6):535.
[9]张月兰,程 颖,曾定尹,等.血管紧张素Ⅱ致小鼠心肌肥厚、心肌纤维化模型的建立[J].中国现代医学杂志,2006,16(24):3 716.
