国产与进口奥美拉唑肠溶胶囊在健康人体内的药代动力学和生物等效性研究
2010-11-06袁晓琼周远大
袁晓琼,杨 辉,周远大
(重庆医科大学附属第一医院,重庆 400016)
奥美拉唑(omeprazole)为苯并咪唑类化合物,能选择性抑制胃壁细胞膜的H+-K+-ATP酶活性,对于基础胃酸分泌和各种刺激引起的胃酸分泌具有强而持久的抑制作用,临床主要用于治疗胃溃疡、十二指肠溃疡、应激性溃疡、反流性食管炎和卓-艾综合征(胃泌素瘤)等[1-2]。奥美拉唑在酸性条件下不稳定,为避免其在胃中分解,故制成肠溶制剂。为评价国产制剂的质量,笔者参照相关文献建立了测定奥美拉唑血浆浓度的高效液相色谱法[3-5],比较了国产与进口奥美拉唑肠溶胶囊在健康人体内的药代动力学过程。
1 仪器与试药
Agilent1100系列高效液相色谱仪,Agilent1100泵系统,Agilent 1100可调波长紫外检测器和Agilent 1100工作站。受试制剂(T制剂)为重庆芸峰药业有限公司研制的奥美拉唑肠溶胶囊,规格为20 mg/粒,批号为050102,含量为100.4%;参比制剂(R制剂)为阿斯利康制药有限公司生产的奥美拉唑肠溶胶囊(商品名洛赛克),规格为20 mg/粒,批号为0502019;奥美拉唑对照品(重庆市华鼎现代生物制药有限责任公司);替硝唑(内标,中国药品生物制品检定所)。甲醇、乙腈为色谱纯,磷酸二氢铵为分析纯,所有试验用水均为重蒸馏水。
2 方法与结果
2.1 血药浓度测定
2.1.1 色谱条件
色谱柱:Phenomenex® C18柱(250 mm ×4.6 mm,5μm);固定进样环:100μL;流动相:甲醇-0.1 mol/L乙酸胺缓冲液-二乙胺(62 ∶38 ∶0.5);流速:0.8 mL/min;紫外检测波长:302 nm;柱温:室温。在此条件下,奥美拉唑与内标替硝唑及血浆中内源性杂峰分离良好(图 1)。
2.1.2 溶液配制
精密称取奥美拉唑13.45 mg,用适量甲醇溶解后,置25 mL量瓶中,加甲醇至刻度,混匀,即得质量浓度为538μg/mL的奥美拉唑标准贮备液。使用时以甲醇稀释为53.8μg/mL的奥美拉唑标准溶液。精密称取替硝唑标准对照品29.3 mg,用适量甲醇溶解,置50 mL量瓶中,加甲醇至刻度,混匀,即得质量浓度为586μg/mL的替硝唑标准贮备液。使用时以甲醇稀释为3.516μg/mL的替硝唑标准溶液。

2.1.3 血浆样品处理
取受试者血浆1.0mL,加入替硝唑标准溶液50μL和0.1mol/L氢氧化钠适量,混匀,加4 mL乙醚,旋摇1 min,静置,取乙醚层,于40℃水浴中用氮气吹干,加100μL流动相复溶,进样分析。
2.1.4 方法学考察
标准曲线制备:在空白血浆中添加奥美拉唑使血药浓度分别相当于 4.8,4.0,1.0,0.25,0.062 5,0.015 6,0.003 9 μg/mL,按血浆样品的处理与测定方法进行处理和测定,所得数据经回归,得标准曲线方程 Y=7.924 6 X-0.082 90,r=0.999 93(n=7)。
回收率及精密度试验:按照标准曲线制作方法,采用高、中、低3个质量浓度,结果血浆中奥美拉唑含量的回收率见表1,日内、日间相对标准差(RSD)见表2,最低定量质量浓度为0.003 9μg/mL,RSD=7.50%(n=5)。

表1 高效液相色谱法测定血浆中奥美拉唑含量的回收率(n=5)
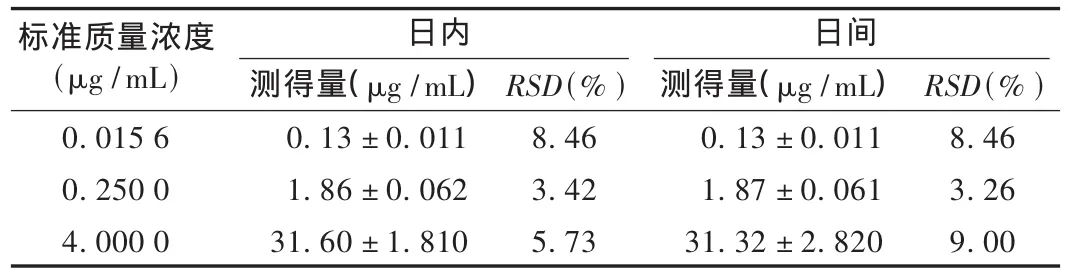
表2 日内和日间精密度测定结果(n=5)
稳定性试验:将奥美拉唑和替硝唑混合标准溶液于室温放置,0,5,10,24,48 h时进行测定,测得奥美拉唑质量浓度分别为0.14,0.14,0.14,0.15,0.13 μg/mL,平均(0.14 ±0.007 1)μg/mL,RSD=5.05%(n=5),结果表明室温放置48 h稳定性良好。将含药血浆反复冷冻(-20℃)、融化,按血浆样品的处理与测定方法进行处理和测定,3 d内测定5次,测得奥美拉唑质量浓度分别为0.41,0.38,0.41,0.40,0.42μg/mL,平均(0.40±0.0152)μg/mL,RSD=3.75%(n=5),结果表明血浆样品3 d内反复冻融稳定性良好。
2.2 血药浓度测定方法与结果
20名健康志愿者均为男性,年龄(22.8±2.09)岁,体重(61.2±6.5)kg,身高(168.5±5.41)cm,经血尿常规、肝肾功能及心电图检查均示健康,且试验前2周内未服任何药品,均签署知情同意书并经本院伦理委员会批准。随机分成两组,每组10名,分别单剂量给予进口或国产奥美拉唑 60 mg,在给药后 0.5,1,2,3,4,5,6,8,10,12,24 h 各取前臂静脉血3 mL,离心分离血浆0.5mL,于-18℃保存待测。20名受试者用药后各时间点平均血药浓度-时间曲线见图2。
2.3 药代动力学参数
健康志愿者不同时间测得的血药浓度数据用3P97程序经计算机迭代拟合,结果显示两种奥美拉唑肠溶胶囊分别口服60 mg后的体内过程均符合一室开放模型(表3),两种肠溶胶囊主要药代动力学参数经统计检验无显著性差异(P>0.05)。结果表明,国产奥美拉唑肠溶胶囊在健康人体内的药代动力学过程与进口制剂相似,主要药代动力学参数与文献报道一致[4]。
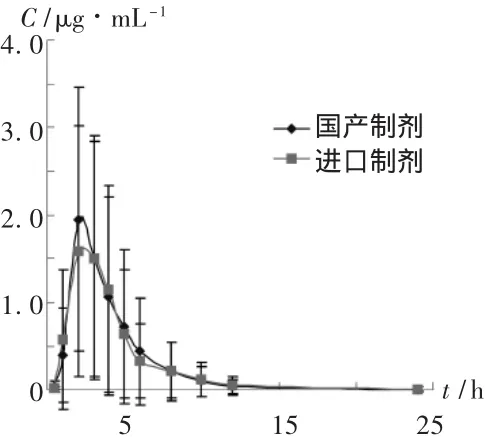
图2 受试者用药后各时间点平均血药浓度-时间曲线图

表3 两种奥美拉唑肠溶胶囊的药代动力学参数比较(n=20)
2.4 生物等效性评价
将 AUC0-∞,tmax,Cmax分别经三因素方差分析,国产与进口制剂间、周期间差异均不显著(P>0.05)。国产制剂与进口制剂的 AUC0-∞分别为(7.31±6.98)μg·h/mL 和(7.10±6.45)μg·h/mL,国产制剂相对生物利用度为(103.61±16.14)%。方差分析结果经对数转换,两种制剂间无显著差异,F(1,18)=0.208 5,P>0.05;双单侧 t检验 t1=6.338,t2=5.424,等效;(1-2α)置信区间为[95.3%,108.7%],等效。国产制剂与进口制剂的 AUC0-t分别为(7.18±6.86)μg·h/mL 和(6.93±6.37)μg·h/mL,国产制剂相对生物利用度为(95.54±10.99)%。方差分析结果经对数转换,两种制剂间无显著差异,F(1,18)=0.453 4,P >0.05;双单侧 t检验 t1=6.917,t2=5.570,等效;(1-2α)置信区间为[96.3% ,109.0%],等效。国产制剂与进口制剂的 Cmax分别为(2.19±1.53)μg/mL和(2.13±1.48)μg/mL。方差分析结果经对数转换,两种制剂间无显著差异,F(1,18)=0.057 2,P >0.05;双单侧 t检验 t1=2.839,t2=2.361,等效;(1-2α)置信区间为[88.0%,118.5%],等效。国产制剂与进口制剂的 tmax分别为(2.30±0.73)h和(2.20±0.89)h,经非参数统计方法(Wilcoxon法)进行统计分析,两种制剂间无显著差异(P>0.05)。结果表明,两种肠溶胶囊为生物等效制剂。
3 讨论
奥美拉唑经肝细胞P450酶系催化代谢,主要代谢途径为羟化代谢。从血药浓度测定结果可以看出,奥美拉唑在体内消除迅速,受试者血药浓度个体差异较大,其原因可能是人群中存在着与 s-美芬妥英代谢表型相关的羟化代谢多态性,表现为某些个体对药物的羟化代谢能力低下或发生缺陷,使原型药物消除减慢,消除半衰期延长和 AUC明显增加,从而使个体差异增大。由于奥美拉唑的疗效与血药浓度之间无直接关系,因此这两种制剂的临床疗效比较有待于进一步研究。
[1]聂浩鸿,田维霞.克拉霉素与奥美拉唑、阿莫西林联合治疗慢性胃炎82例[J].中国药业,2008,17(9):55.
[2]古 莉,邓德明.凝血酶加奥美拉唑治疗残胃出血40例[J].中国药业,2008,17(11):60.
[3]王乐群,马长清.高效液相色谱法测定奥美拉唑肠溶胶囊的含量[J].中国药师,2008,11(6):656-657.
[4]陈少波,吴定国.高效液相色谱法测定健康人血浆中奥美拉唑的浓度[J]. 医药导报,2006,25(10):999-1 000.
[5]邓 鸣,张晓丽,侯艳宁.高效液相色谱法测定人血浆中奥美拉唑浓度[J].中国药事,2006,20(12):759-761.
