聚乙烯亚胺介导基因转染的影响因素研究
2010-11-06周鹏,张瑜
周 鹏,张 瑜
(1.广东省深圳龙珠医院,广东 深圳 518055;2.新疆维吾尔自治区人民医院高血压科,新疆 乌鲁木齐 830001)
基因转染是指利用基因载体携带目的基因运送到细胞内的方法。目前在基因治疗中,由于病毒载体存在着诸多缺陷[1],非病毒载体如阳离子脂质体和阳离子共聚物越来越受到重视[2-3]。其中聚乙烯亚胺(polyethylenimine,PEI)是目前研究较多的聚阳离子型基因载体[4],富含氨基,可与DNA链上负电性的磷酸根通过静电作用缔合成复合物。在此过程中,DNA会被高度压缩成50~200 nm大小的纳米球[5],大大增强了对细胞膜的穿透作用,因此具有较高的转染效率[6]。但PEI作为非病毒基因载体,其转染效率的影响因素较多,重复性不好。笔者考察了影响其转染效率的因素,从而筛选出较优的转染条件,为进一步的研究打下基础。
1 实验材料
PEI(相对分子质量为25 000,支链型,无水,Aldrich-Sigma公司)。人宫颈癌细胞系Hela细胞(ATCCNo.CCL-2.1),在100 mL/L胎牛血清的RPMI 1640培养基中培养,血清56℃灭活30 min。真核表达质粒编码增强型绿色荧光蛋白(theenhanced green fluorescent protein,pEGFP-C1,华西医科大学惠赠),由CMV启动子驱动,在DH5α菌株中大量扩增。由QIAGEN公司的质粒大抽提试剂及纯化柱制备质粒,酶切鉴定。
2 方法与结果
2.1 PEI/DNA复合物的制备及其形态观察
氮磷比(N/P)为聚合物中的氨基基团与DNA中的磷酸基团的物质的量之比。根据N/P,将聚合物的磷酸盐缓冲液与质粒DNA的磷酸盐缓冲液混合,涡旋,室温静置30 min,获得聚合物-DNA复合物。取适量滴加在铜网上,用醋酸铀进行负染,干燥后置透射电镜下观察复合物胶束的形态。由图1可见,各PEI-DNA复合物纳米粒呈规则的球形,粒子大小分布较均一,表明二者已形成复合物纳米粒。
2.2 质粒量对转染效率的影响

图1 PEI-DNA纳米复合物的透射电镜图谱(N/P=20)
将Hela细胞接种到12孔板上,每孔1.5×105个细胞,培养24h,细胞汇合度不低于70%,将PEI与DNA分别在磷酸盐缓冲液中配成一定浓度的溶液。设质粒剂量分别为每孔 0.5,1,2,3,4 μg,然后将两者按N/P=10混合,涡旋,室温静置20 min。转染前吸去细胞培养液,加入不含血清的RPMI 1640培养液1 mL,再每孔加入100~200μL的PEI-DNA复合物,细胞培养箱中培养4 h后,吸去转染复合物,加入新鲜的含100 mL/L胎牛血清的RPMI 1640培养液继续培养40~48 h,然后用磷酸盐缓冲液冲洗,再用0.25 g/L胰酶-乙二胺四乙酸消化液将细胞消化下来,用磷酸盐缓冲液重悬细胞,转染率通过在流式细胞仪上测定每10 000个细胞中发荧光的细胞百分数获得。结果如图2所示,在12孔板中,当每孔质粒量少于2μg时,转染率较低;当质粒量达到每孔2μg后,继续增加质粒量,转染率反而下降。因此12孔板质粒的用量以每孔2μg较适宜。
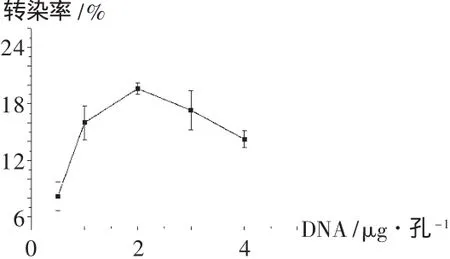
图2 不同质粒量对转染率的影响
2.3 复合物形成时间对转染效率的影响
将Hela细胞接种到12孔板上,每孔1.5×105个细胞,培养24h,细胞汇合度不低于70%,将PEI与DNA分别在磷酸盐缓冲液中配成一定浓度的溶液,按转染质粒量为每孔2μg,N/P=10混合,涡旋,室温静置 10,20,30,40,50 min。转染前吸去细胞培养液,加入不含血清的RPMI 1640培养液1 mL,再每孔加入100~200μL的PEI-DNA复合物,细胞培养箱中培养4 h后,吸去转染复合物,加入新鲜的含100 mL/L胎牛血清的RPMI 1640培养液继续培养40~48 h,收集细胞,转染率通过在流式细胞仪上测定每10 000个细胞中发荧光的细胞百分数获得。复合物形成时间是PEI上的正电荷与DNA上负电荷相互作用形成球状纳米粒的时间,时间过短不能充分形成球状纳米粒,时间过长纳米粒容易沉淀影响转染效率。由图3可见,复合物形成时间以30 min为宜。
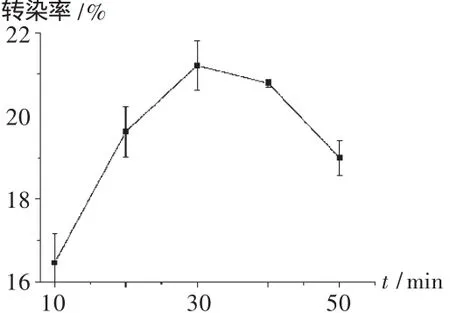
图3 复合物形成时间对转染率的影响
2.4 复合物与细胞作用时间对转染率的影响
将Hela细胞接种到12孔板上,每孔1.5×105个细胞,培养24 h,细胞汇合度不低于70%,将PEI与DNA分别在磷酸盐缓冲液中配成一定浓度的溶液,按转染质粒量为每孔2μg,N/P=10混合,室温静置30 min,转染前吸去细胞培养液,加入不含血清的RPMI 1640培养液1 mL,再每孔加入100~200μL的PEI-DNA复合物,细胞培养箱中培养3,4,5,6 h后,吸去转染复合物,加入新鲜的含100 mL/L胎牛血清的RPMI 1640培养液继续培养40~48 h,收集细胞,转染率通过在流式细胞仪上测定每10 000个细胞中发荧光的细胞百分数获得。转染复合物需与细胞作用一定时间,使其与细胞充分接触,进入细胞内,但复合物作用时间较长时,细胞死亡较多,对转染不利。由图4可见,转染复合物与细胞作用4 h时转染效率较高。
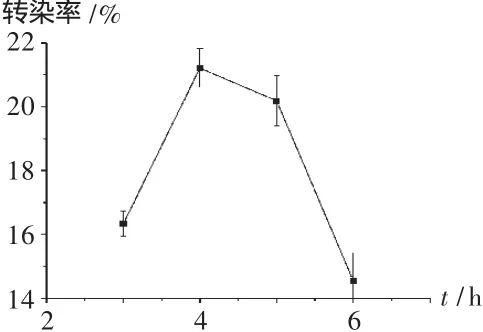
图4 复合物在细胞上的作用时间对转染率的影响
2.5 N/P对转染效率的影响
将Hela细胞接种到12孔板上,每孔1.5×105个细胞,培养24 h,细胞汇合度不低于70%,将PEI与DNA分别在磷酸盐缓冲液中配成一定浓度的溶液,按转染质粒量为每孔2μg,N/P=10,15,20,25,30 混合,室温静置 30 min,转染前吸去细胞培养液,加入不含血清的RPMI 1640培养液1 mL,再每孔加入100~200μL的PEI-DNA复合物,细胞培养箱中培养4 h后,吸去转染复合物,加入新鲜的含100 mL/L胎牛血清的RPMI 1640培养液继续培养40~48 h,收集细胞,转染率通过在流式细胞仪上测定每10 000个细胞中发荧光的细胞百分数获得。PEI介导的基因转染率与N/P比值的关系极大。笔者考察了N/P为 10,15,20,25,30 时对 PEI转染Hela的影响。如图5所示,N/P=20时被转染细胞增强型绿色荧光蛋白(EGFP)阳性效率最高。
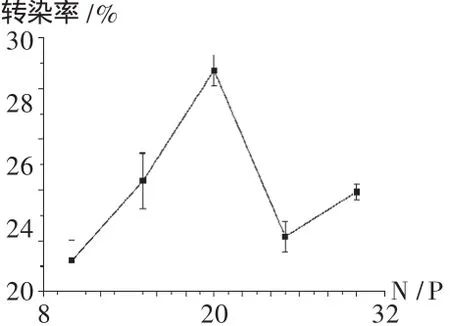
图5 不同N/P对转染率的影响
3 讨论
PEI是目前研究较为广泛的聚阳离子基因载体,其每3个基团含有1个氨基,有丰富的阳离子电荷,可缩合DNA呈颗粒状。PEI-DNA复合物通过静电作用吸附到细胞表面[7],被动内吞,进入细胞内。制备PEI-DNA复合物方法简单,转染效率不亚于各种商业化的体外转染剂[8]。PEI可作为一种结合DNA的骨架,偶联上导向配体、核定位信号肽等,合成更复杂的DNA非病毒载体释放系统,用于体内基因治疗。但影响PEI转染效率的因素较多,如质粒量、复合物形成时间、转染复合物与细胞作用时间、N/P等。其中N/P对转染的影响最大,N/P增加时,阳性细胞比例增加,细胞毒性也增加,根本原因在于PEI的用量增加。本试验发现,当N/P较低时,PEI-DNA复合物的转染效率随N/P增加而增加,当N/P增加到一定值后,细胞毒性增加明显,死亡细胞急剧增加,转染效率反而下降。
由本研究结果可知,PEI介导的基因转染Hela细胞较优的转染条件为质粒量2μg,复合物形成时间30 min,复合物在细胞上作用4 h,N/P=20。此转染条件可为进一步的体内研究打下基础。
[1]Kaneda Y.New vector innovation for drug delivery:Development of fusigenic non-viral particles[J].Curr Drug Targets,2003,4(8):599-602.
[2]Shimizu K,Ito A,Arinobe M,et al.Effective cell-seeding technique using magnetite nanoparticles and magnetic force onto decellularized blood vessels for vascular tissue engineering[J].J Biosci Bioeng,2007,103(5):472-478.
[3]Tang T,Zheng JW,Chen B,et al.Effects of targeting magnetic drug nanoparticles on human cholangiocarcinoma xenografts in nude mice[J].Hepatobiliary Pancreat Dis Int,2007,6(3):303-307.
[4]Merdan T,Kopecek J,Kissel T.Prospects for cationic polymers in gene and oligonucleotide therapy against cancer[J].Adv Drug Deliv Rev,2002,54(5):715-758.
[5]Kakizawa Y,Kataoka K.Block copolymer micelles for delivery of gene and related compounds[J].Adv Drug Deliv Rev,2002,54(2):203-222.
[6]Brokx R,Gariépy J.Peptide- and polymer-based gene delivery vehicles[J].Methods Mol Med,2004,90(1):139-160.
[7]Cryan SA,O'Driscoll CM.Mechanistic studies on nonviral gene delivery to the intestine using in vitro differentiated cell culture models and an in vivo rat intestinal loop[J].Pharm Res,2003,20(4):569-575.
[8]杨耀武,张 莹,王健伟,等.用聚乙烯亚胺反向转染siRNA表达盒进行RNA干扰的研究[J].生物技术通讯,2006,17(2):133-137.
