猪γ干扰素的表达及其抗病毒活性的安全检测
2010-10-16贺番孙元葛金英李淼常天明步志高仇华吉
贺番,孙元,葛金英,李淼,常天明,步志高,仇华吉
1 中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室,哈尔滨 150001
2 内蒙古农业大学动物科学与医学学院,呼和浩特 010018
猪γ干扰素的表达及其抗病毒活性的安全检测
贺番1,2,孙元1,葛金英1,李淼1,常天明1,步志高1,仇华吉1
1 中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室,哈尔滨 150001
2 内蒙古农业大学动物科学与医学学院,呼和浩特 010018
为了提高干扰素抗病毒活性测定的生物安全性,本研究使用含有 GFP的复制缺陷型水疱性口炎病毒(VSV△G*G)为指示病毒,分别对经原核表达系统和杆状病毒表达系统表达的重组猪γ干扰素(PoIFN-γ)在MDBK细胞上进行抗病毒活性测定。结果显示:由杆状病毒表达的重组PoIFN-γ具有高度抗病毒活性,其抗病毒活性为105IU/mL,原核表达的重组PoIFN-γ纯化后经缓慢复性也会产生一定的抗病毒活性,其抗病毒活性为32 IU/mL。该方法与利用表达 GFP的重组水疱性口炎病毒(VSV*GFP)所检测的干扰素抗病毒活性结果完全一致,表明复制缺陷型病毒VSV△G*G可作为复制型重组病毒的替代品,使得干扰素抗病毒活性检测更加安全、准确。
猪γ干扰素,杆状病毒,抗病毒活性检测
Abstract:In order to ensure the biosafty of the IFN-γ antiviral activity assay, we used a replication-deficient VSV carrying GFP as an interferon sensitive indicator virus(VSV△G*G).The antiviral activities of porcine IFN-γ expressed inEscherichia coliand in baculovirus on MDBK cells were assessed.The results showed that the antiviral activity of porcine IFN-γ expressed in baculovirus could reach 105IU/mL, while the porcine IFN-γ expressed inE.colishowed some antiviral activity(32 IU/mL)after refolding.The results of the VSV△G*G-based antiviral assay were almost identical to that of the VSV*GFP-based assay, suggesting it is highly feasible to use VSV△G*G as a substitute for VSV*GFP, making assays for IFN-γ antiviral activity safer and more accurate.
Keywords:porcine interferon-γ, baculovirus, antiviral activity
干扰素(Interferon,IFN)是在特定的诱生剂作用下,由细胞产生的一种具有高度生物活性的糖蛋白,在同种动物细胞上具有广谱抗病毒活性。1957年,Isaacs等首先发现病毒感染的细胞能产生一种因子,作用于其他细胞能干扰病毒的复制,因而命名为干扰素[1]。目前已知干扰素并不能直接杀伤病毒,而是诱导宿主细胞产生数种酶,干扰病毒的基因转录或病毒蛋白组分的翻译。根据产生干扰素细胞的来源不同、理化性质和生物学活性的差异,可分为Ⅰ型和Ⅱ型IFN,Ⅰ型IFN主要包括IFN-α、β、ω、δ、κ、ε、ξ和 τ等,Ⅱ型 IFN 只有 IFN-γ一种[2]。IFN-γ主要由机体内活化的T淋巴细胞和NK细胞产生[3]。当抗原、PHA或ConA刺激后T细胞分泌产生IFN-γ,通常与IL-2的产生相一致。IFN-γ对酸敏感,具有抑制病毒复制调节作用,但其抗病毒作用比Ⅰ型干扰素弱[4],主要参与诱导主要组织相容性抗原(MHC)的表达和免疫调节效应,也称为免疫干扰素。
猪γ干扰素(PoIFN-γ)的编码基因为501 bp,编码 166个氨基酸,前 23个氨基酸为信号肽,后143个氨基酸为成熟活性蛋白,天然活性状态为同源二聚体的糖蛋白,单体没有生物学活性[5]。由于IFN-γ具有独特的免疫调节功能和抗肿瘤作用,是机体细胞免疫评价的重要指标之一,故其在疾病的诊断、治疗和预防等方面具有广阔的应用前景。1981年,Godkin等首先将 IFN-γ基因克隆成功[6]。1990年,Dijikmans等克隆了含内含子的PoIFN-γ基因[7]。随后,Vandenbroeck等分段克隆了 PoIFN-γ基因的外显子并将其拼接为完整基因后在大肠杆菌[8]和昆虫细胞[9]中进行了表达。1999年Cencic等在兔肾细胞中表达了 PoIFN-γ[10]。国内研究者也先后利用不同表达系统表达了PoIFN-γ,但抗病毒活性较低或不具有活性[11-14]。
干扰素生物学活性定量分析的研究从干扰素被发现以来就一直没有间断过。抗病毒分析方法(Antiviral assay,AVA)是第一个建立起来的检测IFN样品相对活性或效能的生物学方法[15]。现有的干扰素生物学活性鉴定与定量分析方法普遍存在费时、繁琐、不够精确、特异性差等一系列缺陷,亟待改进。近年来我国有研究者利用表达绿色荧光蛋白(GFP)的重组水疱性口炎病毒(Vesicular stomatitis virus)(VSV*GFP)[16]以及MDBK-Mxp-luc细胞系来检测牛β干扰素的抗病毒活性[17],使检测过程更加便捷、准确。
将外源提供的病毒囊膜蛋白包装在缺失编码相同蛋白基因病毒的核酸上所形成的病毒,称为复制缺陷型病毒。复制缺陷型病毒具有安全性好、易于检测、宿主范围广泛等优点,虽然其缺少复制能力,但是在研究病毒进入过程、受体鉴定、中和抗体检测、疫苗评价等方面具有重要作用。本研究利用表达GFP的复制缺陷型VSV(VSV△G*G)[18]代替复制型重组病毒VSV*GFP,通过对大肠杆菌和重组杆状病毒表达的PoIFN-γ在MDBK细胞上进行抗病毒生物活性测定,建立了一种干扰素生物学活性定量分析方法,该方法与利用重组 VSV*GFP病毒的抗病毒活性检测方法所测定结果完全符合,且比后者更为安全、准确。
1 材料和方法
1.1 材料
PoIFN-γ编码基因由上海英骏生物有限公司合成(含6个His标签的编码序列,以便于蛋白的纯化)。原核表达质粒 pET-30a(+)、杆状病毒转移载体pFastBacHT B及感受态DH10BacTM受体菌及转染试剂(Cellfectin reagent)购于美国Invitrogen公司。质粒pVSV-G、Sf9细胞、MDBK细胞均由本实验室保存。PoIFN-γ单抗购自SANTA公司,荧光素(FITC)标记的羊抗鼠荧光二抗、抗 His标签单抗、辣根过氧化物酶(HRP)标记的羊抗鼠 IgG购自 Sigma公司。VSV*GFP及VSV△G*G参见文献报道[16,18]。
1.2 原核表达重组PoIFN-γ蛋白在大肠杆菌中的表达、纯化和鉴定
1.2.1 重组蛋白的表达
将合成的PoIFN-γ基因经BamH I和Hind III限制酶双酶切后克隆于原核表达质粒 pET-30a(+)的相应位点,PoIFN-γ基因阅读框架与His标签融合。鉴定正确后转化BL21,用IPTG诱导,进行SDS-PAGE分析。
1.2.2 原核表达重组蛋白的鉴定
参照文献[19]方法进行Western blotting鉴定。一抗为PoIFN-γ单抗和抗His标签单抗(用PBS溶液分别做1:100和1:3000稀释),二抗为红外荧光抗鼠二抗和辣根过氧化物酶标记的羊抗猪IgG(1:4000稀释),利用红外荧光扫描仪检测结果和用DAB显色。
1.2.3 重组蛋白的纯化
根据His·Bind纯化试剂盒说明书,利用Ni2+树脂柱对大肠杆菌表达的重组PoIFN-γ(His-PoIFN-γ)进行纯化。
1.3 PoIFN-γ基因在昆虫杆状病毒系统中的表达及鉴定
1.3.1 重组杆粒的获得
将合成的PoIFN-γ基因经BamH I和Aat Ⅱ限制酶双酶切后克隆于杆状病毒转移载体pFastBacHT B的相应位点,获得重组转移载体 pFB-PoIFN-γ。转化大肠杆菌 DH10BacTM感受态细胞得到重组杆粒rBacmidPoIFN-γ,利用M13通用引物对其进行PCR鉴定。
1.3.2 重组病毒的获得
参照Cellfectin reagent试剂盒说明书,将鉴定为阳性的rBacmidPoIFN-γ转染 Sf9细胞,获得的重组杆状病毒rBacPoIFN-γ上清,提取基因组后利用M13通用引物对其进行PCR鉴定。扩大培养rBacPoIFN-γ,将细胞超声波破碎进行Western blotting检测。
1.3.3 杆状病毒表达蛋白的鉴定
参照文献[19]方法进行间接免疫荧光试验(IFA)与 Western blotting鉴定。一抗为抗 PoIFN-γ单抗,间接免疫荧光试验二抗为 FITC标记羊抗猪IgG,Western blotting二抗为红外荧光抗鼠二抗,利用红外荧光扫描仪检测结果。
1.4 重组PoIFN-γ抗病毒活性测定与比较
按文献报道的方法[20],用VSV*GFP/MDBK细胞系统测定重组 PoIFN-γ抗病毒活性,以 2×104细胞/孔的密度将MDBK细胞铺于96孔板,待细胞贴壁后,加入101~108不同稀释度的rBacPoIFN-γ感染Sf9细胞上清(含有重组 PoIFN-γ)以及倍比稀释后的经纯化、缓慢复性的原核表达的 His-PoIFN-γ,37℃作用过夜,同时设不加重组蛋白的孔为对照。100 PFU/孔VSV*GFP感染细胞,1 h后换完全培养液,24 h后荧光显微镜观察结果,以荧光亮度为对照孔50%的最高稀释度为抗病毒活性单位(IU)。
1.5 VSV△G*G的制备及毒价测定
采取脂质体转染法用4 µg表达VSV G蛋白的质粒pVSV-G转染BHK21细胞,转染后6 h更换培养基。20 h后用复制缺陷型水疱性口炎病毒(VSV△G*G)进行转导,24 h后收集细胞上清,3000 r/min离心10 min以清除细胞碎片,测定毒价。
1.6 利用 VSV△G*G 检测重组 PoIFN-γ抗病毒活性
按照文献报道的方法[20],将 MDBK细胞铺于96孔板,待细胞贴壁后,加入 101~108不同稀释度的重组 PoIFN-γ(rBacPoIFN-γ感染 Sf9 细胞上清),以及倍比稀释后的经纯化、缓慢复性的His-PoIFN-γ,37℃作用过夜。100 PFU/孔VSV△G*G感染细胞,1 h后换完全培养液,24 h后荧光显微镜观察结果,以荧光亮度为对照孔50%的最高稀释度为抗病毒活性单位(IU)。
1.7 相对荧光强度测定
按照 1.6中的方法分别利用 VSV*GFP和VSV△G*G对不同稀释度的重组PoIFN-γ进行抗病毒活性检测。用以上两种病毒转导MDBK细胞24 h后,用裂解液将细胞处理30 min,取200 µL置于96孔读数板中,在 FLX800-Microplate Fluorescence Reader(Bio-TEK公司产品)上测定每孔中的相对荧光强度。
2 结果
2.1 PoIFN-γ基因在大肠杆菌中的表达
用抗His标签单抗进行Western blotting,结果表明原核表达的His-PoIFN-γ蛋白大小为25 kDa,与预期结果相符。同时设含有 His标签的无关蛋白为阳性对照,pET-30a(+)空载体转化菌为阴性对照。利用PoIFN-γ单抗的Western blotting结果进一步证实目的蛋白获得表达(图1、2)。

图1 用抗His标签单抗对His-PoIFN-γ蛋白进行Western blotting分析Fig.1 Western blotting analysis of His-PoIFN-γ protein with anti-His-tag McAb.M: PageRulerTMprestained proteinladder;1: purified His-PoIFN-γ protein; 2: irrelevant E2 protein with His-tag served as the positive control; 3: pET-30a vectortransformedE.colicells served as the negative control.
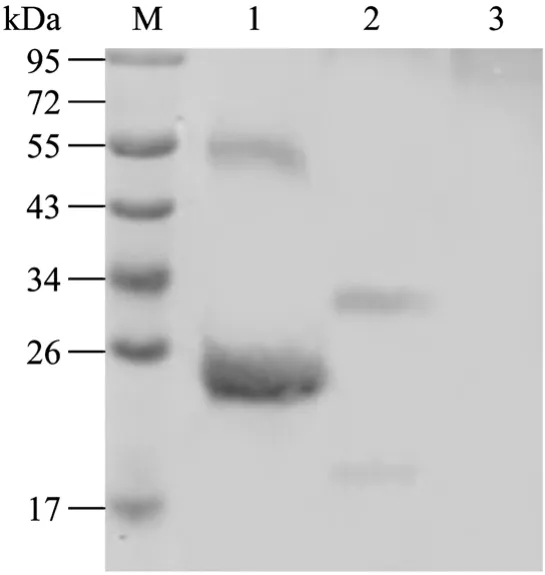
图2 用抗 PoIFN-γ单抗对重组 PoIFN-γ进行 Western blotting分析Fig.2 Western blotting analysis of recombinant PoIFN-γ with anti PoIFN-γ McAb.M: PageRulerTMprestained protein ladder;1: His-PoIFN-γ protein after purification served as the positive control; 2: Baculovirus-expressed recombinant PoIFN-γ protein;3: Baculovirus-expressed recombinant E2 protein of CSFV as the negative control.
2.2 PoIFN-γ基因在昆虫细胞中的表达
将重组杆状病毒 rBacPoIFN-γ接种 Sf9细胞,72 h内细胞病变完全,收集细胞进行破碎,12 000 r/min离心 10 min以去除细胞碎片,进行Western blotting检测。
结果表明,原核表达的His-PoIFN-γ经正确的纯化、缓慢复性后可恢复有活性的二聚体形式(图2),之后的抗病毒活性检测也进一步证实了该结论。杆状病毒表达的重组PoIFN-γ主要以二聚体形式存在,大小为34 kDa与预期结果相符(图2),超声裂解可少量破坏其二聚体形式。
2.3 IFA检测PoIFN-γ在昆虫细胞中的表达
分别以rBacPoIFN-γ感染Sf9细胞,至细胞病变达 90%时将细胞固定,用 1:100稀释的抗 PoIFN-γ单抗进行IFA检测,同时以1:100稀释的抗猪瘟E2蛋白的单抗为阴性对照。结果显示,抗 PoIFN-γ单抗检测rBacPoIFN-γ感染Sf9细胞显示阳性荧光信号(图3A),而抗猪瘟 E2蛋白的单抗则荧光信号为阴性(图3B),表明PoIFN-γ在昆虫细胞中获得表达。
2.4 重组PoIFN-γ的抗病毒活性
利用 VSV*GFP/MDBK系统测定重组 PoIFN-γ抗病毒活性,以不同浓度杆状病毒表达重组PoIFN-γ上清以及原核表达纯化后 PoIFN-γ作用 MDBK细胞,37℃过夜,感染VSV*GFP,24 h后观察结果。结果显示,未加重组 PoIFN-γ空白对照,细胞出现细胞病变,103倍稀释可以完全抑制VSV*GFP的复制,细胞无明显细胞病变,且无荧光出现,104和105倍稀释部分抑制 VSV*GFP的复制,106倍稀释几乎不能抑制VSV*GFP的复制,105倍稀释组的荧光亮度约为空白对照组的一半,测得其抗病毒活性为105IU/mL(图4A);用相同浓度杆状病毒表达的猪瘟病毒E2蛋白上清作用MDBK细胞的对照组细胞也出现典型的细胞病变同时可观察到大量荧光(图4B);只用重组PoIFN-γ处理的MDBK细胞状态良好,无细胞病变,与正常MDBK细胞无差异(图5A)。而原核表达的HisPoIFN-γ在稀释32倍后则完全失去抗病毒活性,表明 PoIFN-γ的空间结构对其生物学活性会产生很大影响。
2.5 利用复制缺陷型病毒检测重组PoIFN-γ抗病毒活性
利用复制缺陷型病毒 VSV △ G*G/MDBK 系统重新对重组 PoIFN-γ抗病毒活性进行测定,期望找到一种更加安全、准确的检测方法。结果表明,利用复制缺陷型病毒测定重组 PoIFN-γ的抗病毒活性与利用重组病毒 VSV*GFP所测定的结果完全一致(图6)。复制缺陷型病毒作为复制型重组病毒的替代品也会引起细胞病变(图5B)。
2.6 两种病毒检测PoIFN-γ抗病毒活性的比较
通过检测相对荧光强度比较不同稀释度重组PoIFN-γ在 VSV*GFP/MDBK 和 VSV △ G*G/MDBK系统的抗病毒活性,结果表明,两种系统的测定结果尽管存在差异,但总体趋势一致(图7),说明复制缺陷型病毒能够作为复制型重组病毒的替代品用于抗病毒活性检测。
3 讨论

图3 用IFA检测重组杆状病毒感染Sf9细胞中的PoIFN-γ表达情况Fig.3 Detection of the PoIFN-γ expression in Sf9 cells infected with the recombinant baculovirus rBacPoIFN-γ.(A)Sf9 cells infected with rBacPoIFN-γ expressing PoIFN-γ.(B)Sf9 cells infected with the recombinant baculovirus expressing E2 protein served as the negative control.
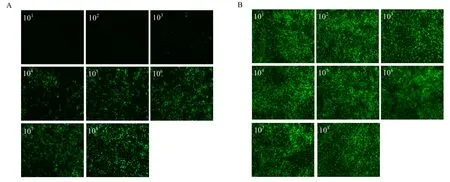
图4 不同浓度重组杆状病毒表达的重组PoIFN-γ抑制VSV*GFP在MDBK细胞上复制Fig.4 Inhibition of the replication of VSV*GFP in MDBK cells with differently diluted recombinant PoIFN-γ expressed from recombinant baculovirus.(A)Baculovirus-expressed recombinant PoIFN-γ at different dilutions.(B)Baculovirus-expressed recombinant E2 protein of CSFV at different dilutions.
干扰素一直是病毒学、细胞学、分子生物学、临床医学、免疫学、肿瘤学等相关领域的研究热点。干扰素与特异性抗体不同,其主要发挥的是抗病毒感染效力。对干扰素进行AVA检测时需要用干扰素提前24 h处理细胞,诱导细胞产生数种酶,以抵抗病毒的感染,进一步干扰病毒的基因转录或病毒蛋白组分的翻译,从而达到抑制病毒复制的作用。如果说中和试验是利用中和抗体将病毒中和,从量上减少病毒的感染能力;干扰素就是从质上对细胞产生作用,使其抗感染能力增强。
IFN-γ单体没有生物学活性,其天然活性形式为两条单体链结合形成的同型二聚体形式,它能诱导巨噬细胞产生细胞因子,具有免疫调节功能,是机体细胞免疫的重要检测指标之一,在疾病的诊断、治疗和预防等方面具有广阔的应用前景。IFN-γ基因在正常情况下处于抑制状态,只有在某些刺激因子的刺激下才能表达,同时IFN-γ产量低、纯化困难、成本比较高,难以大量制备,随着基因工程技术的迅速发展,可以利用该技术大量制备IFN-γ。目前广泛采用的原核表达系统虽然可以将 IFN-γ蛋白大量表达,但是纯化、复性工艺复杂,而且表达产物在结构、生物学活性与真正天然干扰素相比存在明显差距。昆虫杆状病毒表达系统具有与高等真核细胞类似的蛋白质修饰、加工和转运体系,经常用来表达具有特定结构功能的蛋白。由杆状病毒表达的重组蛋白在抗原性、免疫原性和功能上均与天然蛋白相似。因此,杆状病毒载体表达系统是研究蛋白的结构和功能的一个有力工具。本研究同时利用原核表达系统和杆状病毒表达系统分别表达PoIFN-γ并进行抗病毒活性分析,结果表明:与原核表达系统相比,杆状病毒表达系统可以对外源蛋白进行多种翻译后加工和修饰,表达的重组蛋白更接近天然结构。抗病毒活性检测表明经杆状病毒表达的PoIFN-γ的抗病毒活性可达105IU/mL,而原核表达PoIFN-γ经纯化后缓慢复性也会产生少量的二聚体,产生较低的抗病毒活性。本研究获得的重组PoIFN-γ为后续单克隆抗体的制备以及最终建立评价机体细胞免疫水平的检测 PoIFN-γ酶联免疫斑点法(Enzyme linked immunospot assay,ELISPOT)提供技术支持。

图5 VSV*GFP(A)或 VSV △ G *G(B)感染MDBK细胞产生的细胞病变Fig.5 Cytopathic effects(CPE)produced in MDBK cells infected with VSV*GFP(A)or VSV∆G*G(B).
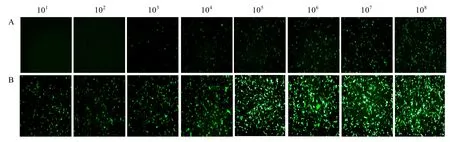
图6 重组杆状病毒表达的不同浓度PoIFN-γ对VSV△G*G感染MDBK细胞的抑制作用Fig.6 Inhibition of infection of VSV∆G*G in MDBK cells with differently diluted PoIFN-γ expressed from recombinant baculovirus.(A)Baculovirus-expressed recombinant PoIFN-γ protein of different dilutions.(B)Baculovirus-expressed recombinant E2 protein of CSFV of different dilutions.
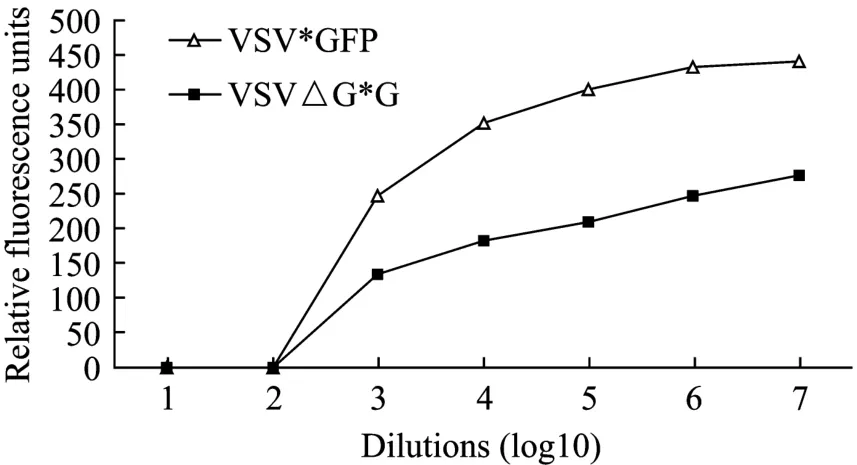
图7 利用两种病毒检测重组PoIFN-γ抗病毒活性的比较Fig.7 Comparison of recombinant PoIFN-γ antiviral activity using the two virus systems.
在众多干扰素生物学活性的研究方法中,AVA是最常用的检测方法[15],而且适用各种类型的干扰素,成本较低,一般实验室都具备进行抗病毒分析的条件,现在仍被广泛使用。AVA检测包含两方面的内容:抵抗病毒感染和抑制病毒复制。其中,抵抗病毒的感染是检测的基础,只有先抵抗病毒的侵染才能进一步抑制病毒的复制。AVA检测的判定时间对检测结果十分重要,检测一般都是在用病毒感染细胞20 h之后进行观测,这时主要测定的是干扰素对病毒的抗感染能力。若是以测定干扰素抑制病毒的复制能力为主,在加入病毒后不同的时间会出现不同的结果,对检测结果的准确性会有很大的影响。本研究采用复制缺陷型病毒作为指示病毒则解决了这一问题。AVA常用的指示病毒为VSV、脑炎心肌炎病毒(Encephalomyocarditis virus,EMCV)、塞姆利基森林病毒(Semliki forest virus,SFV)、辛德比斯病毒(Sindbis virus)、门戈病毒(Mengovirus)[12]等。其中VSV是最常用的病毒之一,它对干扰素很敏感,复制很快,在多种细胞株上都能够生长至很高滴度[21]。AVA常用的细胞系有MDBK、A549、WISH、HeLa、Hep2、FS4、FL、2D9和L929等。AVA判定方法有病毒复制抑制试验(Virus yield-reduction assay,VYRA)[22-24]、蚀斑抑制试验(Plaque reduction assay,PRA)[25]、病毒蛋白表达或RNA合成抑制试验等,但最常用的细胞病变抑制试验(Cytopathic effect reduction assay,CPERA)。VYRA需要滴定每个孔病毒的滴度,非常费时费力。而CPERA则相对简单,节省时间,使用也较为广泛。CPERA常采用半数CPE抑制作为IFN活性判断的终点,CPE可肉眼观察,但主观性太强以至于准确性较差,因此,大部分IFN定量工作者均采用细胞染色(结晶紫、MTT、MTS或萘酚蓝黑等)的方法,增加判断的准确性[15,25]。目前市场上有许多商品化的人和鼠干扰素的单克隆抗体,因此可以直接用ELISA检测干扰素的相对含量[26]。这不需要准备细胞,干扰素样品可以直接检测,操作方便。但其缺点是检测的是干扰素的抗原性,有抗原性而无活性的干扰素分子会影响干扰素活性的判断[27]。
反向遗传技术使得构建带有报告基因的VSV成为现实。在 VSV中插入 GFP获得重组病毒VSV*GFP,可以在病毒增殖时通过荧光显微镜观察GFP蛋白的表达而判断病毒的增殖情况,可以很容易地进行蚀斑计数,并可以使用荧光酶标仪对 GFP的表达进行定量[16]。2007年,陈伟业使用表达GFP的重组VSV(VSV*GFP)在MDBK细胞上进行了干扰素抗病毒活性滴定[17]。此方法在96孔细胞培养板上操作,通过GFP检测定量半数病毒复制抑制来替代通过细胞染色定量半数CPE抑制,利用仪器检测GFP的相对荧光值(RFU)来定量GFP蛋白的相对含量。这与细胞染色方法定量半数CPE相比,步骤得到极大简化。
VSV是人畜共患病原,涉及到 VSV的所有操作,包括具有增殖能力的重组病毒,均应有高等级的生物安全设施,因此测定干扰素活性所用病毒的安全性及实验结束后对环境及试剂与耗材的无害化处理问题越来越引起人们的疑虑。本研究利用表达GFP的复制缺陷型 VSV(VSV△G*G)来代替表达GFP的复制型重组VSV*GFP,分别对原核及杆状病毒表达的PoIFN-γ在MDBK细胞上进行了抗病毒生物活性测定。VSV△G*G是通过将外源表达VSV的G蛋白包装在缺失了G蛋白基因、携带GFP基因的VSV基因组中所获得的一种复制缺陷型病毒。与野生型病毒相比,其核酸分子上编码G蛋白的基因被删掉,因而不能复制,只有外源提供G蛋白后才能使其重新包装成为新的子代病毒,所以这种病毒在宿主细胞中只能进行“一个细胞周期”的感染,生物安全性高;同时由于该病毒不能进行复制,更有利于定量检测。本研究中利用复制缺陷型病毒VSV△G*G测定重组PoIFN-γ的抗病毒活性检测结果与利用复制型重组病毒 VSV*GFP的抗病毒活性检测结果完全符合,同时使用复制缺陷型病毒进行检测会避免检测结果随时间的改变而改变的问题,使得对干扰素的活性检测更为安全、准确。
REFERENCES
[1]Isaacs A, Lindenmann J.Virus interference I.The interferon.Proc R Soc Lond B:Biol Sci, 1957, 147(927):258−267.
[2]Cann AJ.Principles of Molecular Virology.Beijing:Science Press, 2006: 177−178.卡恩.分子病毒学原理.北京: 科学出版社, 2006:177−178.
[3]Willianms JG, Jurkovich GJ, Maier RV.Interferon-gamma:a key immunoregulatory lymphokine.Surg Res, 1993,54(1): 79−93.
[4]Chen XM, Xue QH, Zhu RG,et al.Comparison of antiviral activities of porcine interferon type I and type II.Chin J Biotech, 2009, 25(6): 806−812.陈雪梅, 薛清华, 祝荣格, 等.猪I型与II型干扰素的克隆、表达与抗病毒活性比较.生物工程学报, 2009,25(6): 806−812.
[5]Boehm U, Klamp T, Groot M.Cellular responses to interferon-gamma.Annu Rev Immunol, 1997, 15: 749−795.
[6]Godkin JD, Bazer FW, Moffatt J,et al.Purification and properties of a major, low molecular weight protein released by the trophoblast of sheep blastocyst at day 13-21.Reprod Fertil, 1982, 65(1): 141−150.
[7]Dijikmans R, Vandenbroeck K, Beaken E,et al.Sequence of the porcine interferon-gamma(IFN-gamma)gene.Nucleic Acids Res, 1990, 18(14): 42−59.
[8]Vandenbroeck K, Dijkmans R, van Aerschot A,et al.Engineering by PCR-based exon amplification of the genomic porcine interferon-γ DNA for expression inEscherichia coli.Biochem Biophys Res Commun, 1991,180(3): 1408−1415.
[9]Vandenbroeck K, Willems L, Billiau A,et al.Glycoform heterogeneity of interferon-gamma expressed in Sf9 cells.Lymphokine Cytokine Res, 1994, 13(4): 253−258.
[10]Cencic A, Lefevre F, Koren S,et al.Tertacyclin controlled expression of glycosylated porcine interferon-gamma in mammalian cells.Animal Biotechnol, 1999, 10(1/2):63−79.
[11]Guo YJ, Wu D, Chen RW,et al.Cloning, high level expression and purification of porcine IFN-γ.Chin J Biotech, 2001, 17(2): 183−186.郭瀛军, 吴丹, 陈蕊雯, 等.猪γ干扰素基因的克隆、表达及纯化.生物工程学报, 2001, 17(2): 183−186.
[12]Yan LP, Zhou YJ, Qiu HJ,et al.Expression of porcine interferon-γ and preparation of rabbit antisera against porcine interferon-γ.Chin J Prev Vet Med, 2004, 26(4):252−255.闫丽萍, 周艳君, 仇华吉, 等.猪 γ干扰素的体外表达及其多克隆抗血清的制备.中国预防兽医学报, 2004,26(4): 252−255.
[13]Qin LT, Wang XJ, Hu S,et al.Expression of porcine gamma-interferon in recombinant baculovirus and determination of its antiviral activity.Chin J Biotech,2007, 23(3): 386−391.秦立廷, 王喜军, 胡森, 等.猪 γ干扰素在重组杆状病毒中的表达及其抗病毒活性的测定.生物工程学报,2007, 23(3): 386−391.
[14]Qin LT.Cloning and expression of bovine, chicken,porcine interferon-gamma and production of monoclonal antibodies.Tai’an: Shandong Agricultural University, 2006.秦立廷.牛、鸡和猪γ-干扰素的克隆表达与单克隆抗体的研制.泰安: 山东农业大学, 2006.
[15]Pestka S, Meager A.Interferon standardization and designations.J Interferon Cytokine Res, 1997, 17(Supp1):S9−14.
[16]Wen ZY, Ge JY, Hu S,et al.Rescue of a recombinant vesicular stomatitis virus expressing enhanced green fluorescent protein.Chin J Prev Vet Med, 2007, 29(12):905−910.温志远, 葛金英, 胡森, 等.表达增强绿色荧光蛋白重组水疱性口炎病毒印第安纳株的构建.中国预防兽医学报, 2007, 29(12): 905−910.
[17]Chen WY.Generation of several CHO cell lines stably expressing bovine, porcine and chicken beta interferon and evaluation of their bioactivity.Nanjing: Nanjing Agricultural University, 2007.陈伟业.重组牛、猪和鸡β干扰素在CHO细胞中的高效稳定表达及其生物学活性研究.南京: 南京农业大学, 2007.
[18]Ge J, Wen Z, Wang X,et al.Generating vesicular stomatitis virus pseudotype bearing the severe acute respiratory syndrome coronavirus spike envelope glycoprotein for rapid and safe neutralization test or cell-entry assay.Ann N Y Acad Sci, 2006, 1081: 246−248.
[19]Hou Q, Peng WP, Sun Y,et al.Expression of the truncated E2 protein of classical swine fever virus inEscherichia coliand preparation of a monoclonal antibody against the E2 protein.Vet Sci China, 2008, 38(1): 6−10.侯强, 彭伍平, 孙元, 等.猪瘟病毒E2蛋白主要抗原区编码基因的原核表达及其单克隆抗体的制备.中国兽医科学, 2008, 38(1): 6−10.
[20]Kenji M, Akihiko U, Takehiro K,et al.Production of biologically active recombinant bovine interferon-γ by two different baculovirus gene expression systems using insect cells and silkworm larvae.Cytokine, 2001, 13(1):18−24.
[21]Goorha RM.Preparation and assay of vesicular stomatitis virus.Methods Enzymol, 1981, 78(Pt A): 309−312.
[22]Weigent DA, Stanton GJ, Langford MP,et al.Virus yield-reduction assay for interferon by titration of infectious virus.Methods Enzymol, 1981, 78(Pt A): 346−351.
[23]Stanton GJ, Langford MP, Dianzani F.Virus yieldreduction assay for interferon by titration of Sindbis virus hemagglutinin.Methods Enzymol, 1981, 78(Pt A):351−357.
[24]Jameson P, Grossberg SE.Virus yield-reduction assays for interferon: picornavirus hemagglutination measurements.Methods Enzymol, 1981, 78(Pt A): 357−368.
[25]Ferreira PC, Peixoto ML, Silva MA,et al.Assay of human interferon in vero cells by several methods.J Clin Microbiol, 1979, 9(4): 471−475.
[26]Garrison TL, Hung F, Izotova L,et al.ELISA measurement of interferons.Biotechniques, 2002, Suppl:98−100.
[27]Diaz de Arce H, Artursson K, L’Haridon R,et al.A sensitive immunoassay for porcine interferon-alpha.Vet Immunol Immunopathol, 1992, 30(4): 319−327.
Expression of porcine interferon-γ and its safe antiviral assay
Fan He1,2, Yuan Sun1, Jinying Ge1, Miao Li1, Tianming Chang1, Zhigao Bu1, and Huaji Qiu1
1 State Key Laboratory of Veterinary Biotechnology, Harbin Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Harbin 150001, China 2 College of Animal Science and Animal Medicine, Inner Mongolia Agricultural University, Hohhot 010018, China
Received:November 20, 2009;Accepted:January 28, 2010
Supported by:National Basic Research Program of China(973 Program)(No.2005CB523202).
Corresponding author:Huaji Qiu.Tel: +86-451-85935041; E-mail: huajiqiu@hvri.ac.cn国家重点基础研究发展计划(973计划)(No.2005CB523202)资助。
